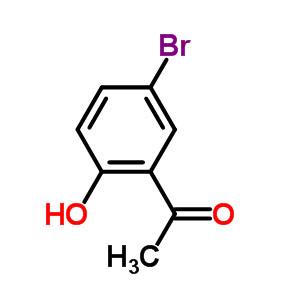
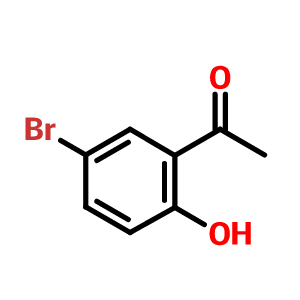
2-羟基-5-溴苯乙酮的制备及其应用
发布日期:2022/9/2 14:32:09
基本描述
2-羟基-5-溴苯乙酮的CAS号是1450-75-5,分子式为C8H7BrO2,以及分子量是215.04g/mol。熔点是58-61 °C(lit.),沸点为135-143 °C(Press: 16 Torr)和密度是1.586±0.06 g/cm3(Predicted)。此外,2-羟基-5-溴苯乙酮的酸度系数(pKa)是9.59±0.18(Predicted)。
合成

图1 2-羟基-5-溴苯乙酮的合成路线[1]。
步
在室温下搅拌10分钟,向4-溴苯酚(1c)(173.1克,1摩尔)和乙酸酐(102克,1 mol)的混合物中加入三滴浓H2SO4。混合物在搅拌下倒入水(500毫升)中,用乙酸乙酯(10×50毫升)萃取。合并的提取物用无水硫酸钠干燥,减压蒸发。2c。
第二步
将粉末状无水AlCl3(186g,1.4mol)在冰水浴中的圆底烧瓶中逐渐加入2c(150.5g,0.7mol)。将所得混合物在油浴中加热至120°C 6小时。然后向反应混合物中加入大量碎冰用于水解。混合物用乙酸乙酯萃取。在无水硫酸钠上干燥后,在减压下除去溶剂,并使用石油醚/乙酸乙酯作为洗脱剂通过硅胶层析纯化所得目标化合物2-羟基-5-溴苯乙酮。
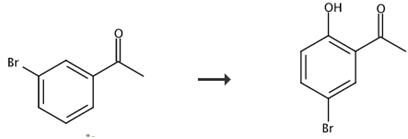
图2 2-羟基-5-溴苯乙酮的合成路线[2]。
将Pd(OAc)2 (10.0 mol%)、PhI(OTFA)2 (1.0 mmol)、苯乙酮或对取代苯乙酮(p-OMe、p-Me、p-Cl、p-Br) (0.5 mmol)和DCE (2.0 mL)在空气中,在特氟乙烯包覆磁搅拌棒存在下装入带隔膜的反应管中。将管置于预热的油浴(80℃)中搅拌1 h,加入乙酸乙酯(~2 mL)、十二烷(113 μL,内标)和水。对有机层进行气相色谱分析。最终得到产品2-羟基-5-溴苯乙酮。
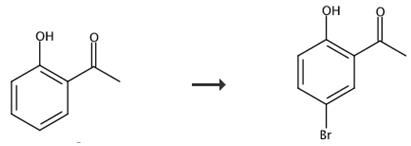
图3 2-羟基-5-溴苯乙酮的合成路线[3]。
将5 mmol底物加入5 mL含5 mmol KBr的水中。室温搅拌1 min后,搅拌下用均压滴筒滴入30 mmol 30% H2O2。当反应开始时,向上述混合物中加入催化剂V-MCM-41 (25 mg),然后加入70% HClO4 (2 mmol)。采用薄层色谱法(TLC)监测反应过程。待TLC板上起始物质消失或无变化后,对催化剂进行过滤,并对反应内容物进行多次醚萃取。用饱和碳酸氢钠溶液冲洗组合滤液。有机提取物在无水硫酸钠上干燥,减压蒸发溶剂。粗产物经结晶或硅胶柱层析(60 - 120目)纯化。产物纯度经核磁共振氢谱确证,气相色谱定量。条件:2,产量(Wt %): 99,时间(h): 3。对有机层进行核磁共振分析。最终确定其结构是2-羟基-5-溴苯乙酮。
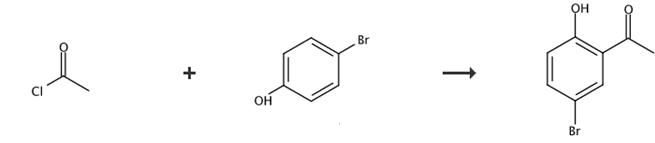
图4 2-羟基-5-溴苯乙酮的合成路线[4]。
步骤1:在无水氯化铝(84.0 g, 0.49 mol)的二氯甲烷(1200ml)悬浮液中加入乙酰氯(49.2 g, 0.63 mol),搅拌并冰上冷却。混合搅拌20分钟,在冰上冷却,然后加入4-溴苯酚(98 g, 0.57 mol)。将反应混合物在室温下搅拌1小时,然后加入冰水。用乙酸乙酯萃取反应混合物。结合的有机层用盐水冲洗,在无水硫酸钠上干燥。减压蒸馏溶剂后,用硅胶柱层析纯化残渣,得到4-溴苯乙酸酯(104.0 g, 85%)。1 H-nmr (CDCl3): 2.28(年代,3 H), 6.98 (d, 2 H), 7.48 (d, 2 H)。
步骤2:将4-溴苯乙酸酯(104 g, 0.484 mol)和无水氯化铝(130.5 g, 0.968 mol)的混合物在120-140℃搅拌20分钟。将反应混合物冷却至60-80℃。加入冰水,用乙酸乙酯萃取。有机层用盐水冲洗,在无水硫酸钠上干燥。减压蒸馏溶剂后,用硅胶柱层析纯化残渣,得到1-(5-溴-2-羟基苯基)-乙烷(101 g,98%)。 1H-NMR (CDCl3): 2.60 (s, 3H), 6.87 (d, 1H), 7.53 (dd, 1H), 7.81 (s, 1H), 12.12 (s, 1H).
应用
苯乙酮类化合物(Acetophenones)是一类广泛存在于自然界的天然产物,常见于各种高等植物及一些不同属真菌的次级代谢产物中[5-6]。该类化合物具有广泛的生物活性,如抗菌、抗癌、消炎、治疗高脂血症、肥胖症和免疫调节等,在农药和医药领域中有极其重要的意义[7-8]。其中的2-羟基-5-溴苯乙酮作为一种重要的化工原料,是合成其他药物及香料的中间体,工业上广泛应用于树脂、纤维素醚和纤维素醚的合成,也可用作塑料的增塑剂,作为香料,用于制造香烟和香皂的香精,还可作为有机合成反应的中间体,表面处理剂和催化剂[9-11]。
参考文献
[1] J.-F. Chen, Z.-Q. Liu, Ferrocenyl-Appended Aurone and Flavone: Which Possesses Higher Inhibitory Effects on DNA Oxidation and Radicals?, Chem. Res. Toxicol. 28(3) (2015) 451-459.
[2] K.P. Kakade, S.P. Kakade, S.Y. Deshmukh, Synthesis and characterization of some bromo substituted chalcone by the green synthesis way (grinding method) and aurones 2-benzylidine-1-benzofuran-3-one by cyclization method, World J. Pharm. Pharm. Sci. 4(1) (2015) 1591-1597.
[3] S.R. Kelode, P.R. Mandlik, Synthesis, characterization and antimicrobial studies of Co(II), Ni(II), Cu(II), Cr(III), Mn(III), Fe(III), VO(IV), Zr(IV) and UO2(VI) with tetradentate Schiff base having N2O2 donor group, J. Chem. Pharm. Res. 4(9) (2012) 4181-4184.
[4] S.R. Kelode, P.R. Mandlik, A.S. Aswar, Synthesis of hydrazone Schiff bases and microbiological evaluation of isonicotinoyl hydrazide with different acetophenones, Orient. J. Chem. 27(3) (2011) 1053-1062.
[5] J. Kido, J.G. Lee, T. Takeda, 3-(hydroxyphenyl)-4,5-diazaphenanthrolines, their lithium complexes, and electron transporting and injecting materials, and organic electroluminescent devices using the complexes, Chemipro Kasei Ltd., Japan . 2008, p. 33pp.
[6] X. Liu, J. Zou, P. Zhan, Preparation of Ligustrazine chalcone derivatives as antioxidant, Shandong University, Peop. Rep. China . 2018, p. 14pp.
[7] M. Shoaib, S.W.A. Shah, M. Ghias, N. Ali, N. Umar, I. Shah, Shafiullah, M. Nisar, T. Jan, M.N. Tahir, Synthesis, crystal studies and biological evaluation of flavone derivatives, Pak. J. Pharm. Sci. 33(1) (2020) 11-20.
[8] X. Tang, Y. Zhao, Q. Lin, T. Yang, Preparation method of 5-bromobenzofuranone using 2-bromo-1-(5-bromo-2-hydroxyphenyl)-ethanone, Bayecao Health Industry Research Institute Xiamen Co., Ltd., Peop. Rep. China; Huaqiao University . 2022, p. 11pp.
[9] M. Varasi, F. Thaler, A. Abate, C. Bigogno, R. Boggio, G. Carenzi, T. Cataudella, R. Dal Zuffo, M.C. Fulco, M.G. Rozio, A. Mai, G. Dondio, S. Minucci, C. Mercurio, Discovery, Synthesis, and Pharmacological Evaluation of Spiropiperidine Hydroxamic Acid Based Derivatives as Structurally Novel Histone Deacetylase (HDAC) Inhibitors, J. Med. Chem. 54(8) (2011) 3051-3064.
[10] M. Varasi, F. Thaler, A. Abate, G. Carenzi, C. Mercurio, S. Minucci, Preparation of oxospirochromanepiperidine derivatives and analogs for use as histone deacetylase inhibitors, DAC S.r.l., Italy . 2009, p. 40pp.
[11] M. Varasi, F. Thaler, A. Abate, G. Carenzi, S. Minucci, Preparation of oxospirochromanepiperidine derivatives and analogs for use as histone deacetylase inhibitors, DAC S.r.l., Italy; Mercurio, Ciro . 2009, p. 142pp.
欢迎您浏览更多关于2-羟基-5-溴苯乙酮的相关新闻资讯信息