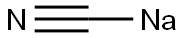-
外観
白色〜わずかにうすい黄色, 結晶〜粉末又は板状
-
溶解性
水に極めて溶けやすく、エタノールに溶けにくい。
-
解説
シアン化ナトリウム,青酸ソーダ(sodium prussiate)ともいう.以前は溶融したナトリウムにアンモニアを反応させてナトリウムアミドNaNHをつくり,これに赤熱したCを反応させると得られた.現在は,シアン化水素HCNが多量に得られるので,これとNaOHとの反応でつくられる.
-
性質
シアン化ナトリウム,無色の立方晶系結晶.塩化ナトリウム型構造.C-N約1.1 Å.無水物は,密度1.86 g cm-3.融点563.7 ℃,沸点1496 ℃.乾燥空気中では370 ℃ まで安定である.潮解性があり,水に易溶.水溶液は加水分解のために強アルカリ性を示す.酸で(CO2でも)HCNを発生する.水溶液は空気の存在下で金,銀を溶かす.また,水酸化鉄(Ⅱ)と加熱するとNa4[Fe(CN)6]を生じる.水溶液を濃縮すると,二水和物の単斜晶系の結晶が得られる.硝酸塩などの強酸化剤と混合すると爆発することがある.
-
用途
金の青化製錬、顔料(紺青)の原料、非鉄金属から銅及び銀などの抽出メッキ、金属の焼入れ、写真薬、還元剤、ビニリデン樹脂、医薬品メチオニン、黄血塩、分析用試薬
-
製法
シアン化ナトリウムは、シアン化水素を水酸化ナトリウムで処理することによって生成されます。水溶液中ではシアン化物イオンとナトリウムイオンに電離しています。
HCN+NaOH→NaCN+H2O
以前は、ナトリウムアミドと炭素を高温で反応させるカストナー法によって調製されていました。
NaNH2+C→NaCN+H2
-
応用
シアン化ナトリウム,代表的なシアン化物として有機合成,医薬品,農薬,顔料などの原料,金,銀の青化法による精錬,めっき,鋼の焼入れ,写真,殺虫剤,分析試薬などに広く用いられる.猛毒.
-
使用上の注意
潮解性あり。酸及び光によって分解する。
-
説明
Sodium cyanide, NaCN, is a cyanide salt that is a white, deliquescent, crystalline powder and is soluble in water. The specific gravity is 1.6, which is heavier than water. Sodium cyanide is toxic by inhalation and ingestion, with a TLV of 4.7 ppm and 5 mg/m3 of air. The target organs are the cardiovascular system, central nervous system, kidneys, liver, and skin. Reactions with acids can release flammable and toxic hydrogen cyanide gas. Cyanides are incompatible with all acids. The four-digit UN identification number is 1689.
The NFPA 704 designation is health 3, flammability 0, and reactivity 0. The primary uses are in gold and silver extraction from ores, electroplating, fumigation, and insecticides.
-
化学的特性
Sodium cyanide is found as white granules, flakes or lumps. Sodium cyanide is shipped as pellets or briquettes. Odorless when dry. It absorbs water from air (is hygroscopic or deliquescent). Hydrogen cyanide gas released by sodium cyanide has a distinctive mild, bitter almond odor, but a large proportion of people cannot detect it; the odor does not provide adequate warning of hazardous concentrations.
-
物理的性質
Physical Properties White cubic crystals; hygroscopic; density 1.6 g/cm3; melts at 563°C; very soluble in water; aqueous solution strongly alkaline and decomposes rapidly.
-
使用
Sodium cyanide is used for electroplating metals such as zinc, copper, cadmium, silver, and gold, and their alloys; for extracting gold and silver from ores; and as a fumigant and a chelating agent. It occurs in many varieties of maniocs (cassava), especially in bitter manioc.
-
定義
sodium cyanide: A white orcolourless crystalline solid, NaCN,deliquescent, soluble in water and inliquid ammonia, and slightly solublein ethanol; cubic; m.p. 564°C; b.p.1496°C. Sodium cyanide is now madeby absorbing hydrogen cyanide insodium hydroxide or sodium carbonatesolution. The compound is extremelypoisonous because it reacts with the iron in haemoglobin in theblood, so preventing oxygen reachingthe tissues of the body. It is used inthe extraction of precious metals andin electroplating industries. Aqueoussolutions are alkaline due to salt hydrolysis.
-
製造方法
Sodium cyanide can be prepared by several methods (See Potassium Cyanide).
It is prepared by passing hydrogen cyanide through a 50% aqueous solution of sodium hydroxide followed by evaporation of the solution in vacuum: NaOH + HCN → NaCN + H2O
Another method is to reduce sodamide with carbon at red heat: NaNH2 + C → NaCN + H2↑
Also, sodium cyanide can be made by heating a mixture of sodium carbonate and carbon with ammonia at high temperatures: Na2CO3 + 4C + 2NH3 → 2NaCN + 3CO↑ + 3H2↑.
-
調製方法
Sodium cyanide was first prepared in 1834 by heating
Prussian Blue, a mixture of cyanogen compounds of iron,
and sodium carbonate and extracting sodium cyanide from
the cooled mixture using alcohol. Sodium cyanide remained
a laboratory curiosity until 1887, when a process was patented
for the extraction of gold and silver ores by means of a dilute solution of cyanide.
-
反応性
Sodium cyanide, NaCN, white solid, soluble, very poisonous, formed (1) by reaction of sodamide and carbon at high temperature, (2) by reaction of calcium cyanamide and sodium chloride at high temperature, reacts in dilute solution in air with gold or silver to form soluble sodium gold or silver cyanide, and used for this purpose in the cyanide process for recovery of gold. The percentage of available cyanide is greater than in potassium cyanide previously used. Used as a source of cyanide, and for hydrocyanic acid.
-
一般的な説明
A clear colorless aqueous solution.
-
空気と水の反応
Slowly evolves flammable and poisonous hydrogen cyanide gas.
-
反応プロフィール
Sodium cyanide is weakly basic. Reacts with acids of all kinds to generate quantities of very poisonous hydrogen cyanide gas. Incompatible with strong oxidizing agents, especially if solution dries out. Gives insoluble products with silver(I), mercury(I) and lead(II) ions that may decompose violently under certain conditions.
-
危険性
Toxic by ingestion and inhalation.
-
健康ハザード
Sodium cyanide is a white crystalline solid that is odorless when dry, but emits a slight
odor of hydrogen cyanide in damp air. It is slightly soluble in ethanol and formamide. It is very poisonous. It explodes if melted with nitrite or chlorate at about 450°F. It produces
a violent reaction with magnesium, nitrites, nitrates, and nitric acid. On contact with acid,
acid fumes, water, or steam, it produces toxic and flammable vapors. Synonyms for sodium
cyanide are hydrocyanic acid, sodium salt, and cyanide of sodium.
-
燃焼性と爆発性
Sodium cyanide and potassium cyanide are noncombustible solids. Reaction with
acids liberates flammable HCN.
-
化学反応
シアン化物プロセスとしても知られる金シアン化反応は、金を抽出するための主要な技術であり、低品位の鉱石から金を得ることができます。この方法は、金とシアン化物との高い親和性を利用し、空気 (酸素) と水の存在下で金を酸化および溶解させ、ジシアノ金酸ナトリウムを生成します。
4Au+8NaCN+O2+2H2O→4Na[Au(CN)2]+4NaOH
同様に、シアン化カリウム (KCN) を使用すると、ジシアノ金酸カリウム (KAu(CN)2) を生成します。
-
法規情報
シアン化ナトリウムは、労働基準法で「疾病化学物質」、労働安全衛生法で「名称等を表示・通知すべき危険有害物」、「リスクアセスメントを実施すべき危険有害物」「特定化学物質第2類物質」などに該当します。化学物質排出把握管理促進法 (PRTR法) では「第1種指定化学物質」、毒物及び劇物取締法では「毒物」、消防法では非危険物質ではありますが「消防活動阻害物質」に指定されており、使用の際には注意が必要です。
-
保存と取り扱いに関する注意事項です
取扱い及び保管上の注意は、下記の通りです。
- 保管容器は、換気の良い冷暗所で保管する。
- 屋外や換気の良い区域のみで使用する。
- 使用時は保護手袋、保護眼鏡、保護衣、保護面を着用する。
- 水溶液は塩基性で酸と激しく反応するため、接触を避ける。
- 空気中の二酸化炭素や湿気、または酸、水、アルカリ性炭酸塩と接触すると有毒なシアン化水素ガスを発生するため、接触を避ける。
- 取扱い後はよく手を洗浄する。
- 吸入した場合、空気の新鮮な場所に移し、呼吸しやすい姿勢で休息させ、医師に連絡する。
- 皮膚に付着した場合は、多量の水と石鹸で洗い流し、医師の手当を受ける。
- 眼に入った場合は、水で数分間注意深く洗う。
参考文献
-
使用用途
シアン化ナトリウムは、酸と反応させることでシアン化水素を発生させるため、金属などのメッキに使用されています。また、鋼の焼入れ、金・銀の冶金、有機合成の中間体の製造、シアン化物・シアノ錯塩の製造、農薬などに広く用いられています。
農薬として散布すると、有効成分は速やかにとアンモニアに分解されます。また、シアン化ナトリウムは浸透移行性がないため、作物体への移行がありません。
アルカリ性浴のシアン化銅浴、ピロリン酸銅浴は均一電着性に優れ、その特性を利用して広く利用されています。シアン化銅浴は、複雑な形状の、アルミニウムダイカストの下地としてメッキに利用されています。
シアン化ナトリウムは毒性が強いため、昆虫学者が使用する瓶への収集など、急速に殺したり気絶させたりするために使用されます。
-
化学性质
水和物と二水和物があり,市販品は水和物の白色固体,水に溶解し,強アルカリを呈する
-
工業用途
sodium
cyanide and other water-soluble cyanides are used as modifying reagents for selective
flotation of ores containing galena, sphalerite and gangue minerals.
-
職業ばく露
Sodium cyanide is used as a solid or in solution to extract metal ores, in electroplating and metal cleaning baths; in metal hardening; in treatment of rabbit and rat burrows and holes and termite nests; in insecticides
-
貯蔵
In
particular, work with cyanides should be conducted in a fume hood to prevent
exposure by inhalation, and splash goggles and impermeable gloves should be worn
at all times to prevent eye and skin contact. Cyanide salts should be stored in a cool,
dry location, separated from acids.
-
輸送方法
UN1689 Sodium cyanide, Hazard Class: 6.1; Labels: 6.1-Poisonous materials.
-
合成方法
金属ナトリウムを木炭と混合し,550℃以上でアンモニアガスと反応させる。また,シアン化水素の合成法とともに水酸化ナトリウムと反応させて製造される
-
不和合性
Sodium cyanide decomposes on contact with acids, acid salts, water, moisture, alcohols, and carbon dioxide, releasing highly toxic and flammable hydrogen cyanide gas. Aqueous solution is a strong base; it reacts violently with acid and is corrosive. Incompatible with oxidizers (chlorates, nitrates, peroxides, permanganates, perchlorates, chlorine, bromine, fluorine, etc.); contact may cause fires or explosions. Keep away from alkaline materials, strong bases, strong acids, oxoacids, epoxides. Absorbs moisture from the air forming a corrosive syrup. Corrosive to active metals, such as aluminum, copper, and zinc. Under acid conditions, sarin hydrolyzes to form hydrofluoric acid.
-
廃棄物の処理
Consult with environmental regulatory agencies for guidance on acceptable disposal practices. Generators of waste containing this contaminant (≥100 kg/mo) must conform to EPA regulations governing storage, transportation, treatment, and waste disposal. In accordance with 40CFR165, follow recommendations for the disposal of pesticides and pesticide containers. Must be disposed properly by following package label directions or by contacting your local or federal environmental control agency, or by contacting your regional EPA office. Add strong alkaline hypochlorite and react for 24 hours. Then flush to sewer with large volumes of water.