-
外観
白色粉末~結晶
-
定義
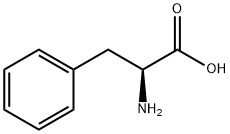
本品は、次の化学式で表されるアミノ酸である。
-
性質
フェニルアラニンは白色の結晶で、少量の水には溶けますが、エタノールなどの有機溶媒には溶けにくい特性があります。約283℃で分解融解します。100分の1 水溶液の pHは5.4から6.0の間で、酸性をしめします。
フェニルアラニンは人工甘味料アスパルテームの原料になりますが、それ自体には苦みがあります。光学異性体のD-フェニルアラニンは甘味があります。
-
解説
L-フェニルアラニン,単斜晶系板状あるいは小葉状結晶.分解点283 ℃.[α]D20"-35.1°(水).pK1 2.26,pK2 9.19(25 ℃),pI5.48.水に微溶,エタノールに難溶.苦味を呈する.必須アミノ酸で栄養剤として用いられ,動物体内でチロシンはフェニルアラニンからつくられる.DL-フェニルアラニンはフェニルアセトアルデヒドのストレッカーのアミノ酸合成や,α-ブロモ-β-フェニルプロピオン酸のアミノ化により合成する.白色の結晶.融点271~273 ℃.D-フェニルアラニンは微生物界に存在する.
森北出版「化学辞典(第2版)
-
構造
フェニルアラニンはベンゼン環を持つアミノ酸です。アラニンの側鎖の水素原子がフェニル基で置き換えられた構造を持っています。実際、フェニルアラニンという名前もこの構造に由来しています。
-
化粧品の成分用途
ヘアコンディショニング剤、皮膚コンディショニング剤
-
合成
植物や多くの微生物で、糖代謝産物であるプレフェン酸からシキミ酸を経て生合成されます。プレフェン酸が脱炭酸されると同時にヒドロキシ基を失うとフェニルピルビン酸になります。フェニルピルビン酸がアミノ基転移を受け、フェニルアラニンと α-ケトグルタル酸が生成します。
ほとんどの芳香族生体分子合成はこの経路によっており、このシキミ酸経路をもたない哺乳動物では体内で合成することができません。人間はこのシキミ酸経路を持たないので、フェニルアラニンは必須アミノ酸の1つとして分類されます。
-
製造
L-フェニルアラニン,略号PheまたはF.タンパク質構成アミノ酸として,また遊離の形で自然界に広く分布している.おもに発酵法でつくられる.
-
効能
フェニルアラニン補充薬
-
化学的特性
L-Phenylalanine has no odor and a slight bitter taste. It melts with decomposition at about 283°C. The pH of a 1 in 100
solution is between 5.4 and 6.0. FEMA notes this chemical is used in cocoa substitute only.
-
天然物の起源
Reported found in white bread, macaroni, egg noodles, corn flakes, corn grits, oatmeal, wheat bran, wheat
flakes, shredded wheat, barley, brown rice, rye flour, whole grain wheat flour, buttermilk, blue cheese, cheddar cheese, cottage
cheese, cream cheese, parmesan cheese, bacon, cured ham, frankfurters, pork sausage, canned red kidney beans, canned sweet corn,
canned peas, canned lima beans, canned potatoes, canned asparagus, canned snap beans, canned beets, beef, lamb, fresh ham, veal
round, beef liver, chicken, chicken liver, turkey and other natural sources.
-
使用
L-Phenylalanine is an essential amino acid. L-Phenylalanine is biologically converted into L-tyrosine, another one of the DNA-encoded amino acids, which in turn is converted to L-DOPA and further conv
erted into dopamine, norepinephrine, and epinephrine. L-Phenylalanine is produced for medical, feed, and nutritional applications such as in the preparation of Aspartame.
-
調製方法
In previous large-scale production processes for L-phenylalanine two enzymatic methods were applied: 1. Resolution of N-acetyl-D,L-phenylalanine by carrier-fixed microbial acylase: This process provided pharmaceutical-grade L-phenylalanine, but suffered from the disadvantage that the D-enantiomer had to be racemized and recycled. 2. Stereoselective and enantioselective addition of ammonia to trans-cinnamic acid, catalyzed by L-phenylalanine ammonia lyase (PAL, EC 4.3.1.5): PAL-containing Rhodotorula rubra was used in an industrial process to supply L-phenylalanine for the first production campaign of the sweetener aspartame. When continuously operated in an immobilized whole cell reactor, the bioconversion reached concentration up to 50 g/L Lphenylalanine at a conversion of about 83%. Other processes started from phenylpyruvate with L-aspartic acid as amine donor using immobilized cells of Escherichia coli or from a-acetamidocinnamic acid and immobilized cells of a Corynebacterium equi strain. In both cases L-phenylalanine concentrations up to 30 g/L and more (molar yields as high as at least 98 %) were reached.
However, fermentation processes based on glucose-consuming L-phenylalanine overproducing ;mutants of E. coli and coryneform strains turned out to be more economical. L-Phenylalanine is formed in ten enzymatic steps starting from erythrose-4-phosphate and phosphoenolpyruvate. A suitable profile of the specific glucose feed rate prevents acetate formation and leads to improved L-phenylalanine production with a final concentration up to 46 g/L and a corresponding yield of 18 %.
L-Phenylalanine is recovered from the fermentation broth either by two-step crystallization or by an ionexchange resin process. The preferred cell separation technique is ultrafiltration; and the filtrates may be treated with activated carbon for further purification. Instead of ion-exchange resins nonpolar, highly porous synthetic adsorbents are recommended to remove impurities. An alternative process in which a cell separator is integrated in the fermentation part, thus allowing cell recycling, was suggested for L-phenylalanine production and may lead to prospective developments.
-
定義
ChEBI: The L-enantiomer of phenylalanine.
-
製造方法
From PTS-negative Escherichia coli bioengineered strains.
-
一般的な説明
Odorless white crystalline powder. Slightly bitter taste. pH (1% aqueous solution) 5.4 to 6.
-
空気と水の反応
Water soluble. Aqueous solutions are weak acids.
-
反応プロフィール
L-Phenylalanine may be light sensitive. Act as weak acids in solution.
-
健康ハザード
ACUTE/CHRONIC HAZARDS: When heated to decomposition L-Phenylalanine emits toxic fumes of nitrogen oxides.
-
火災危険
Flash point data for L-Phenylalanine are not available; however, L-Phenylalanine is probably combustible.
-
使用用途
フェニルアラニンは、人工甘味料であるアスパルテームの原料として利用されます。
また、体内でドーパミンやノルアドレナリンなどの神経伝達物質の材料として利用されます。これらの物質は、精神を高揚させたり、血圧を上昇させたりする効果を持っています。そのため、うつ病の改善効果などが期待されています。
化粧品としてヘアコンディショニング剤、皮膚コンディショニング剤に使用されます。コンディショニング剤とは皮膚の水分の蒸発を防ぎ、保湿性を与えて皮膚や毛髪を保護するための原料のことです。
-
そ他情報
フェニルアラニンから生成される物質
アスパルテーム
人工甘味料であるアスパルテームは、フェニルアラニンとアスパラギン酸のジペプチド誘導体です。ジペプチド誘導体は、2つのアミノ酸がアミド結合によって結びついたアミノ酸ポリマーのことです。具体的には、フェニルアラニンのアミノ基がアスパラギン酸のカルボキシル基とアミド結合を形成することで、アスパルテームが生成します。
チロシン
フェニルアラニンは肝臓でチロシンに代謝されます。フェニルアラニンのパラ位にヒドロキシ基が置換された分子はチロシンと呼ばれ、タンパク質中のチロシン残基のリン酸化は生体内の情報伝達機構において非常に重要な役割を果たしています。
また、チロシンへのヒドロキシ化反応を触媒する酵素が欠損することで、フェニルアラニンが正常に代謝できなくなる遺伝病がフェニルケトン尿症です。この病気は幼児期に発症し、低フェニルアラニン食などの治療が必要ですが、現在では新生児の血液検査で早期発見が可能です。
-
安全性プロファイル
Mildly toxic by intraperitoneal route. An experimental teratogen. Experimental reproductive effects. Human mutation data reported. When heated to decomposition it emits toxic fumes of NOx.
-
概要
必須アミノ酸の一種.植物では,アルカロイド,フラボノイド,リグニンなどの生合成前駆体
-
純化方法
Likely impurities are leucine, valine, methionine and tyrosine. Crystallise L-phenylalanine from water by adding 4volumes of EtOH. Dry it in vacuo over P2O5. Also crystallise it from saturated refluxing aqueous solutions at neutral pH, or 1:1 (v/v) EtOH/water solution, or conc HCl. It sublimes at 176-184o/0.3mm with 98.7% recovery and unracemised [Gross & Gradsky J Am Chem Soc 77 1678 1955]. [Greenstein & Winitz The Chemistry of the Amino Acids J. Wiley, Vol 3 pp 2156-2175 1961, Beilstein 14 IV 1552.]