
5YR企业会员
发布人:上海优宁维生物科技股份有限公司
发布日期:2026/2/6 16:42:30
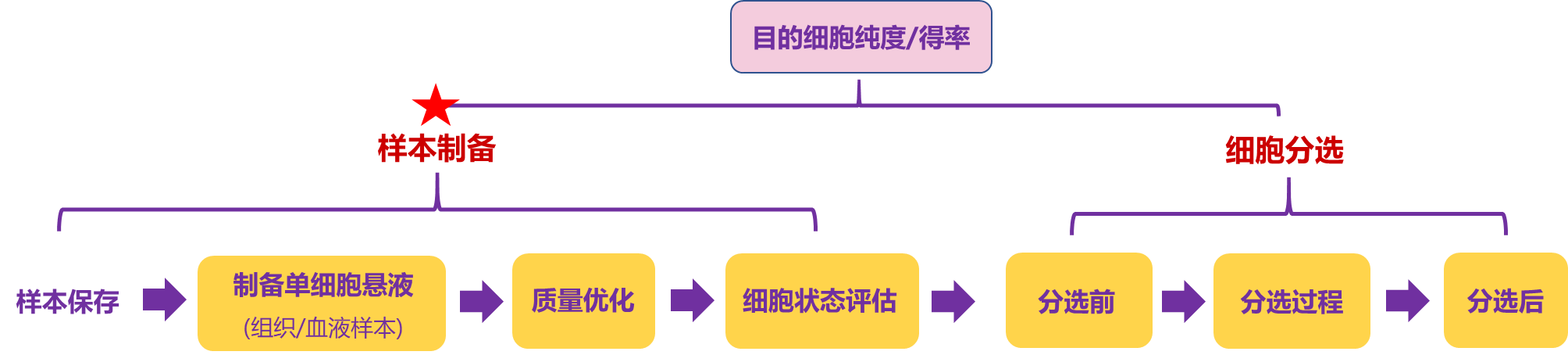
目的细胞的纯度与得率,是 “样本制备” 与 “细胞分选” 两大环节紧密衔接、共同作用的结果。
样本制备是分选的 “源头地基”:从组织保存、解离到预分选处理,每一步都为后续分选奠定基础;而细胞分选本身,也需系统兼顾分选前准备、过程操作与分选后处理的全程细节。只有两端同时优化,才能实现高纯度、高得率的稳定结果。本期我们将聚焦样本制备全流程,拆解易被忽略的重要操作细节,助您从源头提升分选效能,攻克实验痛点! (分为上下两篇噢)
样本保存
单细胞悬液制备过程中,样本获取后若无法及时处理或需短途运输,需进行特殊保存处理,否则会影响细胞状态进而直接影响细胞活率,导致后续分选实验的得率和纯度下降。样本保存特殊处理建议如下:
组织样本
组织样本通常指非液体组织来源,可用商品化组织保存液保存,将组织完全浸于保存液中,4℃保存或运输,可保证至少48h内细胞活性无改变,极大降低细胞凋亡或死亡。
重要操作Tips:
(1)根据组织块大小选择对应体积离心管,保证组织与保存液充分接触,避免管体过大导致保存液浪费,过小则组织无法完全浸没,局部细胞易干燥坏死。
(2)组织无需剪切,直接放入保存液中,否则会破坏细胞间连接,增加解离难度。
血液样本
血液样本可使用含特定抗凝剂如肝素钠(abs47014863)等抗凝管保存,可保证至少24小时内细胞活性与免疫学特性稳定,有效避免细胞死亡及活力下降。
重要操作Tips:
(1)使用抗凝管收集血液样本后应立即轻柔颠倒抗凝管5-8 次,使抗凝剂与血液充分接触,避免剧烈震荡,否则会导致溶血。
(2)不同类型抗凝管保存时间有所不同,需根据实验需求进行选择。如无法在规定时间内完成单细胞悬液制备,可将目标细胞分离出来,使用细胞冻存液程序性降温后进行长期冻存。
(3)血液样本收集完成后,应在室温下直立保存运输,且需及时检测样本质量,避免因样本降解、细胞损伤影响后续分选结果,同时需严格排查微生物污染,防止污染导致实验失败或数据偏差。
制备单细胞悬液
单细胞悬液的质量是细胞分选成败的关键,其制备的核心在于 “避免细胞过度解离” 与 “最大化保留细胞数量”之间的精准平衡。针对不同来源的样本,为您推荐如下解离方案:

实体组织样本
- 机械法:通过物理作用,如研磨、过滤、吹打,分解质地较软或纤维含量少的组织样本。此方法操作简单、快速,成本低,但易造成组织细胞损伤,细胞分散不完全,解离效果较一般。
![]()
- 机械法操作tips:
- 组织样本应在冰浴或4℃解离,研磨缓冲液提前预冷,减少细胞代谢消耗和热损伤。
- 研磨时轻柔按压,不要过多研磨或用针头或细口径吸管强行吹打同一组织样本,反复操作会损伤细胞。
- 应根据目的细胞大小选择合适参数的细胞筛网(30/70/100μm)过滤。
- 酶解法:通过消化酶,如胶原酶、胰蛋白酶等,分解如肿瘤、肝脏、肾脏等纤维含量高或质地坚韧的组织。此方法能保持细胞完整性和活性,可选择酶种类丰富多样,但操作较繁琐,消化时间长且难控制,可能影响细胞抗原表位识别。
![]()
- 酶解法操作tips:
- 根据不同组织类型选择合适的酶解方案(见表1)。
- 可扫码查看优宁维专属组织分离指南,帮助您根据目的细胞类型选择适宜的解离酶与浓度。
- 酶液需提前在37℃水浴复温,避免冷酶液直接加入样本导致细胞应激。
- 酶解在 37℃或室温孵育20-30min,每10 min轻柔摇晃离心管,以助组织分散,避免超时消化。
表1不同组织解离方案
3.GentleMACS组织解离系统:基于两种传统方法的融合创新,实现组织解离技术的全面革新。
该系统由组织处理器、组织解离试剂盒、专用耗材组成,处理器可外设加热模块或冷冻模块实现温和细胞或细胞核解离,解离过程高效、自动化、标准化可重复,获得细胞活性高、抗原表位被极大保护,可保障下游实验结果真实可靠。
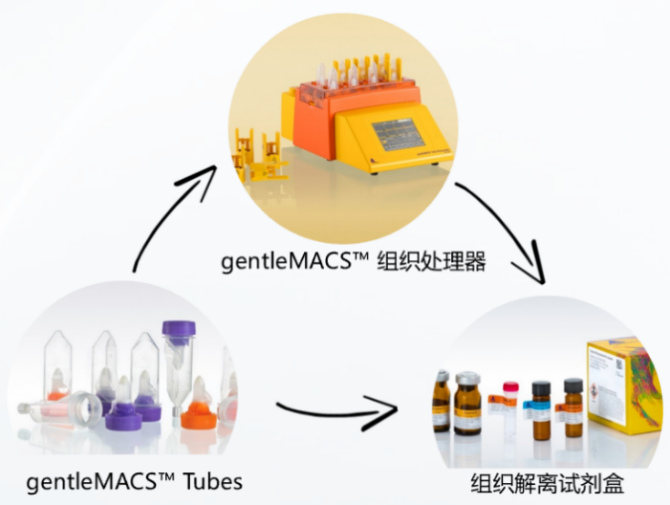
图1. GentleMACS组织解离系统
GentleMACS组织解离系统操作过程:以肿瘤组织为例

先将预处理的组织样本与适量酶解缓冲液一并放入专用 gentleMACS 组织解离管。然后将解离管置于主机上,通过预设或自定义程序进行自动化解离。程序完成后,取出解离管,即可通过过滤或离心快速获得高质量单细胞悬液。
虽然流程清晰简单易懂,但为确保解离效能,小优总结以下高频问题给大家提前避坑:
Q1. MACS组织解离专用耗材C管与M管分别适用于哪种实验场景?

需注意!gentle MACS组织处理器必须与组织解离管配套使用,避免因使用不兼容的耗材导致仪器损坏、程序错误或样本损失。
Q2. GentleMACS组织解离系统操作过程中是否需要人为干预?
选好程序启动后,设备即进入全自动流程,无需人工值守与手动干预。该设计可规避不同操作者手法差异与计时误差,能够实现解离结果的高度标准化、可重复性与一致性,大幅提升实验效率与可靠性。
Q3. GentleMACS组织解离系统是否只能提取细胞?
不仅能提取细胞,还可通过搭配Cooler模块与专用耗材(#130-130-533),快速、温和获取细胞核。该系统能在保持细胞核完整性与活性的同时,确保高重复性与标准化流程。

Q4. GentleMACS组织解离系统还有哪些特殊应用?
该系统还可适配心脏或肝脏灌流等特殊前处理。通过特定灌流程序与专用耗材(#130-128-151),实现自动化、可控的器官原位灌流,高效清除血液并均匀分布消化酶,显著提升细胞得率与活性。
Q5. 针对样本罕见,没有专属试剂盒怎么办?
美天旎通用型多组织解离试剂盒,如 Multi Tissue Dissociation Kit 1/2(#130-110-201/ 130-110-203)可提供标准化的替代方案。该试剂盒1型和2型核心区别在于分别适配不同组织类型与酶解策略(见表2)。此外,也可在通用试剂盒基础上,调整酶解时间、温度,或补加特定酶(如透明质酸酶)进行实验条件优化。
表2 Multi Tissue Dissociation Kit 1型/2型核心区别
Q6. 组织上机前是否需要预剪切?
预剪切并非固定步骤,关键取决于组织类型。为确保解离效果一致,避免过度解离或细胞损伤,建议严格按照说明书要求判断是否预先剪切。
Q7. 肿瘤组织如何选用合适的组织处理器操作程序?(以人肿瘤组织解离试剂盒#130-095-929为例)
需判断组织软硬程度,选择对应的研磨程序类型(如图2)。搭配对应组织处理器和组织解离试剂盒提供的研磨程序进行选择。软组织(如黑色素瘤、结肠癌等)优先选温和研磨程序,减少细胞损伤;硬组织(如乳腺癌、胰腺癌、肝癌等)可选用加强研磨程序,保障解离充分。 根据软硬程度选择好适配的程序类型后,也需注意解离仪器不同,对应的操作程序也有所不同,具体如下:
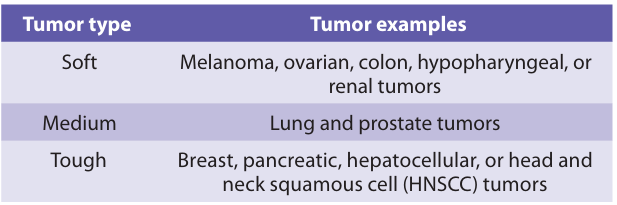
图2 肿瘤组织软硬程度分类
(1)若使用带加热功能的 gentleMACS™ Octo 解离仪器,根据下表选择适宜程序,运行结束后可直接按说明书操作进行下一步。
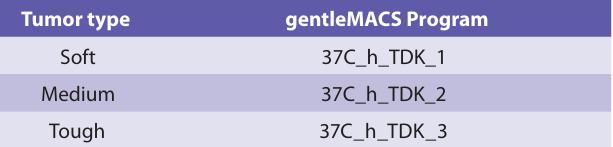
图3 加热款肿瘤组织研磨程序示例
(2)若使用常规gentleMACS™解离仪或非加热模式的gentleMACS Octo 解离仪,无论肿瘤是柔软、中等硬度还是坚硬型,首先统一运行 gentleMACS 程序 h_tumor_01,按说明书操作步骤处理后,进行第二次程序(如图4)。运行结束后,进行第三次程序处理(如图5)。


Q8. 罕见组织样本找不到对应的组织解离程序怎么办?
罕见组织样本没有特定标准化解离程序,可咨询优宁维技术获取推荐方案,也可参考说明书中的通用程序摸索最佳处理方案!
Q9. 没有Gentle MACS组织处理器,可以单独用解离试剂盒吗?
可以,因为美天旎的试剂盒是经过严格筛选与优化配比的优质酶解方案。若解离试剂盒不搭配仪器使用,可参考解离试剂盒说明书中“通道2”程序的运行时间(如图3),自行摸索酶浓度优化实验条件。
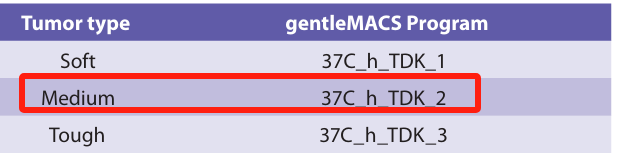
图6 说明书“通道2“程序示例
Q10. 单次实验上机样本量是多少?
需根据实际样本量折算,但要严格根据样本量添加解离试剂(如图4),避免因试剂不足影响解离效率。

图7 以肿瘤组织解离试剂盒说明书为例
MACS组织解离热卖产品:
血液样本
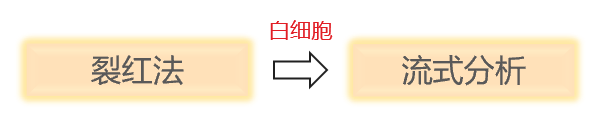
如何根据不同需求选择合适的外周血处理方法?
![]()
裂红法与密度梯度离心法实验流程及操作tips
1.裂红法: 特异性裂解红细胞,富集有活白细胞,以制备细胞悬液。
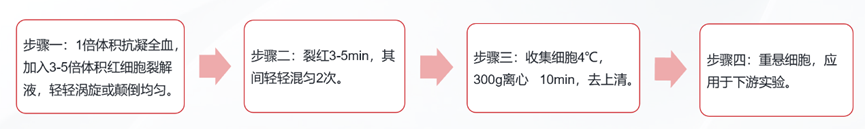
- 操作tips:
- 溶血素需4℃保存,现用现配;若操作小鼠或大鼠的血源样本,操作温度建议升至37℃,适当增加孵育时间
- 裂红体积应在全血体积的3-5倍左右,建议裂红3-5 min。避免裂解时间过长损伤细胞抗原表位及细胞状态,时间过短则裂解不充分。
裂红试剂热卖产品:
2.密度梯度离心:使用密度梯度介质,利用细胞密度差异实现分层,富集目标细胞。

- 操作tips:
- 根据样本来源及目标细胞类型,选用对应密度参数的Ficoll分离细胞。且使用前需恢复至室温(18-20℃),以确保最佳分离效果
常用分离细胞Ficoll密度参数如下:
1.077 g/mL:分离人外周血、脐带血及骨髓中单个核细胞
1.073 g/mL:人基质细胞、间充质干细胞(MSC)等低密度细胞
1.084 g/ml:分离大鼠、小鼠血液及骨髓中单个核细胞
- 合适的分离温度应保持在18-20°C。温度过高分离介质密度较低,影响分离效果及细胞活性;温度过低,PBMC无法有效富集于分离胶界面,导致分层模糊、红细胞污染及细胞回收率显著下降。
- 离心过程中,离心机应缓升缓降,避免因离心机震动影响细胞分层

图8. 密度梯度离心分层示意图
细胞分离相关产品:
优化细胞悬液质量
我们获得的单细胞悬液可能会有一些细胞团块、细胞碎片、死细胞等影响后续分选过程如干扰磁珠标记、堵塞分选柱,导致细胞分选纯度与得率下降。因此,我们可以选用以下细胞优化试剂提升细胞质量:
1.筛网过滤:使用孔径适宜的细胞筛网对粗提细胞悬液进行过滤,以去除未充分解离的组织团块。(MACS® SmartStrainers70μm#130-098-462或70um细胞筛网#abs7232)
2.碎片去除试剂:利用密度梯度离心的原理快速、有效去除细胞碎片(Debris Removal Solution#130-109-398或细胞分离液#abs9102)
3.死细胞去除:磁珠标记死细胞表面的磷脂酰丝氨酸,通过高强度磁场,将死细胞去除( Dead Cell Removal Kit #130-090-101)
4.裂红试剂:利用渗透压差,裂解无核红细胞。(Red Blood Cell Lysis Solution (10×)#130-094-183或红细胞裂解液(1×)#abs9101)
注:若您后续进行细胞培养,则不需要裂红;若是磁珠分选或测序,则需要进行裂红和细胞碎片去除
细胞状态评估
经质量优化后的单细胞悬液需评估细胞活性,确保细胞活率>85%,以保证磁珠标记效率获得理想的分选结果。
1.血球计数板:
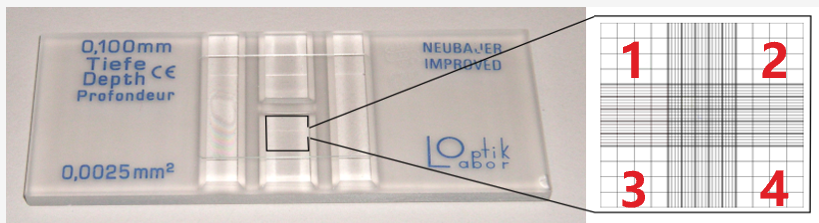
图9. 血球计数板示意图
- 用无水乙醇(或 95%)擦拭计数板,晾干,取一张干净盖玻片覆在计数板上
- 滴加适量单细胞悬液,确保无气泡且分布均匀
- 显微镜观察,计数四角方格的细胞,遵循“计上不计下、计左不计右”原则
- 按公式计算浓度与活率:
浓度(cells/mL)=(四大格细胞总数÷4)×稀释倍数×10⁴;
活率(%)=(活细胞数÷总细胞数)×100%
2.细胞计数仪:
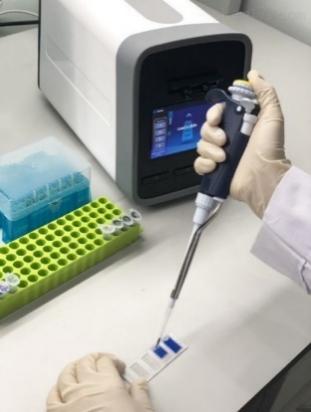
图10. 细胞计数仪操作示意图
(1)将单细胞悬液按说明书比例与台盼蓝(abs42028917)染液混合
(2)取10-20μL混合液加至专用计数板
(3)计数板插入仪器指定卡槽,等待读取细胞浓度、活率及粒径分布等数据
注:若目的细胞比例过高(≥90%),超出磁珠的最大上限量,应重新评估分选的必要性,优先考虑直接使用或选择阴性去除方案。
相关新闻资讯