
1YR企业会员
发布人:武汉恩玑生命科技有限公司
发布日期:2026/2/6 15:38:14
文章《The Society for Immunotherapy in Cancer statement on best practices for multiplex immunohistochemistry (IHC) and immunofluorescence (IF) staining and validation》由癌症免疫治疗学会(SITC)病理工作组牵头,联合来自学术机构的病理学家、实验室负责人以及制药和诊断公司的专家共同撰写,发表于《Journal for ImmunoTherapy of Cancer》,聚焦多色免疫组织化学(mIHC)和多色免疫荧光(mIF)染色及验证的最优操作规范。肿瘤微环境(TME)的免疫特征与癌症预后及免疫治疗应答密切相关,mIHC/mIF技术可量化免疫细胞亚群、功能状态及空间分布,但其应用存在平台差异大、操作不规范等问题。为此,SITC召集多领域专家,梳理了mIHC/mIF各类技术的原理、流程、优劣,制定了抗体选择、实验优化、验证等环节的共识性建议,同时指出该技术有望进入常规临床应用,为其规范化发展及生物标志物研究提供了重要参考。
一、研究背景与目的
肿瘤微环境(TME)是宿主成分与肿瘤细胞复杂相互作用的集合体,包含多种免疫细胞、具有特定免疫活性蛋白表达模式的细胞及基质细胞,每种成分均构成独特微环境生态位。研究表明,肿瘤或免疫细胞 PD-L1 表达、治疗前 CD8+T 细胞浸润密度等 TME 特征与免疫检查点抑制剂治疗应答相关,治疗中样本研究也为阐明免疫治疗对 TME 的重塑作用、药物机制及疗效早期标志物提供了重要依据。基于此,表征更多 TME 特征以挖掘可靠生物标志物、推动精准医疗成为研究热点。
当前临床价值最高的生物标志物源自肿瘤相关细胞分析,而外周血免疫细胞表征与 TME 细胞组成相关性低,对筛选免疫治疗获益患者的价值有限。肿瘤样本研究则面临组织资源稀缺、石蜡包埋前处理差异、标志物表达空间异质性、复杂或稀有细胞表型原位检测难等挑战。流式细胞术虽适用于细胞表型分析,但依赖新鲜组织、细胞产量低且丢失空间信息,限制了其常规应用。
TCGA 项目采用的多组学方法提供了大量数据,助力肿瘤分类及免疫浸润预后意义研究,但样本包含非肿瘤组织,生物信息学解析虽能实现虚拟单细胞分析,却仍丢失空间信息,单细胞 RNA-seq 同样缺乏空间语境。相比之下,免疫组织化学(IHC)可区分表达相同蛋白的不同细胞,表征 TME 中特定细胞的密度与空间分布,还能半定量评估标志物强度。免疫荧光(IF)则可在单细胞水平表征宽动态范围的表达。IHC 与 IF 检测的核心是特异性抗体,常规方法多针对福尔马林固定石蜡包埋组织中单蛋白检测,而 mIHC/mIF 技术可同时靶向多个蛋白,单细胞水平精准检测 2-50 个标志物,涵盖多种技术平台,如支持 4-5 重检测的标准 IF 显微镜、6-8 重检测的多光谱技术,以及 MIBI-TOF、IMC、DSP 等高重检测技术。这些技术各有优劣,均需优化与验证,本文献就此提出最佳实践要求的共识性建议,以保障数据质量。
二、研究内容与方法
SITC组建多领域专家工作组,通过梳理研究成果、整合实验经验、结合多平台技术验证,系统分析mIHC和mIF技术关键环节并汇总对比技术参数,最终形成共识性最优操作规范建议。核心研究内容包括:对比传统检测方法与mIHC和mIF技术的优劣,明确后者在多标志物检测、空间分布分析及抗PD-L1治疗应答预测中的优势。明确抗体选择的关键要点,对单克隆抗体优先选择、抗体验证、敏感性及可重复性提出具体建议。规范实验优化与对照设置的相关要求,明确对照设置标准及实验各环节的优化方向。详细解析5类主流mIHC和mIF技术的原理、优劣及适用场景,明确临床与科研中mIHC和mIF检测的验证核心要求,保障研究可重复性与透明度。
三、核心研究结果
1、多重显色免疫组织化学染色
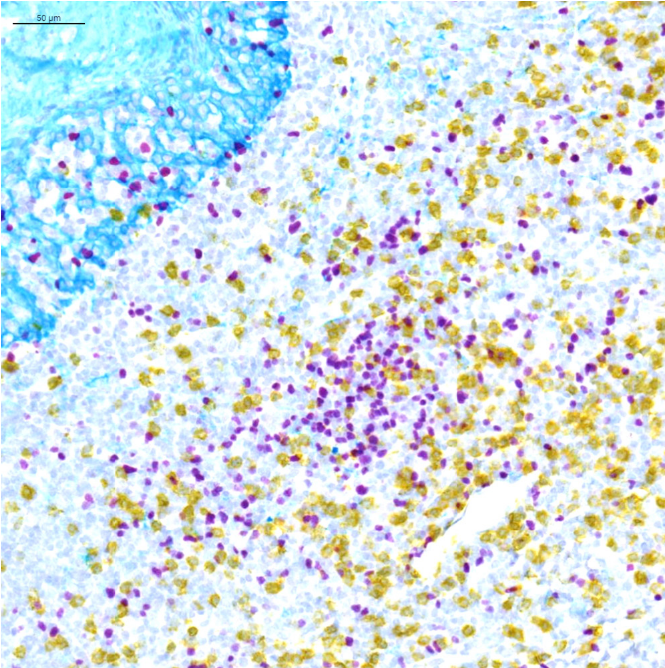
标准显色mIHC是传统单一IHC技术的延伸,通过不同颜色发色团标记多个标志物实现同张切片多标志物同步检测,适用于临床常规检测。本图展示了三重显色mIHC的成像效果、验证其多标志物共表达检测可行性及发色团区分度与染色清晰度。采用Ventana公司三种不同颜色的发色团标记,辅以苏木素复染区分细胞核与细胞形态,不同颜色对应三种标志物的表达位置,可通过颜色叠加观察标志物空间分布差异及共表达信号,直观体现其多标志物检测能力。这一图像验证了多重显色mIHC的实用性,展示了所选发色团组合的有效性,为临床病理学家熟悉的光学显微镜解读方式提供适配性,同时为后续多标志物显色mIHC的优化提供了可直接应用于临床的参考依据。
2、单张切片多重免疫组织化学连续染色(MICSSS)
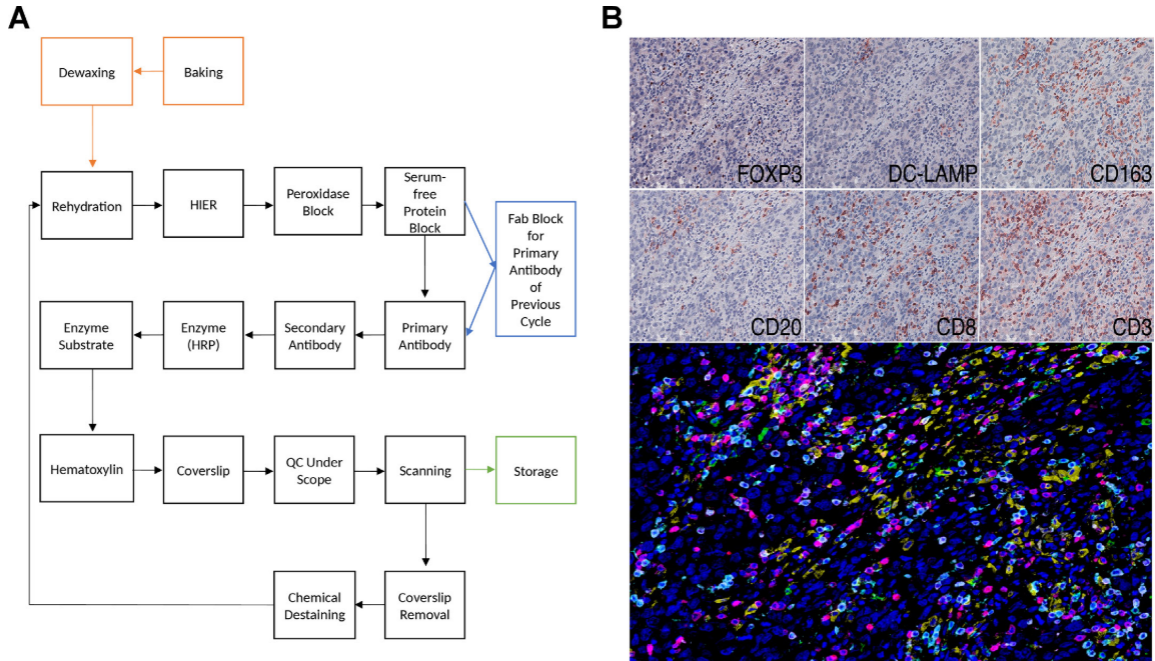
MICSSS 技术的核心是通过 “染色 — 扫描 — 脱染” 的循环步骤,在同一张组织切片上完成多个标志物的检测,它既和传统 IHC 技术兼容性强,又能实现多标志物同步检测,但缺点是操作流程比较繁琐,花费的时间也较长。图中清晰展示了 MICSSS 的完整实验步骤,同时呈现它在三阴乳腺癌组织中检测多种标志物的成像效果。子图 A详细列出了从染色到脱染的循环过程,包括 Fab 片段封闭、化学脱染这些关键步骤。子图 B既展示了 6 种标志物各自的染色图像,也呈现了这些图像融合后的复合伪彩图,单独染色的图像信号清晰、没有杂乱背景,复合图则能让人直观看到不同免疫细胞在肿瘤组织里的浸润情况,以及这些细胞之间的空间位置关系。MICSSS实验流程为后续研究者提供可重复的操作参考,同时也证明了这项技术能有效检测多标志物,还能和传统单一IHC 技术兼容。
3、多重染色的成像区域差异
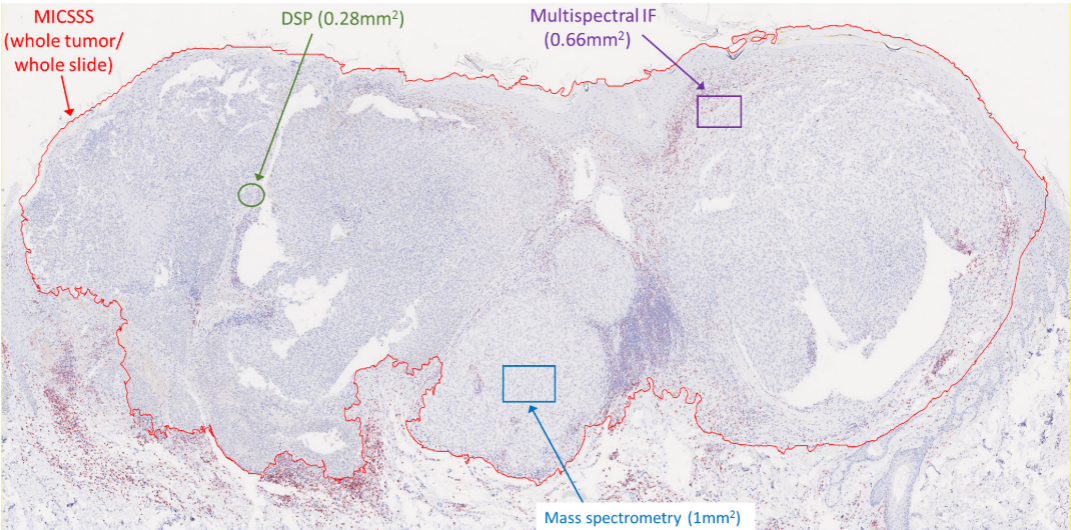
不同mIHC/mIF技术的成像区域差异直接影响其应用场景,全切片成像适用于临床常规筛查,ROI成像适用于科研中复杂肿瘤微环境深入分析,本图以恶性黑色素瘤组织为研究对象,旨在直观对比5类主流技术的成像区域大小,为研究者技术选择提供参考。该图为恶性黑色素瘤组织切片代表性图像,叠加了各类技术的成像区域标注,其中MICSSS为全肿瘤/全切片成像,多光谱mIF、EMS-IHC、DSP分别为0.66mm²、1mm²、0.28mm²的ROI成像,图中备注三类ROI成像技术可通过ROI拼接实现全切片成像,但目前未广泛应用。这一图像直观区分了各类技术的成像特性,揭示了其应用场景的差异,解释了MICSSS与质谱分析、DSP的适用场景区别,同时提示了ROI拼接实现全切片成像的技术优化方向。
4、TSA多重免疫荧光技术
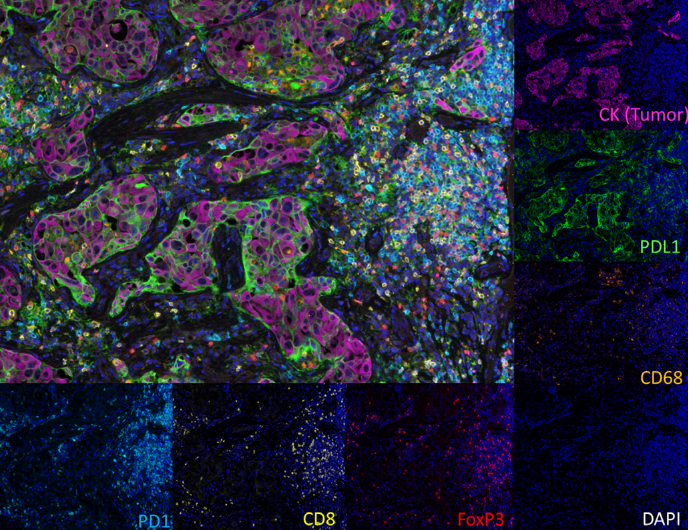
mIF结合TSA技术可实现信号放大、提升低表达标志物检测灵敏度,多光谱显微镜可校正自发荧光和信号重叠,实现单细胞水平精准表型分析,实验以非小细胞肺癌组织为检测对象,采用TSA信号放大和多光谱成像,同步检测6种标志物,利用多通道成像模式避免荧光重叠,可单独或组合显示标志物图像,清晰呈现各标志物的细胞定位及共表达情况。不仅验证了TSA-based多光谱mIF的技术优势,展示了其检测精准性,还可为抗PD-L1治疗应答预测提供依据,同时为其他肿瘤类型开展类似 mIF 检测提供了可直接参考的实验方案。
5、基于组织的质谱分析

EMS-IHC通过一抗与元素质量标签结合,利用质谱仪实现像素级电离分析,可同时检测数十个标志物、干扰少,适合复杂肿瘤微环境高维度解析。本图展示了其成像效果,验证其在人蜕膜组织中多标志物同步检测、高分辨率空间分布分析的能力。实验采用MIBI-TOF技术检测人蜕膜组织,应用40标志物检测面板,展示6种标志物的成像结果,包含6色叠加主图和双色放大插图。主图展示了标志物整体空间分布,插图呈现共定位关系,灰度图像素强度对应标志物表达丰度,可实现精准定量且成像分辨率高。这一图像凸显了EMS-IHC的高分辨率空间分析能力,为复杂组织微环境细胞异质性分析提供工具,同时拓展了该技术的应用场景,可用于非肿瘤组织免疫相关疾病机制探索。
6、数字空间分析
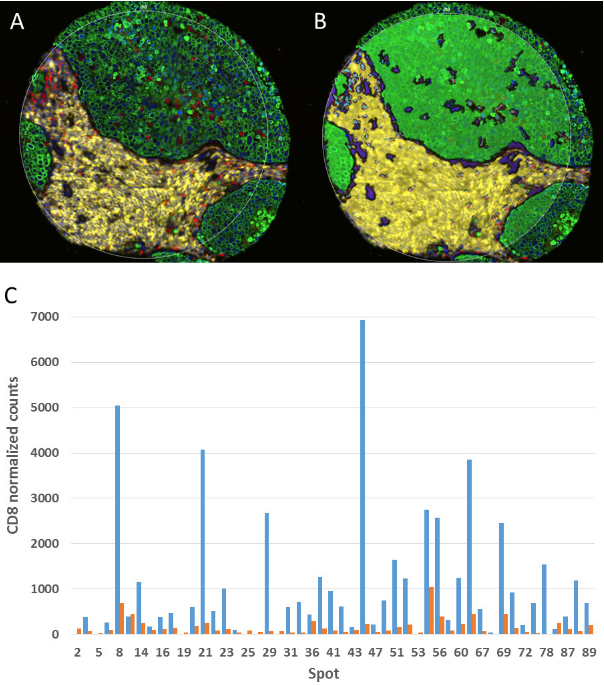
DSP技术通过UV可切割荧光DNA标签一抗结合NanoString技术,实现特定组织分区多标志物精准定量,无需迭代染色、无自发荧光干扰,适合临床样本特定区域分析。实验验证了其在非小细胞肺癌TMA中特定区域标志物定量分析的可行性与准确性,该图清晰呈现了荧光标记定义组织分区、UV激光切割标签、NanoString计数的关键流程,CD8标志物分区定量结果符合已知生物学特征,验证了定量准确性。DSP技术的核心优势在于解决了传统技术无法精准定位定量的局限,验证了其定量可靠性,同时展示了其在TMA高通量检测中的应用潜力,适合多中心临床研究及精准免疫治疗标志物筛选。
四、总结与展望
针对目前主流的5类mIHC/mIF技术平台,本文献详细解析了各平台的原理、流程、优势及局限性,并通过表格进行了系统对比。在技术优化与验证规范方面,文献提出了明确的核心原则,以单一显色IHC检测为基础和参考,mIHC/mIF检测需能重现单一IHC的结果。同时明确了关键优化环节,包括抗原修复条件、抗体孵育时间与浓度、封闭步骤、信号放大方法等,需通过矩阵系统等方式优化以提升信噪比。验证过程需涵盖准确性、精密度、可重复性,且当技术流程、抗体组合或标记方式发生改变时,需重新验证。
mIHC/mIF技术已成为生物标志物研究的标准工具,有望在不久的将来进入临床常规应用,不同技术平台各有优劣、相互补充,单一染色技术更易快速应用于临床,多重染色技术目前仍以研究探索为主。未来需通过统一的最佳实践规范,推动技术的标准化与规范化,同时借助技术革新解决现有局限性,进一步发挥mIHC/mIF技术在癌症免疫治疗生物标志物筛选、治疗应答预测、预后评估及作用机制探索中的核心价值。
参考文献
Taube JM, Akturk G, Angelo M, Engle EL, Gnjatic S, Greenbaum S, Greenwald NF, Hedvat CV, Hollmann TJ, Juco J, Parra ER, Rebelatto MC, Rimm DL, Rodriguez-Canales J, Schalper KA, Stack EC, Ferreira CS, Korski K, Lako A, Rodig SJ, Schenck E, Steele KE, Surace MJ, Tetzlaff MT, von Loga K, Wistuba II, Bifulco CB; Society for Immunotherapy of Cancer (SITC) Pathology Task Force.. The Society for Immunotherapy of Cancer statement on best practices for multiplex immunohistochemistry (IHC) and immunofluorescence (IF) staining and validation. J Immunother Cancer. 2020 May;8(1):e000155. doi: 10.1136/jitc-2019-000155. Erratum in: J Immunother Cancer. 2020 Jun;8(1):e000155corr1. doi: 10.1136/jitc-2019-000155corr1. PMID: 32414858; PMCID: PMC7239569.
EnkiLife mIF 技术服务
提供有偿代检和分析服务
承接多色配套服务

相关新闻资讯