氯化钡的性质及制备
发布日期:2023/4/17 17:37:23
氯化钡主要应用于制造钡盐、鞣革、颜料、染料化学试剂、羊毛染色助剂、金属淬火加工、人造丝白消光剂、防止陶瓷制品褪色、制取金属钡及钡炸药农药(如杀虫剂,田间灭鼠剂)、化工等领域。它为剧毒品!密度为3.05g/cm3,是无色扁平菱形薄片晶体,通常带两分子的结晶水(BaCl2·2H2O)。在100℃水中,20℃时可溶解35.7g;100℃时可溶解58.8g。无水盐的熔点为962℃。[1]
性质
氯化钡的基本性质[2]
无色单斜晶系结晶。冷结晶为扁平菱形,热结晶为无定形。工业品为白色片状或粉状结晶。结晶水在空气中稳定,加热到113℃时失去结晶水。易溶于水,溶解度随温度的升高而增大。有乙醇及氯离子(如氯化钙)存在时,溶解度显著降低。在乙醇及酸中的溶解度比在水中的溶解度小。在无水乙醇中失去结晶水,但并不溶解。不溶于丙酮。氯化钡的水溶液具苦咸味,并且因含氯离子而具有较强的腐蚀性。工业氯化钡有毒、不易燃、不易爆。
氯化钡的毒性[3]
氯化钡属高毒物质。钡离子可激活细胞膜使细胞膜通透性增加使钾大量透过细胞膜进入细胞内导致血清钾含量降低,出现低钾血症。服食氯化钡后刺激口腔和食道出现灼热感,唾液增多;刺激胃肠道黏膜和平滑肌使消化道出现强烈收缩,产生恶心、呕吐、腹痛、腹泻等胃肠道症状;刺激中枢神经系统出现头晕、头痛等不适;影响神经肌肉接头的正常功能对肌肉有强烈而持久的刺激作用先出现痉挛、抽搐等兴奋状态随后表现为上行性四肢无力全身酸软;损害末梢神经,出现全身麻痹、口鼻周围发麻。大量的钡离子入血后,可兴奋心肌使心肌的应激性和传导性增强心跳加快严重时则可转而抑制心肌的兴奋传导,出现心动过缓传导阻滞严重的异位心律和心室纤维颤动以致心脏停搏;亦可引起气管平滑肌兴奋收缩以致痉挛,呼吸肌麻痹最终导致呼吸衰竭。
低钾血症是急性氯化钡中毒最重要的临床表现,早期尽快提高血钾水平是抢救成功降低死亡率的关键。关于补钾口服补钾相对静脉补钾是较安全的补钾措施,若无呼吸肌麻痹或心律失常,可1次大剂量(3~5g)口服补钾视血钾浓度,可重复应用,且不易导致高钾血症。因为当肾脏功能正常时有很强的排钾能力通过肾脏排泄的钾约占总排出量的90%,肾脏排钾量大致和摄入量基本平衡,因此在肾功能正常的情况下,口服钾盐一般不易引起高钾血症。
用途[2]
化学工业中主要用于制造各种钡盐、含钡颜料、有机染料,还用于食盐电解去除盐水中的硫酸根。钢铁工业中用于热处理、合金钢切削工具的淬火处理,并代替氰化钠作钢材的渗碳剂。农业生产中用以除治植物的害虫。造纸工业中用于制造感光纸铜版纸。还可用于锅炉水的处理、陶瓷制品防止褪色等。
生产方法[2]
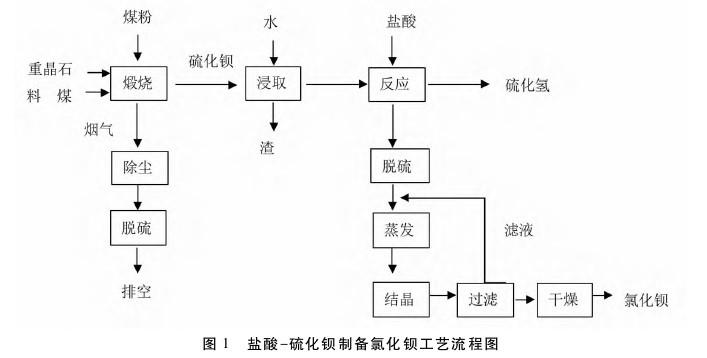
①盐酸法:硫化钡和盐酸反应生成氯化钡和硫化氢。副产的硫化氢可用于制取硫磺,可加工成硫酸及其盐类,可用碱液吸收制取硫氢化钠,可用氢氧化钙吸收制取硫脲,可用于制取蛋氨酸、二甲基甲砜等。
②氯化钙法:将重晶石、原料煤和氯化钙按一定比例混匀,在高温下反应生成氯化钡熔体,然后浸取、过滤、蒸发、结晶、干燥即得产品。
③氯化法:用氯气处理硫化钡溶液得到氯化钡。
④碳酸盐法:碳酸钡与盐酸反应制得氯化钡。
⑤氯化镁法:硫化钡与氯化镁反应制备氯化钡。
⑥氯化铵法:用氨碱厂的蒸馏废液(含有氯化铵)与硫化钡反应制得氯化钡。
主要制法流程简述[2、4]
①盐酸法:将硫化钡溶液加入反应器中,在不断搅拌下慢慢加入质量分数为31%的工业盐酸,控制pH为4~5,硫化钡全部转变为氯化钡。中和反应过.程放出大量硫化氢气体,捕集回收利用。反应过程常有BaS被过量的盐酸分解析出硫磺,送入脱硫塔脱硫。澄清的BaCl2溶液含有过量的游离盐酸,可用烧碱或氢氧化钙、氢氧化钡中和,也可用碳酸钡中和。经过处理的氯化钡溶液采用多效真空蒸发器浓缩到BaCl2质量浓度达到400~600g/L,然后在结晶器中冷却到25~35℃析出BaCl2·2H2O结晶,经离心分离、干燥得到成品。
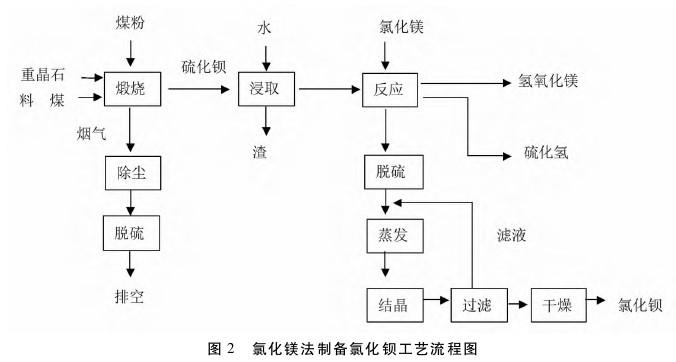
②氯化镁法:氯化镁法主要是利用氯化镁与硫化钡进行复分解反应,同时生产出氯化钡、氢氧化镁、硫化氢,反应方程如下:BaS+MgCl2 +2H2O=BaCl2+H2S↑+Mg(OH)2↓
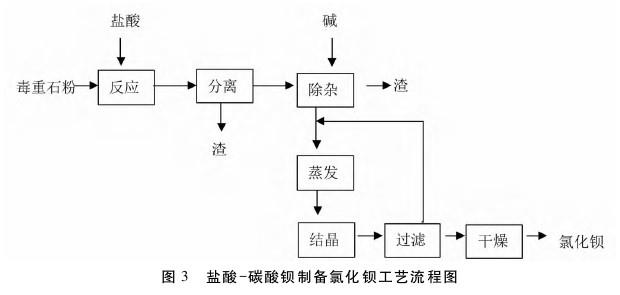
③碳酸盐法:将毒重石破碎、用水打浆,按毒重石与盐酸的质量比为1:(1.2~1.3)加入盐酸,升温至70℃,发生下列反应:BaCO3 +2HCl+H2O→BaCl2·2H2O +CO2↑。为保证产品中铁含量符合标准,在反应生成液中加入一定碱量除铁,再过滤,滤液蒸发浓缩、冷却结晶得到二水氯化钡。
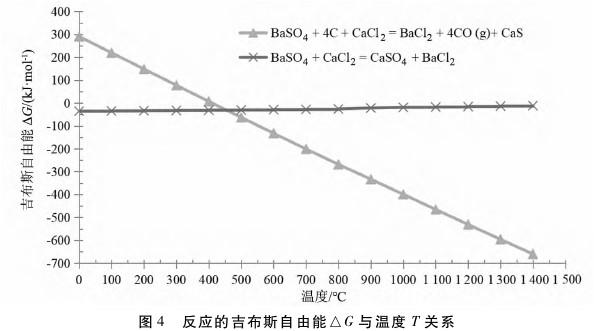
④氯化钙法:将重晶石、原料煤与氯化钙分别破碎,按质量比为100:28:48混匀送入转窑,在770~1100℃进行反应。烧好的氯化钡熔体破碎至30mm以下,送入浸取器用热水(60~80℃)浸取,得到BaCl2质量浓度大于250g/L的溶液,加盐酸脱硫使硫质量浓度小于0.1g/L。脱硫后的BaCl2溶液蒸发浓缩、冷却结晶、离心分离,结晶用清水洗涤,再于60~80℃干燥,得到成品。从图4可以看出,在煤粉参与下,高温时重晶石更容易与氯化钙反应转化生成氯化钡,其高温下吉布斯自由能△G远小于未加入煤粉的化学反应。
参考文献
[1] 张颂平, 黄亚梅, 王文领等. 氯化钡生产工艺的研究[J]. 河南教育学院学报(自然科学版), 2004(01): 34-36.
[2] 氯化钡(BaCl2·2H2O)[J]. 无机盐工业, 2018, 50(03):48.
[3] 庄培卿. 6例急性氯化钡中毒患者的抢救及护理[J]. 中国伤残医学, 2013, 21(11): 385-386.
[4] 程利山, 苏雪桐, 尚苏滢.工业氯化钡生产工艺研究进展及趋势[J]. 山东化工, 2022, 51(15): 83-85+89.
欢迎您浏览更多关于氯化钡的相关新闻资讯信息



