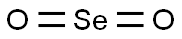-
外観
白色, 結晶〜結晶性粉末
-
性質
常温で無色の針状結晶です。昇華点は315°Cで黄緑色の気体になり、封管中では融点は340°Cで青色の液体に変わります。25°Cで100gの水に、73.3g溶けます。
独特の不快臭を有し、毒性は強いです。マウスによる経口投与での50%致死量 (LD50) は23.3mg/kgで、ラットによる経口投与では68.1mg/kgです。吸入や皮膚から吸収されるため、取り扱いに注意する必要があります。
-
溶解性
水に易溶 (257.1g/100ml, 20℃), エタノールに可溶。水に溶けやすく、エタノールに溶ける。
-
反応
二酸化セレンはアンモニアにより還元され、セレンが生じます。過酸化水素や硝酸中の酸素によって酸化すると、セレン酸を生成可能です。水との反応では亜セレン酸が得られます。
参考文献
-
解説

図1. 二酸化セレンの基本情報
二酸化セレン (英: selenium dioxide) とは、の酸化物の一種です。
無水亜セレン酸 (英: Selenous anhydride) とも呼ばれます。セレンの燃焼やを用いた酸化によって生成し、常温では無色の結晶です。
労働安全衛生法では、名称等を表示すべき危険物及び有害物、名称等を通知すべき危険物及び有害物に該当しています。労働基準法では疾病化学物質に、化学物質管理促進法 (PRTR 法) では第1種指定化学物質に、毒物及び劇物取締法では毒物に該当します。
-
用途
試薬
-
構造
二酸化セレンの化学式はSeO2、式量は110.96g/mol、密度は3.95g/cm3です。室温では鎖状高分子を形成しています。交互にセレン原子と酸素原子が並んでおり、それぞれのセレン原子はピラミッド型を取っていて、末端にはオキシド基があります。架橋Se-Oは179pmで、末端Se-Oは162pmです。セレンの立体化学は、ポリマー鎖に沿って交互になっています。
気相で二酸化セレンは、二量体やオリゴマーとして存在し、高温では単量体になります。単量体は二酸化硫黄に似た曲がった構造を取り、結合長は161pmです。単量体は極性分子で、双極子モーメントは2.62Dで、2つの酸素原子の中点からセレン原子に向いています。二量体は中心対称のいす形を取っています。オキシ塩化セレン (英: Selenium oxydichloride) に二酸化セレンを溶かすと、三量体の[Se(O)O]3を生成可能です。
-
化学的特性
Selenium dioxide is white to slightly reddish crystalline solid or yellow liquid which forms a yellowgreen vapor. It has a sour and pungent odor. Odor threshold in air50.0002 milligram per cubic meter.
-
使用
Selenium dioxide (SeO2) is used as an oxidizing agent, as a catalyst, and as an antioxidant
for lubricating oils and grease.
-
調製方法
While selenium dioxide, SeO2, can be produced by direct reaction of the element with oxygen activated by passage through HNO3, the compound is easily made by heating selenious acid, H2SeO3. Selenium dioxide sublimes at 315–317 °C (599–603 °F), and is readily reduced by SO2 to elemental selenium.
-
一般的な説明
A white or creamy-white volatile lustrous crystal or crystalline powder with a pungent sour smell. Melting point 340 deg C. Density 3.954 g / cm3 . Toxic by ingestion and inhalation.
-
空気と水の反応
In presence of water will corrode most metals [USCG, 1999]. Readily soluble in water forming selenious (selenous) acid.
-
反応プロフィール
Inorganic oxidizing agents, such as Selenium dioxide , react with reducing agents to generate heat and products that may be flammable, combustible, or otherwise reactive. Selenium dioxide reacts with water, particularly hot water, to give selenious (selenous) acid, a weak acid that is corrosive. Stable to light and heat. Rapidly absorbs dry hydrogen fluoride, hydrogen chloride, hydrogen bromide to form the corresponding selenium oxohalide. A good oxidizing agent. Reacts oxidatively with ammonia to form dinitrogen gas and selenium [Merck]. Oxidizes many organic substances.
-
危険性
Toxic by inhalation, ingestion, and skin
absorption.
-
健康ハザード
Absorption of selenium may be demonstrated by presence of the element in the urine and by a garlic-like odor of the breath. Inhalation of dust can cause bronchial spasms, symptoms of asphyxiation, and pneumonitis. Acute symptoms of ingestion include sternal pain, cough, nausea, pallor, coated tongue, gastrointestinal disorders, nervousness, and conjunctivitis. Contact with eyes causes irritation.
-
火災危険
Special Hazards of Combustion Products: Sublimes and forms toxic vapors when heated in fire.
-
使用用途
有機化学分野で二酸化セレンは、酸化試薬の1つとして使用可能です。二酸化セレンを酸化剤に使用し、ほかの合成方法では難しい物質を容易に得られます。具体的には、カルボニル化合物、オレフィン、アセチレン類、アルコール等の酸化に利用可能です。
への添加剤としても使用されており、ガラスに二酸化セレンを添加すると赤色を呈します。不純物を含む青色に見えるガラスを無色に見せるために、二酸化セレンを加える場合もあります。単体セレン、セレン酸塩、亜セレン酸塩も同様の用途で利用可能です。
-
職業ばく露
Selenium dioxide is used in the manufacture of selenium compounds, a reagent for alkaloids; an oxidizing agent; in paint and ink pigments; in metal “blueing” and etching; as a chemical catalyst; in photographic toners; in electric and photoelectric components; and others.
-
輸送方法
UN3283Selenium compound, solid, n.o.s., Hazard Class: 6.1; Labels: 6.1-Poisonous material, Technical Name Required.
-
純化方法
Purify it by sublimation at 315o, or by solution in HNO3, precipitation of selenium which, after standing for several hours or boiling, is filtered off, then re-oxidised by HNO3 and cautiously evaporated to dryness below 200o. The dioxide is dissolved in H2O and again evaporated to dryness. In H2O it forms selenious acid (see selenious acid above). Its solubility in H2O is 70%w/w at 20o, and it is soluble in EtOH. [Waitkins & Clark Chem Rev 36 235 1945, Fehér in Handbook of Preparative Inorganic Chemistry (Ed Brauer) Academic Press Vol I p 421 1963.]
-
不和合性
Selenium dioxide is and inorganic oxidizer; reacts, possibly violently, with reducing agents such as hydrides, nitrides, alkali metals, and sulfides. Contact with strong acids may cause release of toxic hydrogen selenide gas. Water solution is a medium-strong acid (selenious acid). Rapidly absorbs dry hydrogen fluoride, hydrogen bromide, hydrogen chloride, to form corresponding selenium oxohalides. Reacts with many substances producing toxic selenium vapors. Attacks many metals in presence of water.
-
廃棄物の処理
Consult with environmental regulatory agencies for guidance on acceptable disposal practices. Generators of waste containing this contaminant (≥100 kg/mo) must conform to EPA regulations governing storage, transportation, treatment, and waste disposal.
-
参考文献
K. Ståhl, J.P. Legros, J. Galy, Z. Krist., 202, 99 (1992), DOI: 10.1524/zkri.1992.202.1-2.99.