-
定義
本品は、次の化学式で表される気体である。
-
解説
二酸化炭素,
CO2(44.01).炭酸ガスともいう.多くの惑星の大気中に存在する.地球上では空気中に体積で約0.03% 含まれているほか,鉱泉水,天然ガスなどにも含まれ,炭素を含む物質の燃焼,火山の噴火などによって絶えず生成されている.実験室では,石灰石に塩酸を作用させて発生させる.工業的には石灰石を加熱分解してつくる.石炭などを燃やしたときや,エタノール発酵などの発酵のときに発生する二酸化炭素も利用されている.O-C-Oの直線形分子でC-O0.162 nm.無色,無臭,不燃性の気体で支燃性もない.空気中で10% 以上の濃度になると人間は呼吸困難になって意識を失う.空気を1としたとき,d1.529.密度1.976 g L-1(0 ℃,1 atm).固体二酸化炭素は常圧では昇華する.昇華点-78.5 ℃(1 atm),融点-56.5 ℃(5.2 atm).臨界温度31.0 ℃.臨界圧72.80 atm.1 atm で100 mL の水に対する溶解度は171 mL(0 ℃),119 mL(10 ℃),88 mL(20 ℃).水溶液中では炭酸を生じ,わずかに酸性を示す.
H2CO3 H+ + HCO3-
H+ + HCO3-
pKa 6.35.エタノール,脂肪族カルボン酸中へは水よりもよく溶ける.エーテル,ベンゼンとは混和するが,ほかの多くの有機溶媒とは混和しない.2000 ℃ までは安定であるが,さらに高温では一酸化炭素と酸素に解離する.水素とは可逆的に反応して,一酸化炭素と水とを生じる.アルカリ金属,アルカリ土類金属と加熱すると,炭素やギ酸塩に還元される.多くの金属の酸化物,水酸化物と反応して炭酸塩を生じる.とくに水酸化カルシウム水溶液では,はじめ炭酸塩を沈殿するが,長く通じると炭酸水素塩を生じて溶解する.しょう乳洞,しょう乳石,石じゅんの生成はこの反応による.清涼飲料の製造,可燃性物質の製造・取り扱い時の不活性化用,エーロゾルなどに用いられる.化学工業では炭酸塩の製造に用いられる.固体二酸化炭素はドライアイスとよばれ,冷凍食品工業,その他で寒剤として利用されている.
-
用途
ペニシリン製造、アイスクリーム?バター?チーズなどの保存?低温輸送、冷却、溶接、鋳物用、清涼飲料、消火剤、農薬(殺虫剤)
-
化粧品の成分用途
噴射剤
-
効能
医療用ガス
-
性質
無色、無臭、不燃性の気体で空気より重い。空気中に約2.5%含まれると、ろうそくに点火することができない。3~4%含まれると人間は活動能力を失い、20~25%になると仮死状態となるが、元来一酸化炭素と違って有毒ではない。液化しやすく、常温でも50気圧にすると液化する。液体二酸化炭素は常温では加圧下でなければ安定に存在することができず、ボンベの口にズックの袋をかぶせてボンベから液体炭酸を空気中に吹き出させると盛んに蒸発し、その際蒸発熱を吸収して周囲の温度が下がり、液体炭酸の一部が固化し、袋の中には雪のような固体炭酸ができる。これを型に入れて固めたものがドライアイスである。
気体、液体、固体中でつねに分子の存在が認められる。分子は直線形O-C-Oで、C-O距離は1.16Å(Åはオングストローム、10-10メートル)。この距離は普通の炭素‐酸素二重結合に対して期待される値1.22Åよりもかなり短い(二酸化炭素の共鳴構造の図参照)。二酸化炭素は非常に安定な化合物で、2000℃で2%ぐらい一酸化炭素と酸素に解離するにすぎない。熱した炭素、亜鉛、鉄などの上を通すと一酸化炭素に還元される。マグネシウムやアルカリ金属は、二酸化炭素中で加熱すると燃えて炭素を遊離する。アルカリ金属やアルカリ土類金属の水酸化物と炭酸塩をつくる。水酸化カルシウムでは、いったん沈殿した炭酸塩CaCO3が過剰の二酸化炭素とさらに反応して可溶性の炭酸水素塩Ca(HCO3)2を生じる。この石灰水との反応は二酸化炭素の検出法に用いられる。また、自然界における石灰石の溶出や沈降(鍾乳(しょうにゅう)洞、石筍(せきじゅん)など)はこの反応による。他の気体に比べて二酸化炭素は水に溶けやすく、室温1気圧で約0.03モル溶液となる。水溶液中には炭酸を生じており(ただし大部分は水分子とゆるく結合しているだけであって炭酸を生成してはいない)、pH約4の酸性を示す。高温高圧下でアンモニアと二酸化炭素を反応させると、中間にカルバミン酸アンモニウムH2NCO2NH4を生じて次のように反応が進む。
2NH3+CO2→H2N・CO2・NH4
H2NCO2NH4→H2NCONH2+H2Oこの反応は尿素H2N・CO・NH2(肥料)の製造に用いられる。
-
用途
もっとも重要な用途は、炭酸ナトリウム、炭酸水素ナトリウム(重曹)、鉛白(塩基性炭酸鉛)の製造ならびにソーダ水などの清涼飲料水用である。液体炭酸は消火剤に用いられる。固体炭酸は優れた冷凍剤で、食料品、果物などの貯蔵、輸送に適している。
-
説明
Carbon dioxide is a colorless, odorless, noncombustible gas present throughout the atmosphere and is an essential compound for life on Earth. It is found on other planets in the solar system. Mars’s icecaps are primarily frozen carbon dioxide and Venus’s atmosphere is mostly carbon dioxide. Carbon dioxide occurs naturally as approximately 0.03% v/v of the atmosphere.Solid carbon dioxide, also known as dry ice, is usually encountered as white-colored pellets or blocks.
-
化学的特性
Carbon dioxide,CO2, also known as carbonic anhydride and carbonic acid gas, is a colorless,odorless gas that liquifies at -65 °C(-86 OF) and solidifies in dry ice at -78.2 °C(-107 OF). It is soluble in water,alcohol, and most alkaline solutions. In a relatively slow reaction,carbon dioxide hydrates in water to become carbonic acid and is corrosive. In petroleum production, the velocity of the carbon dioxide gas can increase the corrosion rate to very high levels,with the presence of salts becoming unimportant. Carbon dioxide is used in preparing carbonated beverages, fire extinguishers, dry ice refrigerants,and as a raw material in the production of sodium carbonate and sodium bicarbonate using the Solvay procedure.
-
物理的性質
Colorless, odorless and tasteless gas; 1.53 times heavier than air; density 1.80 g/L at 25°C; can be liquefied under pressure; liquefies at -56.6°C at 5.2 atm; density of liquid CO2 at 0°C and 34 atm 0.914 g/mL; solidifies to white snow-like flakes known as dry ice, density 1.56 g/cm3 at -79°C; dry ice sub limes to CO2 gas at -78.5°C; critical temperature 31°C; critical pressure 72.79 atm, critical density 94 cm3/mol; moderately soluble in water, solubility 173 mL and 88mL CO2/100 mL water at 0°C and 20°C, respectively; solubility increases with pressure.
-
来歴
The discovery of carbon dioxide, credited to Joseph Black (1728–1799), played a critical role in supplanting the phlogiston theory and advancing the development of modern chemistry. Black, in his medical studies, was searching for a substance to dissolve kidney stones, but he switched his subject to a study of stomach acidity. Black was working with the carbonates magnesia alba (magnesium carbonate) and calcium carbonate (limestone) and observed that when magnesia alba was heated or reacted with acids, it produced a gas and a salt. Black, who published his work in 1756, called the gas “fixed air” and noted that it had properties similar to those described by Jan Baptista van Helmont (1577–1644) for spiritus sylvestrius. Spiritus sylvestrius was the gas produced during combustion processes, and van Helmont realized that this was the same gas produced during fermentation and when acids reacted with seashells.
-
使用
Carbon Dioxide is a gas obtained during fermentation of glucose
(grain sugar) to ethyl alcohol. it is used in pressure-packed foods as
a propellant or aerating agent and is also used in the carbonation of
beverages. it is released as a result of the acid carbonate reaction of
leavening agents in baked goods to produce an increase in volume.
as a solid, it is termed dry ice and is used for freezing and chilling.
-
調製方法
Carbon dioxide is obtained industrially in large quantities as a byproduct
in the manufacture of lime; by the incineration of coke or
other carbonaceous material; and by the fermentation of glucose by
yeast. In the laboratory it may be prepared by dropping acid on a
carbonate.
-
製造方法
Carbon dioxide is produced as a by-product in many processes. It is pro duced as a by-product in the manufacture of lime from calcium carbonate:
CaCO3 →CaO + CO2
CO2 also is derived from synthesis gas which is a mixture of CO, CO2, H2 and N2 from air obtained by steam reforming. Carbon dioxide also is obtained by combustion of natural gas:
CH4 + 2O2 → CO2 + 2H2O
It also is obtained as a by-product in the Haber-Bosch process for the man ufacture of ammonia. The method involves passing steam and air over hot coke.
Carbon dioxide also is produced along with ethanol from fermentation of carbohydrates by yeast:
C6H12O6→2CO2 + 2C2H5OH
In the laboratory, CO2 may be produced by the reaction of any carbonate with a dilute mineral acid:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
-
定義
1. The
solution of carbon dioxide in a liquid
under pressure, as in carbonated soft
drinks.
2. The addition of carbon dioxide to compounds,
e.g. the insertion of carbon dioxide
into Grignard reagents.
-
薬用
呼吸興奮薬の一種。二酸化炭素は呼吸中枢を刺激して吸気作用をおこさせる働きをもつ。動脈血中の二酸化炭素の量が減少すると、呼吸数が減じ、末梢(まっしょう)血管の拡張がおこって、血圧低下、心拍数の増加と血液拍出量の減少がみられる。もともと二酸化炭素は呼気より排出される生体の代謝産物であるが、これが動脈血中に増加すると、呼吸中枢が興奮して呼吸が速くなり、ガス交換を盛んにして血中の二酸化炭素の量を少なくしようとする。また、空気中の二酸化炭素の濃度が3~5%になると生理的影響が現れ、8%を超えると呼吸困難を訴え、10%以上になると意識喪失がみられ、18%で致命的となる。
なお、呼気中には二酸化炭素が約4.4%含まれており、過換気症候群の発作時には数リットル程度の大きさの紙袋で口と鼻を覆って呼吸し、呼気中の二酸化炭素を再吸入することによって発作を消失させる。また一般に酸素吸入を行うときには、酸素単独よりも二酸化炭素を5~10%混ぜて用いたほうが有効である。このほか、固形炭酸(ドライアイス)は皮膚疾患の腐食剤として使われている。
-
製法
実験室ではキップの装置を用い、炭酸カルシウム(大理石)と希塩酸から発生させる。
CaCO3+2HCl→CaCl2+H2O+CO2
発生気体に含まれる微量の酸は炭酸水素カリウム水溶液を通して除き、濃硫酸を通して乾燥すると純粋なものが得られる。炭酸水素ナトリウムまたは炭酸マグネシウムを熱分解する方法もある。 2NaHCO3→Na2CO3+H2O+CO2
工業的には、石炭、コークスをガス化する際、石灰石CaCO3を焼いて生石灰CaOを製造するときや、アルコール発酵の際の副産物、天然ガス、石油生成の副生ガス、アンモニア合成工程の副生ガスとして多量に得られる。精製には、炭酸ナトリウムまたはエタノールアミン冷水溶液を用い、これに吸収させてから熱分解してもとへ戻す方法が普通用いられる。精製した気体は鋼鉄製のボンベ内に60気圧で液体(液体炭酸)として蓄えられる。
-
一般的な説明
An odorless, white solid. Can cause damaging frostbite. Noncombustible and nontoxic. Liquefies at -109°F. Can asphyxiate by displacement of air. Used as a refrigerant.
-
空気と水の反応
Water soluble. Forms carbonic acid, a mild acid in water.
-
反応プロフィール
Contact of very cold liquid/solid carbon dioxide with water may result in vigorous or violent boiling of the product and extremely rapid vaporization due to the large temperature differences involved. If the water is hot, there is the possibility that a liquid "superheat" explosion may occur. Pressures may build to dangerous levels if liquid gas contacts water in a closed container. With water forms weak carbonic acid in nonhazardous reaction. Dusts of magnesium, lithium, potassium, sodium, zirconium, titanium, and some magnesium-aluminum alloys, and heated aluminum, chromium, and magnesium when suspended in carbon dioxide are ignitable and explosive. This is especially true in the presence of strong oxidizers, such as peroxides. The presence of carbon dioxide in solutions of aluminum hydride in ether can cause violent decomposition on warming the residue, [J. Amer. Chem. Soc., 1948, 70, 877]. Dangers arising from the use of carbon dioxide in the fire prevention and extinguishing systems of confined volumes of air and flammable vapors are examined. The hazard associated with its use centers around the fact that large electrostatic discharges may be created that initiate explosion, [Quart. Saf. Summ., 1973, 44(1740, 10].
-
危険性
Solid damaging to skin and tissue; keep
away from mouth and eyes. Asphyxia.
-
健康ハザード
Carbon dioxide is an asphyxiant. Exposureto about 9–10% concentration can causeunconsciousness in 5 minutes. Inhalation of3% CO2 can produce weak narcotic effects.Exposure to 2% concentration for severalhours can produce headache, increased bloodpressure, and deep respiration. Contact with gas or liquefied gas may cause burns, severe injury and/or frostbite.
-
火災危険
Non-flammable gases. Containers may explode when heated. Ruptured cylinders may rocket.
-
化学性质
色?臭の気体で,水にいくらか溶け,弱酸性を示す。
-
温室効果
二酸化炭素は温室効果ガスとして働き、赤外線の特定の波長帯域に強い吸収帯を持ち、地球温暖化の主な原因とされています。二酸化炭素は産業革命以前の濃度は280ppmでしたが、2015年には世界の年平均二酸化炭素濃度が400ppmに到達しました。
排出量が莫大であるため、各国で排出量の削減を目指す取り組みが進められています。これには、エネルギーや農業・畜産業など人為起源の二酸化炭素の排出量を抑制する取り組み、森林の維持・育成、二酸化炭素回収貯留 (CCS) 技術の開発などが含まれます。また、排出権取引を活用した取り組みも行われており、海洋酸性化も懸念されています。
-
処理
酸化炭素の回収・分離の取り組み:地球温暖化を抑制するためには、二酸化炭素の新たな排出を減らすだけでなく、排気からの回収や大気からの回収技術 (Direct Air Capture, DAC) 、植林や負の排出も必要です。DACはアメリカ、カナダ、スイスなど15か所で開発施設があり、日本も2050年の実用化を目指しています。
DACには二酸化炭素を、化学吸収・吸着法、物理吸着法、膜分離法、ドライアイス化させる深冷法などがあります。回収した二酸化炭素は地中に貯留するか、原料として利用できます。
-
使用用途
二酸化炭素は、の製造など、化学工業で広く利用される他に、炭酸飲料などの清涼飲料水や医薬品などとしても使用されています。固体はドライアイスと呼ばれ、冷却剤として、魚類、乳製品、冷凍食品などの保存、低温輸送用などに利用されています。
液化炭酸ガスは、冷却用の他に清涼飲料水の原料、消火剤、炭酸塩の工業製品の原料、殺虫剤、酸化防止剤、植物の成長促進用など、他用途に使用されています。
断熱材などに使用されるなどに含まれている泡の組成は、ウレタンフォームの原料を混合して反応が起きる際に副生する二酸化炭素を利用したものです。二酸化炭素の大量放出が地球温暖化の原因の1つとされているため、二酸化炭素の排出量削減が求められています。
-
农业用途
Solid carbon dioxide is known as dry ice. It is produced by cooling gaseous carbon dioxide under pressure.
Dry ice is used in refrigeration, carbonated drinks and fire extinguishers. It is also a constituent of medical gases, as it promotes exhalation.
-
安全性プロファイル
An asphpant. See
discussion of simple asphyxiants under
ARGON. Experimental teratogenic and
reproductive effects. Contact of solid
carbon dioxide snow with the skin can cause
burns. Dusts of magnesium, zirconium,
titanium, and some magnesium-aluminum
alloys igmte and then explode in COa
atmospheres. Dusts of aluminum,
chromium, and manganese ignite and then
explode when heated in CO2. Several bulk
metals wlll burn in CO2. Reacts vigorously with (Al + Na2O2), Cs2O, Mg(C2H5)2, Li,
(Mg + Na2O2), K, KHC, Na, Na2C2, NaK,
Ti. CO2 fire extingushers can produce
highly incendiary sparks of 5-1 5 mJ at
10-20 kV by electrostatic discharge.
Incompatible with acrylaldehyde, aziridme,
metal acetylides, sodium peroxide.
-
安全性
In formulations, carbon dioxide is generally regarded as an
essentially nontoxic material.
-
職業ばく露
Gaseous Carbon dioxide is used to
carbonate beverages; as a weak acid in the textile, leather,
and chemical industries; in water treatment; and in the
manufacture of aspirin and white lead; for hardening molds
in foundries; in food preservation, in purging tanks and
pipe lines; as a fire extinguisher, in foams; and in welding.
Because it is relatively inert, it is utilized as a pressure
medium. It is also used as a propellant in aerosols; to promote plant growth in green houses; it is used medically as
a respiratory stimulant; in the manufacture of carbonates;
and to produce an inert atmosphere when an explosive or
flammable hazard exists. The liquid is used in fire extinguishing equipment; in cylinders for inflating life rafts; in
the manufacturing of dry ice, and as a refrigerant. Dry ice
is used primarily as a refrigerant. Occupational exposure to
carbon dioxide may also occur in any place where fermentation processes may deplete oxygen with the formation of
carbon dioxide, e.g., in mines, silos, wells, vats, ships’
holds, etc.
-
製造方法
原料である粗二酸化炭素ガスとして、工業的には発酵ガス、天然ガス、石油精製の副生ガス、アンモニア合成の際の副生ガスなどが主に用いられます。これらは二酸化炭素濃度が高いですが、水素、メタン、酸素、窒素、無機・有機硫黄の不純物、水蒸気などの不純物が含まれています。
これを物理的洗浄法 (水洗洗浄) 、活性炭、シリカ、アルミナによる吸着、化学的洗浄法 (過マンガン酸カリ溶液洗浄法) 、炭酸ナトリウム溶液洗浄法などを組合わせて精製します。液化炭酸ガスは、上記のようにして得られた二酸化炭素のガスを1.01MPaに圧縮して冷却することで得られます。
また、ドライアイスは8.08MPaに圧縮して得られた液化炭酸ガスを細孔から噴出させることで、断熱膨張により雪片状に凝結させながら、型に詰めて圧縮成形して得られます。
-
環境運命予測
Carbon dioxide is an asphyxiant, means it causes toxicity by
displacing oxygen from the breathing atmosphere primarily in
enclosed spaces or in open spaces due to sudden release of
massive amounts of CO2 (for example, forests fire or natural
emission during a volcanic eruption) and results in hypoxia.
Thehumanbody produces about 12 000–13 000 mmols per day
of CO2 and is excreted primarily via lungs. The CO2 concentration
in plasma is maintained within a narrow range of
40±5 mm Hg (4.7–6 KPa). At plasma concentration of
22.5mmHg (3 KPa) or less death can occur within few minutes.
The cause of death in breathing high concentration ofCO2 is due
to CO2 poisoning, that results in rapid decrease in blood pH
(respiratory acidosis,
Low concentrations of CO2 in the air, or insufficient time for
CO2 in blood to exchange with oxygen (O2) in air such as in the
situations of hyperventilation, can lead to an increase in blood
pH (respiratory alkalosis, >pH 7.45). The reaction of CO2 with
water in the body is catalyzed by the enzyme carbonic anhydrases
(or carbonate dehydratases), which leads to formation of carbonic
acid, followed by dissociation into protons (H+) and bicarbonate
(HCO3-
�). Carbonic acid is buffered in the cell primarily
by hemoglobin and proteins, which have limited capacity.
-
貯蔵
Extremely stable and chemically nonreactive. Store in a tightly
sealed cylinder. Avoid exposure to excessive heat.
-
輸送方法
Carbon dioxide (UN1013, UN2187), Hazard
Class: 2.2; Labels: 2.2-Nonflammable compressed gas. Dry
ice (UN1845), Hazard class 9 is considered a “miscellaneous hazardous material” and does not require a label.
The gas and refrigerated liquid fall in Hazard Class 2.2 and
there is no Packing Group; solid, dry ice falls in Hazard
Class 9. Solid, dry ice carries the symbol “AW.” The letter
“A” restricts the application of requirements of this subchapter to materials offered or intended for transportation
by aircraft, unless the material is a hazardous substance or
a hazardous waste. The letter “W” restricts the application
of requirements of this subchapter to materials offered or
intended for transportation by vessel, unless the material is
a hazardous substance or a hazardous waste. Cylindersmust be transported in a secure upright position, in a wellventilated truck. Protect cylinder and labels from physical
damage. The owner of the compressed gas cylinder is the
only entity allowed by federal law (49CFR) to transport
and refill them. It is a violation of transportation regulations to refill compressed gas cylinders without the express
written permission of the owner.
-
合成方法
炭素または炭化水素の燃焼,炭酸カルシウムの熱分解あるいは酸分解により得られる。
-
純化方法
Pass the gas over CuO wire at 800o to oxidise CO and other reducing impurities (such as H2), then over copper dispersed on Kieselguhr at 180o to remove oxygen. Drying it at -78o removes the water vapour. Final purification is by vacuum distillation at liquid nitrogen temperature to remove non-condensable gases [Anderson et al. J Chem Soc 3498 1962]. Sulfur dioxide contaminant can be removed at 450o using silver wool combined with a plug of platinised quartz wool. Halogens are removed by using Mg, Zn or Cu, heated to 450o. [Glemsner in Handbook of Preparative Inorganic Chemistry (Ed. Brauer) Academic Press Vol I p 647 1963.]
-
廃棄物の処理
Return refillable compressed
gas cylinders to supplier. Vent to atmosphere
-
規制状況(Regulatory Status)
GRAS listed. Accepted for use in Europe as a food additive.
Included in the FDA Inactive Ingredients Database (aerosol
formulation for nasal preparations; IM and IV injections). Included
in the Canadian List of Acceptable Non-medicinal Ingredients.
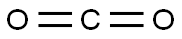

 H+ + HCO3-
H+ + HCO3-