-
外観
黄色の粉末
-
性質
酸化ビスマスは、融点/凝固点が820℃で、沸点が1,890℃です。希塩酸および希硝酸に溶けやすく、水にはほとんど溶けません。α-Bi2O3は、室温でp型の電子伝導性を示し、酸素分圧により550~650℃の間でn型の電子伝導性に変化することが知られています。
-
反応
酸化ビスマスは、鉱酸と反応して対応するビスマス塩を生成します。水に溶解したとは容易に反応して、次炭酸ビスマスを生成します。およびとの反応では、ビスマストリオレートが得られます。
-
溶解性
水, アルカリに不溶。酸に可溶 (塩を生成)。塩酸及び硝酸に溶けやすく、水にほとんど溶けない。
-
解説
Bi2O3(465.96).三酸化二ビスマスともいう.酸化ビスマス(Ⅲ)は,天然には蒼鉛鉱として産出する.硝酸ビスマス(Ⅲ)を加熱分解すると得られる.立方晶系に属する変態が2種類と,単斜晶系,正方晶系の変態が知られている.融点825 ℃.密度8.6~9.0 g cm-3(変態の種類で異なる).水に不溶,酸に可溶.ゴムの加硫,エナメルの製造,陶磁器の着色,低融点ガラス,フェライト,コンデンサー,バリスターなどの電子材料,消毒剤,紙の防炎加工,触媒材料などに用いられる.森北出版「化学辞典(第2版)
-
用途
触媒、フェライト原料
-
用途
中間物、樹脂用添加物、ガラス、その他の無機化学製品、紙用添加物、半導体、その他電子材料等製品
-
用途
うわ薬、触媒、ビスマス化合物の原料。
-
構造
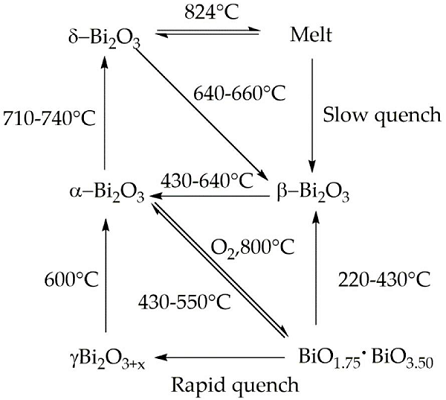
1. 酸化ビスマスの結晶多形
酸化ビスマスには、5つの結晶学的多形があります。室温相で単斜晶構造のα-Bi2O3、高温相で正方晶のβ-Bi2O3、体心立方晶のγ-Bi2O3、立方晶のδ-Bi2O3とε-Bi2O3です。酸化ビスマスがとる構造は、類縁の酸化ヒ素 (As2O3) や酸化アンチモン (Sb2O3) がとる構造とは大きく異なります。
2. α、β相
α-Bi2O3は、酸素原子の層とその間にビスマス原子の層があるという複雑な構造をしています。ビスマス原子はそれぞれ歪んだ6配位と5配位で記述できる、2つの異なる環境にあります。β-Bi2O3は、蛍石(英: Fluorite) に近い構造をとっています。
3. γ、δ、ε相
γ-Bi2O3はBi12SiO20 (英: Bismuth silicon oxide) に類似した構造を持ち、ビスマス原子の一部がケイ素原子の占める位置を占め、Bi12Bi0.8O19.2と書くことができます。δ-Bi2O3は単位格子内の8つの酸素サイトのうち、2つが空になった欠陥蛍石型結晶構造を持っています。ε-Bi2O3はα相とβ相に近い構造を持ちますが、完全に整列したイオン性絶縁体です。
-
製法
酸化ビスマスは、商業的にはビスマスを熱硝酸に溶解することで得られる、次硝酸ビスマスから作られます。を過剰に添加した後の混合物を加熱することで、濃い黄色の粉末として酸化ビスマスが沈殿します。次炭酸ビスマスを約400℃で加熱したり、水酸化ビスマスを燃焼させることによっても得ることができます。
-
化学的特性
Heavy, Yellow Powder
-
物理的性質
Yellow monoclinic crystal or powder; density 8.90 g/cm3; melts at 817°C; vaporizes at 1,890°C; insoluble in water; soluble in acids.
-
天然物の起源
Bismuth trioxide occurs in nature as mineral bismite. The oxide is used in fireproofing of papers and polymers; in enameling cast iron ceramic; and in disinfectants.
-
使用
Bismuth(III) oxide is used in the preparation of BiFeO3perovskite nanoparticles. It finds use in disinfectants, magnets, glass, rubber, vulcanization, fireproofing papers and polymers and catalysts. Bismuth trioxide brings about the "dragon's eggs" effect in fireworks, as a replacement of red lead. Bismuth(III) compounds are attractive reagents and catalysts in organic synthesis because of their low cost and ease of handling. Bismuth trioxide nanoparticles also play an important role in high energy gas generators. The alpha crystalline form of bismuth(III) oxide has p-type electronic conductivity.
-
製造方法
Bismuth trioxide is commercially made from bismuth subnitrate. The latter is produced by dissolving bismuth in hot nitric acid. Addition of excess sodium hydroxide followed by continuous heating of the mixture precipitates bismuth trioxide as a heavy yellow powder. Also, the trioxide can be prepared by ignition of bismuth hydroxide.
-
一般的な説明
Bismuth (III) oxide is a yellow, monoclinic crystalline powder. It is insoluble in water and hydroxide solutions but dissolves in acids to form bismuth (III) salts. It can be prepared by heating bismuth in air or by heating hydroxides, carbonates or nitrates of bismuth.
-
使用用途
1. 合成原料
酸化ビスマスは、触媒やビスマス塩類 (次硝酸ビスマスや等) の原料、あるいはゴムの配合剤として使われています。釉薬 (ゆうやく) や顔料の原料としても利用されています。
2. 電子部品
酸化ビスマスは、・・コンデンサーといった電子部品をはじめ永久磁石、電子材料の原料として利用されています。規制が厳しくなってきている鉛の代替品として、利用範囲を一層広げています。
3. 歯科治療材料
酸化ビスマスは、レントゲンの際に、歯科材料を周囲の歯より不透明にするためにしばしば用いられます。主に、ケイ酸二カルシウムとケイ酸三カルシウムの粉末の混合物とともに、水硬性ケイ酸セメントに10~20質量%添加されます。この材料は、歯根端切除術や吸収穿孔の修復などの歯科治療に使用されています。
-
概要
酸化ビスマス (英: Bismuth oxide) とは、うすい黄色もしくは黄褐色をした粉末の無機化合物です。
ビスマスと酸素から構成され、化学式はBi2O3、分子量は465.96、CAS登録番号は1304-76-3です。別名には、酸化ビスマス (III) があります。
-
Structure and conformation
Bismuth(III) Oxides are the deeply studied class of bismuth compounds, and they present four different phases. At room temperature, monoclinic α-Bi2O3 is the common stable phase with a polymeric-distorted layered structure composed of pentacoordinate bismuth atoms enclosed into pseudo-octahedral units. At a temperature higher than 710 °C, the α phase is converted into the cubic δ phase, which has a defective structure with random oxygen vacancies. The β phase and several oxygen-rich forms are closely related to the δ phase. In particular, the vacancy structures of highly defected bismuth oxides are some sites filled with O?2 and Bi(III) and Bi (V) sites. Bismuth oxide γ-phase also shows a cubic structure, but it is highly unstable and hard to synthesize without supporting it onto other oxides or metallic species. The other two polymorphic metastable bismuth oxide phases are known as the ω phase, stable at temperatures higher than 800 °C and the ε phase, isolated in 2006 by Cornei and co-workers[1].
-
参考文献
G. Malmros, Acta Chem. Scand., 24, 384 (1970), DOI: 10.3891/acta.chem.scand.24-0384.