-
性質
クロム酸は、常温常圧では赤色の固体で、250℃がこの物質の分解点です。また、通常の濃度のクロム酸溶液は黄赤色ですが、高濃度になると赤色ないし濃赤色を呈して、黒っぽい色になります。
水溶液中では、2分子のクロム酸と2分子のオキソニウムイオンが結びついて、1分子の二クロム酸イオンと3分子の水分子に変化するという平衡が成り立っています。pHが1以下の強酸性条件あるいは塩基性条件においては、クロム酸が生成する方向に平衡は傾いているということに気を付ける必要があります。
-
解説
クロム酸,铬(VI)含氧酸H 2 CrO 4,但酸本身尚未分离。有时将氧化铬(VI)称为铬酸,因为铬(VI)CrO 3的水溶液是铬酸溶液。
CrO 3 + H 2 O → H 2 CrO 4
低浓度铬酸溶液呈黄红色,但随着浓度的增加,变为红色或深红色,颜色变深。溶液中存在CrO 4 2-、HCrO 4- 、 Cr 2 O 7 2-等离子,生成高浓度的多元酸离子Cr 3 O 10 2-、Cr 4 O 13 2- 。铬酸根离子在碱性状态下是稳定的,但当它变成酸性时可逆地变为重铬酸根离子Cr 2 O 7 2- 。
2CrO 4 2- + 2H + Cr 2 O 7 2- + H 2 O
Cr 2 O 7 2- + H 2 O
-
用途
金属表面仕上げ剤
-
危険性
クロム酸を含む六価クロムは、非常に毒性が強いことで有名です。クロムのイオンには三価のものと六価のものが存在し、三価のものが自然界に広く安定して存在しているのに対して、六価のものは一部の鉱石などに限定して存在しています。
六価クロムは人間に皮膚に付着すると皮膚炎などの原因になることがあり、体内に摂取してしまうと嘔吐を引き起こします。さらに、DNAを損傷させる作用を持つことから発がん性を持ち、吸入すれば肺がんの原因に、長期間の摂取は大吊架や胃がんの原因になる可能性を持っています。
そのため、六価クロムを粉末状で取り扱う場合には周囲への飛散を防いだ上に、目や鼻、口に入らないよう厳重に管理し、皮膚や衣服にも付着したままで置かないように管理することが必要です。
-
説明
Chromic acid, CrO3, is composed of dark, purplish-red, odorless crystals that are soluble in water. The specific gravity is 2.7, which is heavier than water. It is a powerful oxidizing agent and may explode on contact with organic materials. Chromic acid is a poison, corrosive to the skin, and has a TLV of 0.05 mg/m3 of air. Chromic acid is a known human carcinogen. The four-digit UN identification number is 1463. The NFPA 704 designation is health 3, flammability 0, and reactivity 1. The white section at the bottom of the 704 diamond has an “oxy” prefix, indicating that it is an oxidizer.
-
化学的特性
Chromic acid is a dark purplish-red odorless flakes or crystalline powder
-
使用
Chemicals (chromates, oxidizing agents, catalysts), chromium-plating intermediate, medicine
(caustic), process engraving, anodizing, ceramic
glazes, colored glass, metal cleaning, inks, tanning,
paints, textile mordant, etchant for plastics.
-
定義
The name is in common use, although the true
chromic acid, H2CrO4, exists only in solution.
-
一般的な説明
Chromic acid is a dark purplish red solid, exists only in solution. The hydrate of chromiumoxide, it is used in electroplating baths. Chromic acid is soluble in water with the release of heat. The material itself is noncombustible but Chromic acid will accelerate the burning of combustible materials. Its solution is corrosive to metals and tissue.
-
空気と水の反応
Water soluble.
-
反応プロフィール
A very powerful oxidizing agent, confirmed human carcinogen. Upon contact with reducing reagents Chromic acid can cause a violent explosion, in contact with organic matter Chromic acid may cause a violent oxidation leading to ignition. Dangerously reactive with acetone, alcohols, alkali metals (sodium, potassium), ammonia, arsenic, dimethylformamide, hydrogen sulfide, phosphorus, peroxyformic acid, pyridine, selenium, sulfur, and many other chemicals [Sax, 9th ed., 1996, p. 852]. When mixed with sulfuric acid for glass cleaning operations, used solution in closed bottle may explode due to internal pressure of carbon dioxide arising from contamination by carbon compounds [Bryson, W. R., Chem. Brit., 1975, 11, p. 377].
-
危険性
A human carcinogen. A poison. Corrosive
to skin. Powerful oxidizing agent, may explode on
contact with reducing agents, may ignite on contact with organic materials. Upper respiratory tract
irritant.
-
健康ハザード
Very irritating to eyes and respiratory tract. Ingestion causes severe gastrointestinal symptoms. Contact with eyes or skin causes burns; prolonged contact produces dermatitis (``chrome sores'').
-
火災危険
Behavior in Fire: Containers may explode
-
使用用途
一般に、クロム酸ナトリウム原料、酸化剤、触媒として使用されています。
1. 酸化剤
クロム酸やそのほかのクロム酸塩、三酸化クロムなどの六価クロムを含む化合物は強力な酸化剤であり、有機合成においてよく使用されています。主に、第一級アルコールに作用させてカルボン酸を得たり、第二級アルコールに作用させてケトンを得たりする際に使用される場合が多いです。
試薬や溶媒の条件によってジョーンズ酸化、サレット酸化、コリンズ酸化という名前が付けられています。クロム酸は非常に強い酸化剤であるので、目的物がさらに酸化されて予期せぬ化合物が得られるといった副反応が起きる可能性があり、十分な注意が必要です。
また、クロム酸イオンの水素原子を塩素原子に置き換えたクロロクロム酸イオンとピリジニウムイオンで形成させた塩であるPCCは温和な酸化剤であり、第一級アルコールをアルデヒドに酸化させることができます。これらの酸化反応を行うと、クロム酸は3価のクロムに還元されます。
2. 表面処理剤
写真、メッキ、顔料、皮なめし、染料、染色剤として使用されます。また、金属の化成処理法の1つであるクロム酸処理用としても有用です。処理液に浸漬または陰極電解を行うことによって、耐食性皮膜を付与することができます。このクロム酸処理は、耐食性、塗装の密着性の向上および変色防止の効果があります。
使用時に注意が必要なのは、クロム酸塩および重クロム酸塩 (6価のクロム) は強い酸化性をもち、皮膚・粘膜を強く腐食し、皮膚炎、クロム潰瘍を起こすことです。
-
安全性プロファイル
Confirmed human
carcinogen. Poison by subcutaneous route.
Mutation data reported. A powerful
oxidzer. A powerful irritant of skin, eyes,
and mucous membranes. Can cause a
dermatitis, bronchoasthma, “chrome holes,”
damage to the eyes. Dangerously reactive.
Incompatible with acetic acid, acetic
anhydride, tetrahydronaphthalene, acetone,
alcohols, alkali metals, ammonia, arsenic,
bromine penta fluoride, butyric acid, n,ndimethylformamide, hydrogen sulfide,
peroxyformic acid, phosphorus, potassium
hexacyanoferrate, pyridme, selenium
-
職業ばく露
n chromium plating; medicine, ceramic glazers, and paints.
-
概要
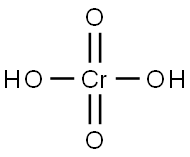
クロム酸とは、H2CrO4で表される化合物です。
(Ⅵ) が、水に溶けてクロム酸塩を生成する物質を総称して指すこともあります。分子量が118.0g/mol、融点が197℃、密度が1.201g/cm3、CAS番号は7738-94-5です。この分子は、三酸化クロムに水が一分子付加したものに等しくなっています。
-
輸送方法
UN1463 Chromium trioxide, anhydrous, Hazard Class: 5.1; Labels: 5.1-Oxidizer, 6.1-Poisonous materials, 8-Corrosive material. UN1755 (solution) Chromic acid, solid, Hazard class: 8; Labels: 8-Corrosive material.
-
不和合性
A strong oxidizer. Aqueous solution is strongly acidic. Reacts with acetic acid, acetic anhydride, acetone, anthracene, chromous sulfide; diethyl ether; dimethyl formamide; ethanol, hydrogen sulfide; methanol, naphthalene, camphor, glycerol, potassium ferricyanide, pyridine, turpentine, combustibles; organics, and other easily oxidized materials (such as paper, wood, sulfur, aluminum, and plastics). Attacks metals in presence of moisture
-
廃棄物の処理
Chemical reduction to chromium(III) can be followed by land fill disposal of the sludge.
-
参考文献
F. Brito, et al., Polyhedron, 16, 3835 (1997), DOI: 10.1016/S0277-5387(97)00128-9.



 Cr 2 O 7 2- + H 2 O
Cr 2 O 7 2- + H 2 O