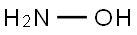-
外観
無色~わずかにうすい黄色, 澄明~ほとんど澄明の液体
-
性質
ヒドロキシルアミンは無色の針状結晶であり、潮解性が非常に高く、揮発性があります。融点は33°Cで、58°Cで分解します。モル質量は33.030g/mol、20°Cでの密度は1.21g/cm3です。
ヒドロキシルアミンは不安定な物質です。室温でも徐々に分解し、湿気やCO2により分解が促進されます。また、加熱や紫外線によって爆発し、アンモニア (NH3) 、窒素 (N2) 、 (N2O) などの物質に変化します。
水、液体アンモニア、に易溶ですが、エーテル、、に難溶です。
-
溶解性
水, メタノール, エタノールに易溶。
-
反応
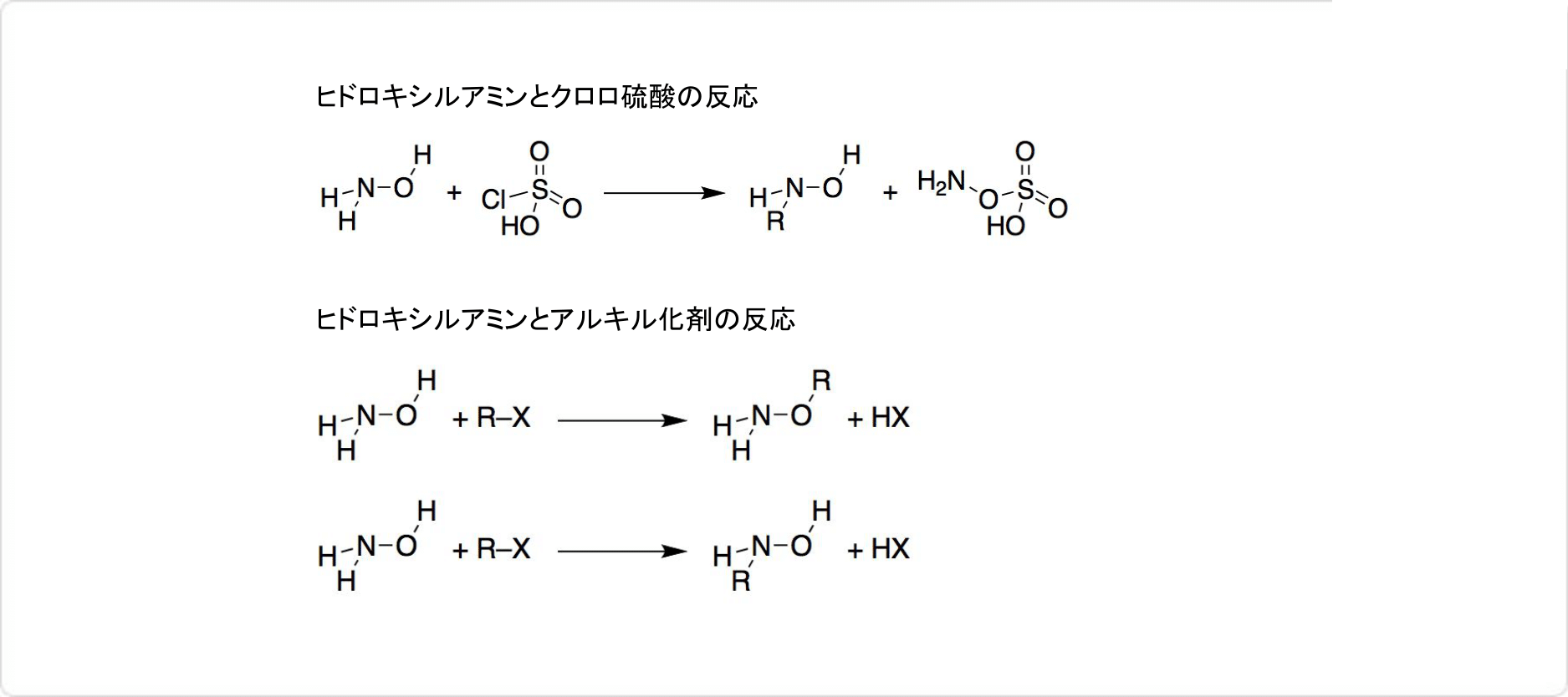
図2. ヒドロキシルアミンの反応
ヒドロキシルアミンはケトンやアルデヒドと反応すると、オキシムが生じます。クロロ硫酸との反応では、ヒドロキシルアミン-O-スルホン酸を生成可能です。
ヒドロキシルアミンは、アルキル化剤などの求電子試薬とも反応します。この反応では、窒素と酸素のいずれの原子も求電子攻撃されます。
-
解説
潮解性,揮発性がある.室温でも徐々に分解するが,湿気やCO2で促進される.また,加熱すると急速に分解が進む(NH3,N2,N2Oなどになる).水,液体アンモニア,メタノールに易溶,エーテル,ベンゼン,クロロホルムなどに難溶.水溶液中では,NH2OH + H2O → NH3OH+ + OH-のように解離してイオンになる.pKb 約7.9.酸と反応して塩となる.溶媒として,アルカリ金属やアルカリ土類金属の塩を溶かす.強い還元性がある.有機合成で,還元剤,付加反応用などに用いられる.有毒.[CAS 7803-49-8]【Ⅱ】ヒドロキシルアンモニウム塩(hydroxylammonium salt):[NH3OH]+ X-.とくに塩化物,硫酸塩などが代表例.(1)硫酸ヒドロキシルアンモニウム:(NH3OH)2SO4(164.14).硫酸ヒドロキシルアミン(hydroxylamine sulfate)ともいう.(NH4)2SO3,NH4NO2およびSO2間の反応や,ニトロパラフィンに硫酸を加えて加水分解するか,硝酸に硫酸を加え電解還元すると得られる.無色の単斜晶系結晶.[NH3OH]+ を含むイオン結晶.融点170 ℃(分解).水に易溶(水溶液は強酸性),エタノール,エーテルに不溶.強還元剤,金属や皮膚をおかす.合成用薬剤,還元剤などに用いられる.有毒.
森北出版「化学辞典(第2版)
-
構造
ヒドロキシルアミン,固体ではトランス形のみ,気体では両者が混在している.固体は無色の単斜晶系結晶.密度約1.20 g cm-3(0 ℃).N-O約1.47 Å,O-H約0.97Å,N-H約1.03 Å.∠H-O-N約102°,∠H-N-O約107°,∠H-N-H約107°.融点33 ℃,沸点142 ℃(一部分解.22 mmHg では,57 ℃).
-
用途
ヒドロキシルアミンおよびその塩類は多くの有機化学、無機化学反応において還元剤として一般的に用いられる。脂肪酸の酸化防止剤としての作用もある。化学以外での利用法としては、獣皮の脱毛や写真の現像液などがある。半導体の洗浄剤として利用される。農薬の原料にもなる。
硝酸ヒドロキシルアンモニウムはロケットの推進剤として、一液推進薬(水溶液)、固体燃料の両方が研究されている。
-
用途
有機合成用。
-
製造
ヒドロキシルアミン:NH2OH(33.03).塩からつくる.たとえば,[NH3OHCl]を,Na(OC2H5)とエタノール中で反応させるか,Na3PO4と反応させてリン酸塩とし,これを減圧下熱分解すると得られる.
-
合成法
ラシヒ法を用いて、ヒドロキシルアミンを合成可能です。0°Cで亜硝酸アンモニウム水溶液をHSO4-/SO2によって還元すると、ヒドロキシルアミド-N,N-ジスルフェートが生成し、加水分解により硫酸塩である(NH3OH)2SO4が得られます。
この硫酸塩を液体アンモニアで処理すると、固体のヒドロキシルアミンが生成します。液体アンモニアに溶けない硫酸アンモニウムを濾別して、減圧下でアンモニアを除去可能です。それ以外にも、ヒドロキシルアンモニウム塩を経由する合成法もあります。
亜硫酸イオンにより亜硝酸や亜硝酸ナトリウムを還元すると、ヒドロキシルアミド-N-スルフェートが生成し、加水分解によってヒドロキシルアンモニウム塩が得られます。ナトリウムブトキシドを用いて中和すると、ヒドロキシルアミンを生成可能です。
-
説明
Hydroxylamine was first synthesized by Wilhem Clemens
Lossen in 1865 in the laboratory of Wilhelm Heinrich Heintz
while working in Halle. The Lossen synthesis originally generated
hydroxylamine in aqueous solution. Anhydrous hydroxylamine
was prepared later by Lobry de Bruyn and Crismer in
1891. The free base is extremely volatile, and industrial-scale
production has been fraught with problems, including large
explosions at facilities in the United States and Japan. Much of
the hydroxylamine produced and transported is in salt form or
as a dilute aqueous solution.
-
化学的特性
slightly yellow liquid
-
物理的性質
White crystalline solid; orthogonal plates or needles; unstable; density 1.21g/cm3at 20°C; melts at 33°C; vaporizes at 58°C; very soluble in water, liquidammonia and lower alcohols; sparingly soluble in most other organic solvents;decomposes in hot water; pKa5.94 at 25°C.
-
使用
Hydroxylamine is used as a reducing agent in photography, in
synthetic and analytical chemistry, as an antioxidant for fatty
acids and soaps, and as a dehairing agent for hides. In addition,
hydroxylamine is used in the production of cyclohexanone
oxime, an isomer of caprolactam, which is an intermediate in
the production of nylon-6. In the semiconductor industry,
hydroxylamine can be a component of a solution that dissolves
a photoresist following lithography. Hydroxylamine can also
be used to selectively cleave asparaginyl-glycine peptide bonds.
-
製造方法
Hydroxylamine is unstable as a free base. It is prepared from hydroxy-lamine hydrochloride, NH2OH?HCl, which is obtained by electrolytic reduc-tion of ammonium chloride solution. The hydrochloride undergoes alkalinedecomposition to hydroxylamine, which is collected by vacuum distillation.
-
定義
ChEBI: The simplest hydroxylamine, consisting of ammonia bearing a hydroxy substituent. It is an intermediate in the biological nitrification by microbes like bacteria.
-
一般的な説明
Odorless white crystalline solid. Sinks and mixes with water.
-
空気と水の反応
Decomposes rapidly at room temperature or when dissolved in hot water by internal oxidation-reduction. Reacts with water or steam to produce heat and corrosive liquids.
-
反応プロフィール
HYDROXYLAMINE is a white solid, thermally unstable, decomposes rapidly at room temperature or when dissolved in hot water by internal oxidation-reduction. HYDROXYLAMINE should be stored below 10° C [Bailar, 1973, vol. 2, p. 272]. Explosive reaction with strong oxidizers (chromium trioxide, potassium dichromate) or powdered zinc upon heat. Reaction with zinc or calcium produces explosive bishydroxylamides. HYDROXYLAMINE ignites on contact with cupric sulfate, alkali metals (sodium, potassium), oxidants (e.g., barium oxide, barium peroxide, lead dioxide, potassium permanganate, chlorine), phosphorus trichloride and pentachloride. HYDROXYLAMINE reacts vigorously with hypochlorites, pyridine, carbonyls [Sax, 9th ed., 1996, p. 1875]. On contact with organic materials in thin layer (e.g., crystals on filter paper), HYDROXYLAMINE may ignite spontaneously in air. HYDROXYLAMINE explodes when heated above 70° C [Brauer, 1963, vol. 1, p. 502]. During a distillation process, an explosion occurred. Potassium hydroxide is thought to be involved in the explosion. Employees in the plant complained of chest pains and suffered chemical burns. Five people were killed by the explosion.
-
危険性
Decomposes rapidly at room temperature,
violently when heated, detonates in flame-heated
test tube. Irritant to tissue.
-
健康ハザード
INHALATION: Moderately toxic by inhalation and oral routes with the following symptoms possible: headache, vertigo, tinnitus, dyspnea, nausea and vomiting, cyanosis, proteinuria and hematuria, jaundice, restlessness, and convulsion. Methemoglobinemia has been reported. EYES: Corrosive - highly irritating. SKIN: Irritating or corrosive to skin. INGESTION: Moderately toxic by inhalation and oral routes with the following symptoms possible; headache, vertigo, tinnitus, dyspnea, nausea and vomiting, cyanosis, proteinuria and hematuria, jaundice, restlessness, and convulsion. Methemoglobinemia has been reported.
-
使用用途
ヒドロキシルアミンおよびその塩類は、多くの有機化学や無機化学の反応で、還元剤として用いられます。オキシムの合成、の原料であるの合成にも使用可能です。分析試薬、酵素の再活性化剤としての用途もあります。
工業用途は、獣皮の脱毛剤や写真現像液、半導体の洗浄剤、医薬品・農薬の原料、タバコ甘味剤、せっけん、脂肪酸の酸化防止剤および安定剤などです。さらに、硝化作用や嫌気性アンモニア酸化の生物学的中間体として、窒素循環や廃水処理で重要な役割を担っています。
-
接触アレルゲン
Hydroxylamine and its salts are used in various
branches of industry, as reducing agents in color film
developers or as reagents in laboratories.
-
発がん性
Carcinogenicity of hydroxylamine and
its salts has not been demonstrated. Several
studies have shown a decreased incidence of
spontaneous mammary tumors in mice exposed
to the sulfate and hydrochloride.3–7 There was
some indication of an increase in the incidence
of spontaneous mammary tumors when the
sulfate was administered to older animals
whose mammary glands were already well
developed.
-
環境運命予測
The large-scale production and use of hydroxylamine may
result in its release to the environment through various waste
streams. Hydroxylamine will exist solely as a vapor in the
ambient atmosphere, and will be degraded in the atmosphere
by reaction with photochemically produced hydroxyl radicals;
the half-life for this reaction in air is estimated to be 18 h.
Abiotic degradation of hydroxylamine by photochemically
produced peroxy radicals is an important environmental fate
process in surface waters, with the half-life of the reaction
measured at approximately 2 h. An estimated bioconcentration
factor of 3 suggests that the potential for bioconcentration in
aquatic organisms is low. If released terrestrially, hydroxylamine
will most likely exist in its protonated form due to its
pKa of 5.94; the protonated form is nonvolatile. Koc estimates
of 14 for hydroxylamine suggest that it may have very high
mobility in soil.
-
純化方法
Crystallise it from n-butanol at -10o, collect it by vacuum filtration and wash it with cold diethyl ether. Harmful vapours. [Hurd Inorg Synth I 87 1939, Semon in Org Synth Coll Vol I 318 1932.]