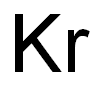-
解説
クリプトン,原子番号36の元素.電子配置[Ar]3d104s24p6の周期表18族希ガス元素.原子量83.798(2).安定同位体核種は,質量数78(0.355(3)%),80(2.286(10)%),82(11.593(31)%),83(11.500(19)%),84(56.987(15)%),86(17.279(41)%)の6種.質量数69~97までの27種の放射性核種が知られている.81Kr がもっとも長寿命で,半減期2.29×105 y で軌道電子捕獲により 81Br に崩壊する.もっとも重要な核種は,核分裂生成物の一つである 85Kr(クリプトン85)で,半減期10.78 y のβ崩壊核種.
森北出版「化学辞典(第2版)
-
性質
クリプトン,無色,無臭の気体.融点-157.36 ℃,沸点-152.3 ℃,臨界温度-63.69 ℃(209.46 K),三重点-157.39 ℃(115.76 K).密度2.443 g cm-3(115.77 K,液体).第一イオン化エネルギー1350.7 kJ mol-1(13.9996 eV).化学的に不活性であるが,1963年にKrF2が合成された([別用語参照]クリプトン化合物).
-
用途
クリプトン用途は,橙赤色の発光スペクトル線を利用して,空港等の施設の照明灯,投影用ランプ充填ガスなど.クリプトンガスレーザーは網膜などの手術に使われる.1983年の国際度量衡機構総会で真空中の光速を基準にするまで,1960年から 86Kr の橙赤色スペクトル線の波長605.780211 nm の1650763.73倍が1 m と定義されていた.
-
構造
クリプトンには、31種類の同位体が知られています。天然には、安定同位体が5種類と放射性同位体が1種類存在します。
水やヒドロキノンとは、包接化合物を形成可能です。化学式はKr・6H2OとKr・3C6H4(OH)2です。水素化クリプトン (Kr(H2)4) の結晶は、5GPa以上で得られます。
この結晶はランダムに配向された水素分子に、クリプトンの八面体が囲まれた面心立方構造を取っています。
-
製法
火星の大気中にも0.3体積 ppm 存在する.液体空気の分留最後の留分から得られるクリプトン.
-
説明
Krypton, Kr, is an elemental, colorless, odorless inert gas. It is noncombustible, nontoxic, and nonreactive; however, it is an asphyxiant gas and will displace oxygen in the air. Krypton 85 is radioactive and has a half-life of 10.3 years. The four-digit UN identification number for krypton is 1056 as a compressed gas and 1970 as a cryogenic liquid. These forms of krypton are not radioactive. Radioactive isotopes of krypton are shipped under radioactive labels and placards as required. Its primary uses are in the activation of phosphors for self-luminous markers, detecting leaks, and in medicine to trace blood flow.
-
化学的特性
colourless gas
-
物理的性質
Krypton is a rather dense, tasteless, colorless, odorless gas. Its critical temperature isbetween that of oxygen and carbon dioxide. It is extracted during fractional distillation ofliquid oxygen at a temperature of about –63.8°C. At one time it was thought that krypton, aswell as the other noble gases, were completely inert. However, in 1967 scientists were able tocombine fluorine with krypton at low temperatures to form the compound krypton difluoride(KrF2). In this case krypton has a valence of 2.
Krypton’s melting point is –156.6°C, its boiling point is –152.30°C, and its density is0.003733g/cm3.
-
同位体
There are a total of 37 isotopes of krypton. Six of these are stable: Kr-78, Kr-80,Kr-82, Kr-83, Kr-84, and Kr-86. The isotope Kr-78 has such a long half-life (0.9×10+20years) that it is considered stable even though it contributes only 0.35% to the naturalkrypton in the Earth’s atmosphere. All the others are radioactive, man-made by-productsof nuclear power plants and radioactive isotopes with half-lives ranging from 107 nanosecondsto 2.29×10+15 years.
-
名前の由来
The name “krypton” is derived from the Greek word kryptos, meaning
“hidden.”
-
天然物の起源
Krypton is the 81st most abundant element on Earth and ranks seventh in abundance ofthe gases that make up Earth’s atmosphere. It ranks just above methane (CH4) in abundancein the atmosphere. Krypton is expensive to produce and thus has limited use. The gas is capturedcommercially by fractional distillation of liquid air. Krypton shows up as an impurity inthe residue. Along with some other gases, it is removed by filtering through activated charcoaland titanium.
There are traces of krypton in some minerals and meteorites. Krypton is found beyondEarth in space.
-
特性
Krypton is the fourth element in group 18 (VIIIA), which is also known as group 0 becausethe elements is this group were thought to have a zero oxidation point. Krypton has many ofthe chemical properties and characteristics of some of the other noble gases.
The fragile compounds formed by noble gases at low temperatures, such as KrF2, are calledclathrates.
-
使用
Krypton is expensive to produce, which limits its use as an inert gas. It is used in a mixturewith argon to fill incandescent light bulbs, fluorescent lamps, lasers, and high-speed photographylamps. Radioactive Kr-85 is used as a source of radiation to measure the thickness ofindustrial materials. It is also used to test for “leakage” of scientific instruments.
Since 1960 the wavelength of the spectral lines of the krypton-86 isotope has been usedas the standard for the length of the meter. One meter is now defined as 1,650,762.73 wavelengthsof the reddish-orange spectral line of the Kr-86 isotope.
-
定義
A colorless odorless
monatomic element of the rare-gas group,
known to form unstable compounds with
fluorine. It occurs in minute quantities
(0.001% by volume) in air. Krypton is used
in fluorescent lights. Symbol: Kr; m.p.
–156.55°C; b.p. –152.3°C; d. 3.749 (0°C)
kg m–3; p.n. 36; r.a.m. 83.80.
-
調製方法
Most krypton produced in commercial scale comes from air. Krypton and other inert gases are obtained from air by a distillation-liquefaction process. Different types of air-separation plants varying in design are known for commercial production of nitrogen, oxygen, and inert gases (See Helium).
Krypton also may be recovered from spent fuel rods of nuclear power plants. It is produced, along with xenon, in fission of uranium and plutonium. This process, however, is not a major source of krypton, and the recovered gas also contains radioactive Kr-85 isotope.
.
-
一般的な説明
Krypton, refrigerated liquid, is a colorless, odorless gas. KRYPTON is shipped as a liquid under its own vapor pressure. Contact with the liquid may cause frostbite to unprotected skin. KRYPTON can asphyxiate by displacement of air. Exposure of the container to prolonged heat or fire may cause KRYPTON to rupture violently and rocket.
-
反応プロフィール
These substances undergo no chemical reactions under any known circumstances. They are nonflammable, noncombustible and nontoxic. They can asphyxiate. Contact of very cold liquefied gas with water may result in vigorous or violent boiling of the product and extremely rapid vaporization due to the large temperature differences involved. If the water is hot, there is the possibility that a liquid "superheat" explosion may occur. Pressures may build to dangerous levels if liquid gas contacts water in a closed container [Handling Chemicals Safely 1980].
-
危険性
Being an inert gas, krypton is nontoxic. However, the man-made radioisotopes of kryptoncan cause radiation poisoning.
-
健康ハザード
Vapors may cause dizziness or asphyxiation without warning. Vapors from liquefied gas are initially heavier than air and spread along ground. Contact with gas or liquefied gas may cause burns, severe injury and/or frostbite.
-
火災危険
Non-flammable gases. Containers may explode when heated. Ruptured cylinders may rocket.
-
その他の情報
クリプトンの化合物
クリプトンは不活性ですが、フッ素と酸化数が+2の不安定な化合物を生成可能です。二フッ化クリプトンは揮発性の固体で、化学式はKrF2と表されます。KrF2の分子構造は直線形で、Kr-F間の距離は188.9pmです。強酸との反応によって、KrF+やKr2F3+のような陽イオンが生じます。
KrF2とB(OTeF5)3の反応によって、クリプトン-酸素結合を含む不安定な化合物であるKr(OTeF5)2を生成可能です。クリプトン-窒素結合は、-50°C以下でKrF2と[HC=NH]+[AsF6-]との反応で生じる[HC=N–Kr–F]+にも見られます。HKrCNやHKrC=CH は、40Kまで安定だと報告されています。
-
使用用途
クリプトンは他の物質と反応しにくいため、不活性ガス・不燃性ガスとして幅広く用いられています。代表的な例として、照明やランプの封入ガスが挙げられます。クリプトンは熱伝導率が低く、電球のからの放熱による熱損失を抑制可能です。
アルゴンが封入された電球と比べて、ランプ効率が10%程向上すると言われています。さらに、高い断熱特性を持つクリプトンは、建築材料としても活用されています。屋内全体の暖房効率を上げるために、クリプトンが封入された窓ガラスを使用可能です。
また、先端分野では半導体を製造する際のエッチングレーザーの光源として、KrFが広く用いられています。
-
同位体
クリプトンの同位体
81Krは大気中での反応によって生じます。半減期は25万年であり、クリプトンの天然同位体の原料です。水面近くのクリプトンは非常に揮発しやすく、81Krは地下水の5万〜80万年の年代測定に利用されます。
78Krは二重電子捕獲が起こる核種です。ただし、確率は低く、半減期は1.1×1020年以上と見積もられています。不活性の放射性ガスである85Krの半減期は10.76年です。プルトニウムやウランの核分裂反応で生じ、原子炉の中で製造されて、燃料棒の再処理の過程で環境にすべて放出されます。
1940年代の85Krの大気中濃度は、1m3の空気に対して0.001ベクレル以下でした。しかし、現在の濃度は、1m3で1ベクレル以上です。南極より北極の方が30%も濃度が高いと報告されています。これは原子炉の多くが、北半球に位置するためです。85Krはベータ崩壊によって、85Rbになります。
-
工業用途
Krypton, which occurs in the air to the extentof 1 part in 1 million, is a heavy gas used as afiller for fluorescent lamps to decrease filamentevaporation and heat loss and to permit highertemperatures in the lamp. Krypton-85, obtainedfrom atomic reactions, is a beta-ray emitter usedin luminous paints for activating phosphors andalso as a source of radiation.