-
外観
白色の粉末
-
性質
炭酸バリウムは、水にはほとんど溶けません。20°Cにおける水への溶解度は、0.0024g/100mLです。ただし、を含む水には、炭酸水素バリウムとなって溶けます。炭酸バリウムは、、にも溶解しますが、には溶けません。
炭酸バリウムの融点は811°Cです。空気中で炭酸バリウムが加熱されると、1,450℃で分解します。酸によっても分解し、二酸化炭素を発生します。
-
溶解性
水に難溶 (2.2×10^(-3)g/100ml, 8℃)。希塩酸及び希硝酸に溶け、希硫酸及び水にほとんど溶けない。水及びエタノールにほとんど溶けない。
-
解説
炭酸バリウム,融点1740 ℃(90 atm).密度4.43 g cm-3.空気中で加熱すると1450 ℃ で分解する.水に難溶.バリウム塩,光学ガラス,ブラウン管,電子材料,蛍光体,うわぐすり,塗料などの原料,殺そ剤などに用いられる.有毒.
森北出版「化学辞典(第2版)
-
用途
ファインセラミックス原料。
-
用途
バリウム塩の原料、窯業用金属熱処理剤
-
用途
超電導用材料、ファインセラミックスの原料。
-
用途
合成中間体、染料、顔料、塗料、光学材料、蓄電池、金属熱処理剤、窯業
-
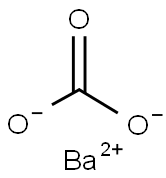
構造
炭酸バリウムはバリウムの炭酸塩であり、通常の炭酸バリウムは無色の結晶です。バリウムイオン (Ba2+) と炭酸イオン (CO32-) の両イオンの配列は、中のカリウムイオン (K+) と硝酸イオン (NO3-) の両イオンと配列が同じです。
この斜方状結晶以外にも、非晶質と六方晶系結晶の二変態が存在し、これら三変態をα形、β形、γ形と呼びます。高圧二酸化炭素中811℃で斜方晶系のγ形は非晶質のβ形になり、982℃で六方晶系のα形に転移します。
炭酸バリウムの化学式はBaCO3、モル質量は197.34g/mol、密度は4.286g/cm3です。屈折率 (nD) は1.60で、標準生成熱 (ΔfHo) は−1,219kJ/molです。
-
合成法
炭酸バリウムは、水酸化バリウム水溶液に二酸化炭素を通すと生成します。バリウム塩水溶液に炭酸アルカリを加えても、沈殿物として炭酸バリウムを得ることが可能です。
工業的には、重晶石を600~800℃で炭素還元し、生成したの熱水溶液に、二酸化炭素を通すことによって製造しています。
-
製造
炭酸バリウム,天然には毒重石として産出する.バリウム塩水溶液に炭酸アルカリを加えるか,水酸化バリウム水溶液に二酸化炭素を通じると得られる.α,β,γ形の三変態がある.普通は斜方晶系のγ形だが,高圧二酸化炭素中811 ℃ で非晶質のβ形に,982 ℃ で六方晶系のα形に転移する.
-
危険性
炭酸バリウムは塩酸に溶けて、バリウムイオンを有する水溶液となります。したがって、X線撮影の造影剤として誤ってを使用すると、塩酸を含んでいる胃酸に溶けるため、有毒なバリウムイオンを生成して危険です。このような理由から、炭酸バリウムを含む天然鉱物に毒重石という名称が付けられました。
ウィリアム・ウィザリング (英: William Withering) は、化学的に毒重石と重晶石が違うことを発見しました。重晶石とは硫酸塩鉱物の1種であり、化学組成は硫酸バリウム (BaSO4) です。を含んだ水によって、毒重石は硫酸バリウムに変化するため、結晶の表面が重晶石で覆われている場合がよくあります。
-
説明
Barium carbonate has the molecular formula of
BaCO3 and the molecular weight of 197.3359 g/mol. Its
CAS number is 513-77-9. Barium carbonate has only
one stable form (aragonite-type structure) and temperature
of precipitation has no effect on crystal form, unlike
that of calcium or magnesium carbonates.
-
化学的特性
Barium carbonate, BaCO3, also known as witherite, is a white powder that is soluble in acids,with the exception of sulfuric acid.It has a melting point of 174°C and is used in television picture tubes, rodenticide, optical glass and ceramic flux.

Barium oxide, BaO, is manufactured by decomposition of barium carbonate.
-
物理的性質
White powder; orthorhombic crystal system; density 4.286 g/cm3; refractive index 1.60; hardness 3.50 Mohs; melts at 811°C; insoluble in water (c. 25 mg/L at 25°C); Ksp 2.0 x 10-9.
-
天然物の起源
Barium carbonate is found in nature as mineral witherite. The compound has many major commercial applications in brick, glass, ceramics, oil-drilling, photographic and chemical industries. It is mixed with wet clay to immobilize many water-soluble salts in making uniform red bricks. In the glass industry, barium is added to glass as barium carbonate or barium oxide to improve the refractive index of optical glass; also to promote sintering and lower the viscosity of melted glass to make glass bead formation easy. It is used in the manufacture of television picture tubes and photographic paper. Another important application involves its use as a fluxing ingredient in ceramic industry for enamels, glazes and ceramic bodies. Barium carbonate is used in oil-well drilling to insolubilize gypsum and inhibit coagulation; in ferrous metallurgy for steel carburizing; in chlor-alkali cells for treating salt brines to remove sulfates; and to make ferrite, and barium titanate. Many barium salts are prepared from barium carbonate.
-
使用
Barium carbonate has many major commercial applications
in brick, glass, ceramics, oil-drilling, photographic
and chemical industries. It is mixed with wet clay to
immobilize many water-soluble salts in making uniform
red bricks. In the glass industry, barium is added to glass
as barium carbonate or barium oxide to improve the
refractive index of optical glass and also to promote sintering
and lower the viscosity of melted glass to make
glass bead formation easy. It is used in the manufacture
of television picture tubes and photographic paper.
Another important application involves its use as a fluxing
ingredient in ceramic industry for enamels, glazes
and ceramic bodies. Barium carbonate is used in oil
well drilling to insolubilize gypsum and inhibit coagulation;
in ferrous metallurgy for steel carburizing; in chloralkali
cells for treating salt brines to remove sulfates; and
to make ferrites, and barium titanate. Many barium salts
are prepared from barium carbonate.
-
定義
barium carbonate: A white insolublecompound, BaCO3; r.d. 4.43. It decomposeson heating to give bariumoxide and carbon dioxide:
BaCO3(s) → BaO(s) + CO2(g)
The compound occurs naturally asthe mineral witherite and can be preparedby adding an alkaline solutionof a carbonate to a solution of a bariumsalt. It is used as a raw materialfor making other barium salts, as aflux for ceramics, and as a raw materialin the manufacture of certaintypes of optical glass.
-
製造方法
Barium
carbonate is made commercially from barium sulfide
either by treatment with sodium carbonate or ammonium
carbonate at 60 to 70°C or by passing CO2 gas
through a soluble Ba2+
solution at 40 to 90°C.
-
一般的な説明
Barium carbonate is a white powder. Barium carbonate is insoluble in water and soluble in most acids, with the exception of sulfuric acid. Barium carbonate has a specific gravity of 4.275. Barium carbonate is toxic by ingestion.
-
空気と水の反応
Barium carbonate is insoluble in water and soluble in most acids, with the exception of sulfuric acid.
-
反応プロフィール
Salts, basic, such as Barium carbonate, are generally soluble in water. The resulting solutions contain moderate concentrations of hydroxide ions and have pH's greater than 7.0. They react as bases to neutralize acids. These neutralizations generate heat, but less or far less than is generated by neutralization of the bases in reactivity group 10 (Bases) and the neutralization of amines. They usually do not react as either oxidizing agents or reducing agents but such behavior is not impossible.
-
危険性
A poison.
-
健康ハザード
(INGESTION ONLY): excessive salivation, vomiting, severe abdominal pain, and violent purging with watery and bloody stools; a slow and often irregular pulse and a transient elevation in arterial blood pressure; tinnitus, giddiness and vertigo; muscle twitchings, progressing to convulsions and/or paralysis; dilated pupils with impaired accommodation; confusion and increasing somnolence, without coma; collapse and death from respiratory failure and cardiac arrest.
-
火災危険
Non-combustible, substance itself does not burn but may decompose upon heating to produce corrosive and/or toxic fumes. Some are oxidizers and may ignite combustibles (wood, paper, oil, clothing, etc.). Contact with metals may evolve flammable hydrogen gas. Containers may explode when heated.
-
化学性质
白色固体,水に難溶
-
使用用途
炭酸バリウムは、バリウム塩やクリスタルガラス、ブラウン管に使用されるバリウムガラスなどの原料として用いられています。また、電極、塗料、エナメル、陶磁器・琺瑯の釉薬、金属熱処理の浸炭剤、紙などといった用途にも利用可能です。
近年では、炭酸バリウムは、電子材料用の原料として幅広く使用されています。主に、等に使われるや複合酸化物などの原料として使用可能です。
それ以外にも、用の原料、・半導体用スパッタガラス用の原料、蛍光体材料のバリウム成分の原料などとしても、幅広く利用されています。さらに、炭酸バリウムには毒性があるため、殺虫剤や殺鼠剤にも使用されています。
-
安全性プロファイル
Poison by ingestion,
intravenous, and intraperitoneal routes.
Human systemic effects by ingestion:
stomach ulcers, muscle weakness,
paresthesias and paralysis, hypermotility,
diarrhea, nausea or vomiting, lung changes.
Experimental reproductive effects.
Incompatible with BrF3 and 2-
furanpercarboxylic acid. See also BARIUM
COMPOUNDS (soluble).
-
合成方法
鉱石を煙炭またはコークスと粉砕混合,還元焙焼して得られる硫化バリウムを熱水で浸出し,炭酸ナトリウムを加える