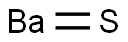-
性質
硫酸バリウムBaSO4(工業的には重晶石)を炭素Cとともに600~800℃に熱し,還元して製造される。 BaSO4+2C―→BaS+2CO2無色の結晶(等軸晶系)。比重4.25(15℃)。Ba2+とS2-のイオンから成る岩塩NaCl型のイオン結晶で,融点は2000℃以上と高いが,空気中で酸化されて黄色をおび,湿気にあうと硫化水素を発生するなど,反応性に富む物質である。気中では酸化されて黄色を呈し,湿気により硫化水素を発生する。水には不溶だが,徐々に加水分解して硫化水素バリウムBa(HS)2と水酸化バリウムBa(OH)2を生ずる。冷水に微溶,塩化アンモニウム溶液に可溶,酸によく溶け硫化水素を発生する。空気中では酸化されて黄色を呈し,湿気により硫化水素を発生する。
-
解説
BaS(169.39).約1000 ℃ に熱した炭酸バリウムに硫化水素と水素との等モル混合気体を通じると得られる.無色の立方晶系結晶.密度4.25 g cm-3(15 ℃).融点2200 ℃.空気中では酸化されてチオ硫酸バリウムを生じる.また,水分と二酸化炭素を吸収して硫化水素を発生する.水を加えると加水分解して硫化水素バリウムと水酸化バリウムを生じる.酸に溶けて硫化水素を発生する.エタノールに不溶.有毒.森北出版「化学辞典(第2版)
-
製法
硫化バリウムは、古来実施していた方法で用いる蛍石の代わりに、コークスを使って硫酸バリウムを熱化学的還元することで製造されます (BaSO4+2C→BaS+2CO2)。この種の変換は、炭素熱還元と呼ばれています。約1,000℃に熱したに硫化水素と水素との等量混合気体を通じることでも得ることができます。
-
特徴
原論文中6.3748 kXとあるものを1 kX=1.002077 Å(for CuKα)により換算
-
化学的特性
colourless crystals, or white to grey-brown powder,
-
物理的性質
Colorless crystalline solid; density 4.25 g/cm3; refractive index 2.155; melts at 1,200°C; soluble in water (decomposes); insoluble in alcohol.
-
天然物の起源
Barium sulfide occurs in the form of black ash, which is a gray to black impure product obtained from high temperature carbonaceous reduction of barite. It is the starting material in the manufacture of most barium compounds including barium chloride and barium carbonate. It is used in luminous paints; for dehairing hides; as a flame retardant; and for generating H2S.
-
使用
Barium sulfide has different characters, so it is used in a variety of ways, such as in electronics, paint pigments, dehairing hides, flame retardant, luminous paints, and generating pure hydrogen sulfide. Barium sulfide can deviate X-rays and helps to give clearly image of the soft tissue. Barium sulfide is a precursor to other barium compounds and also used as a short wavelength emitters for electronic displays.
-
製造方法
Barium sulfide can be
prepared by the direct reaction of the elements, calcined
in an inert atmosphere, at a 1:1.05 molecular ratio:
Ba+S+heat→BaS
Barium sulfide is prepared commercially by heating
barite (BaO) with coal or petroleum coke in a rotary kiln
at 1000°C to 1250°C in an oxygen-free atmosphere. The
product, black ash, is a gray or black powder containing
carbonaceous impurities and unreacted barite. Barium
sulfide is separated from impurities by extraction with
hot water and filtration. Barium sulfide may also be made by high temperature reduction of barium sulfate with methane.
-
調製方法
Barium sulfide is grayish-white solid, formed by heating barium sulfate and carbon, reactive with H2O to form barium hydrosulfide, Ba(SH)2, solution. The latter is also made by saturation of barium hydroxide solution with H2S. Barium polysulfides are formed by boiling barium hydrosulfide with sulfur.
-
一般的な説明
Barium sulfide (BaS) is an inorganic compound that is used as a precursor in the production of barium compounds. These compounds can be used in a variety of applications, such as ceramics, luminous paints, additives, and flame retardants.
-
危険性
Highly toxic by ingestion (see Barium).
-
使用と保管
3. 取扱いおよび保管上の注意
取扱い及び保管上の注意は、下記の通りです。
- 容器を密栓し、冷暗所に保管する。
- 熱や発火源から遠ざける。
- 耐腐食性あるいは耐腐食性内張りのある容器に保管する。
- 屋外や換気の良い区域のみで使用する。
- 粉塵が飛散しないように注意する。
- 混触危険物質とされる酸、酸化剤、リン酸化物、鉛、塩素酸カリウム、硝酸カリウムとの接触を避ける。
- 使用時は保護衣、保護手袋、保護眼鏡、保護面を着用する。
- 取扱い後はよく手を洗浄する。
- 皮膚に付着した場合は、全ての汚染された衣類を脱ぎ、皮膚を流水かシャワーで洗い流し、直ちに医師を呼ぶ。
- 眼に入った場合は、多量の水で注意深く洗い、直ちに眼科医の診察を受ける。
-
使用用途
硫化バリウムの使用用途は、ゴムの加硫、硫化水素の発生用試薬などとして用いられます。またと混合してリトポンと呼ばれる白色の顔料を製造するのに使用されます。硫化バリウムは、銅やその合金の表面を黒色に着色する硫化着色法と呼ばれる方法で用いる硫化物の一つとしても使用できます。
硫化バリウムの多硫化物として、黄色結晶の三硫化バリウム (BaS3)、淡赤色の斜方晶系柱状晶の四硫化バリウムなどがあります。これらの混合物は硫化バリウム華と呼ばれ、殺虫剤や皮革の脱毛剤として用いられます。
また有毒のため急性中毒や刺激性があり、酸と接触すると硫化水素ガスが発生するため注意が必要です。保護具として、保護眼鏡や保護手袋、保護衣、防じんマスクなどの使用が想定されます。
-
安全性プロファイル
A poison. Flammable
by spontaneous chemical reaction, air,
moisture, or acid fumes may cause it to
ignite. For explosion and disaster hazards,
see SULFIDES. To fight fire, use CO2, dry
chemical. Reacts violently with
phosphorus(V) oxide. Mxtures with lead
dioxide, potassium chlorate, or potassium
nitrite explode when heated. Incompatible
with Cl2O, Ca(NO3)2, r(NO3)2, Ca(ClO3)2,
Sr(ClO3)2, (ClO3)2. See also BARIUM
COMPOUNDS (soluble) and SULFIDES.
-
概要
硫化バリウム (英: Barium sulfide) とは、硫黄臭のある白色の結晶性の粉末です。
硫黄とバリウムで構成される無機化合物で、化学式はBaS、分子量は169.39、CAS登録番号は21109-95-5です。塩化ナトリウム型の立方晶系結晶で、バリウムと硫黄を中心に持つ八面体構造をしています。硫化バリウムは、イタリアの錬金術師ヴィンセンツォ・カシャロロ (Vincenzo Casciarolo、1571–1624) によって、硫酸バリウム (BaSO4) の熱化学的還元を介して初めて調製されました。
-
参考文献
O.J. Güntert, A. Faessler, Z. Krist., 107, 357 (1956), DOI: 10.1524/zkri.1956.107.5-6.357.