-
外観
白色〜ほとんど白色, 粉末又は塊
-
性質
炭酸セシウムは、炭酸カリウムやなど、他のアルカリ金属の炭酸塩に比べて有機溶媒への溶解度が高いことが特徴です。これは、原子としてのセシウムの性質に由来します。セシウムは原子半径が大きく、他のアルカリ金属と比べて非常に陽イオン化しやすいという特性を持っています。
炭酸塩となっても電荷密度が低いため、容易に陰イオンと解離して有機溶媒へ溶けることが可能です。この性質を利用して、他のアルカリ金属の炭酸塩では反応が進行しにくい有機溶媒中での合成反応にしばしば用いられます。一方、やp-キシレン、などの低極性溶媒には、他のアルカリ金属同様に極めて不溶です。
炭酸ナトリウムのような他の炭酸塩化合物と同様の反応に利用できますが、試薬としては価格が高めであるため、他の塩基で代替可能な加水分解反応などに利用されることは稀です。
-
溶解性
水に易溶 (260.7g/100g, 20℃)。エタノールに可溶 (11.1g/100g, 19℃)。
-
解説
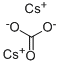
炭酸セシウムとは、組成式Cs2CO3 (分子量325.82) で表されるの炭酸塩です。
白色の粉末または塊上の結晶性固体化合物で、水、アルコール、DMFなどの極性溶媒に高い溶解性を示します。潮解性があり、空気中では湿気を吸って溶解してしまうため、取り扱いには注意が必要です。
有機合成における強力な無機塩基や触媒として使用され、位置・立体選択的なカップリング反応に用いられます。分解温度は600℃で、高温での加熱によって不揮発性の分解生成物を生じます。
この生成物は導電性の蒸着材料として用いられ、太陽電池などの電力変換効率を高める用途で使用されます。また、炭酸セシウムは、消防法はじめ毒劇法、労働安全衛生法、危険物の規制に関する規則 (危規則) 、航空法、PRTR法といった、おもな国内法規による指定はされていません。
-
用途
セシウム塩の各種原材料の製造、特殊光学ガラス、石油系触媒添加剤、特殊セラミックス、硫酸工業、分析用試薬の製造。
-
構造
炭酸セシウムの構造は、第一属のアルカリ金属であるセシウムと、炭酸イオンからなる塩です。無水物のほか、水分子が3つ配位した3水和物が存在します。
セシウム元素は周期表の第6周期にあり、原子半径が非常に大きいため、第一イオン化エネルギーは全元素の中で最も低くなっています。電荷密度も低いため、溶液中では容易にイオンとして解離します。
金属セシウムは非常に反応性が高く、空気中で自然発火するほか、水と爆発的に反応するため、消防法で危険物に指定されています。一方、炭酸セシウムは消防法による規制はありません。
-
使用上の注意
潮解性あり
-
説明
Cesium carbonate is a basic carbonate and is used in organic synthesis as a mild inorganic base. It can be used in C, N, O alkylation and arylation reactions. Cesium carbonate not only promotes the carbonylation of alcohols and carbamination of amines but also inhibits side reactions common in other processes. It is also used in six-membered annulation, intramolecular and intermolecular cyclizations, Suzuki coupling, aza-Henry, nucleophilic substitution, cross-coupling and different cycloaddition reactions.
-
化学的特性
Colourless crystals or white powder , easily soluble in water, quickly absorbs moisture when placed in the air. The aqueous solution of cesium carbonate is strongly alkaline and can react with acid to produce the corresponding cesium salt and water, and release carbon dioxide.
-
使用
Cesium carbonate is a versatile reagent for organic synthesis. This inorganic base has been employed in numerous organic applications ranging from N-protection of amino acids to a base in either the Horner- Wadsworth-Emmons reaction or in Suzuki couplings. It has also found use as a catalyst for ethylene oxide polymerization, in coating for spatter-free welding of steel in CO2, as a functional interlayer in photovoltaic devices and in oxide cathodes. Cesium carbonate is also used in the beer-brewing industry to make the "head" of beer foamier.
-
主な応用
Cesium carbonate is widely utilized as a precursor for other cesium compounds. It acts as a base in sensitive organic reactions. It can be used as a base in C-C and C-N cross-coupling reactions such as Suzuki?Miyaura, Heck, and Buchwald-Hartwig amination reactions. It finds use in solar cells as it increases the power conversion efficiency of cells through the transfer of electrons. It is also used in the production of special optical glasses, petroleum catalytic additives, special ceramics and in the sulfuric acid industry. It is useful in the N-alkylation (of sulfonamides, beta-lactams, indoles, heterocycles and several sensitive nitrogen compounds), carbamination of amines, carbonylation of alcohols and aerobic oxidation of alcohols into carbonyl compounds without polymeric by products. Promotes the efficient O-alkylation of alcohols to form mixed alkyl carbonates.
-
製造方法
cesium carbonate can be prepared by thermal decomposition of caesium oxalate. Upon heating, caesium oxalate is converted to caesium carbonate with emission of carbon monoxide.
Cs2C2O4 → Cs2CO3 + CO
It can also be synthesized by reacting caesium hydroxide with carbon dioxide.
2 CsOH + CO2 → Cs2CO3 + H2O
-
反応性
Many of the properties of cesium carbonate are due to the softness of the cesium cation. This softness makes cesium carbonate rather soluble in organic solvents such as alcohols, DMF and Et2O. This has rendered cesium carbonate useful in palladium chemistry, which is often carried out in non-aqueous media where insolubility of inorganic bases can limit reactivity. Cs2CO3 has, for example, been used with good results in Heck, Suzuki and Sonogashira reactions. Cesium carbonate has also received much attention for its use in O-alkylations, particularly of phenols.It has been postulated that O-alkylations of phenols using Cs2CO3 in non-aqueous solvents occurs via the ‘naked’ phenolate anion, which behaves as a strong nucleophile. Therefore, this methodology can even be applied to secondary halides, minimizing the usual unwanted side reactions such as elimination and decomposition.
-
一般的な説明
Cesium carbonate is a powerful inorganic base widely used in organic synthesis. It is a potential chemoselective catalyst for the reduction of aldehydes and ketones to alcohols. It is employed as base for the Heck coupling reaction of 4-trifluoromethyl-1-chlorobenzene and aryl chlorides.
-
危険性
Cesium carbonate is a danger compound.
H315: Causes skin irritation
H318: Causes serious eye damage
H335: May cause respiratory irritation
H361: Suspected of damaging fertility or the unborn child
H373: May cause damage to organs through prolonged or repeated exposure
-
使用用途
炭酸セシウムは、主に有機合成における無機塩基や触媒として使われます。特に、Heck反応、Sonogashira反応などのカルボニル化、カルバモイル化を伴うカップリング反応を行う場合、他の塩基よりも効率的に反応を進行させることが知られています。炭酸セシウムは繊細な合成に適したバランスのいい強塩基です。
また、近年注目されている用途として、有機電子材料の陰極としての利用があります。分解温度に達した炭酸セシウムは、Cs2OとCs2O2に分解されます。これら2種類の分子が結合するとn型ドープが生成され、N型半導体に負の電荷を持つ自由電子が供給されます。/p>
これによって、炭酸セシウムはデバイスの電力変換効率を増加させることができるため、有機電子材料の陰極としての利用が期待されている状況です。
-
安全性プロファイル
Moderately toxic by
ingestion. Mutation data reported. When
heated to decomposition it emits acrid
smoke and fumes. See also CESIUM.
-
製造方法
炭酸セシウムの製造方法
炭酸セシウムは、シュウ酸セシウムの加熱反応により得られます。シュウ酸セシウムを空気中で加熱すると、を発生しながら炭酸セシウムが生成します。
Cs2C2O4 → Cs2CO3 + CO
また、水酸化セシウムとを反応させることでも合成が可能です。水酸化セシウムは二酸化炭素との反応性が高いため、水溶液に二酸化炭素ガスを通すだけで容易に炭酸セシウムを得ることができます。反応後は、水溶液を蒸発乾固して固体を得ます。
2CsOH + CO2 → Cs2CO3 + H2O
参考文献
-
純化方法
Crystallise it from ethanol (10mL/g) by partial evaporation. [D.nges in Handbook of Preparative Inorganic Chemistry (Ed. Brauer) Academic Press Vol I p 988 1963.]