ChemicalBook CAS数据库列表 盐酸乌拉地尔
盐酸乌拉地尔
- CAS号:64887-14-5
- 英文名:Urapidil hydrochloride
- 中文名:盐酸乌拉地尔
- CBNumber:CB6332466
- 分子式:C20H30ClN5O3
- 分子量:423.94
- MOL File:64887-14-5.mol
盐酸乌拉地尔化学性质
- 熔点 :156-1580C
- 储存条件 :Keep in dark place,Inert atmosphere,Room temperature
- 溶解度 :H2O: soluble
- 形态 :solid
- 颜色 :white
- 水溶解性 :Soluble to 50 mM in water
- InChI :InChI=1S/C20H29N5O3.ClH/c1-22-18(15-19(26)23(2)20(22)27)21-9-6-10-24-11-13-25(14-12-24)16-7-4-5-8-17(16)28-3;/h4-5,7-8,15,21H,6,9-14H2,1-3H3;1H
- InChIKey :KTMLZVUAXJERAT-UHFFFAOYSA-N
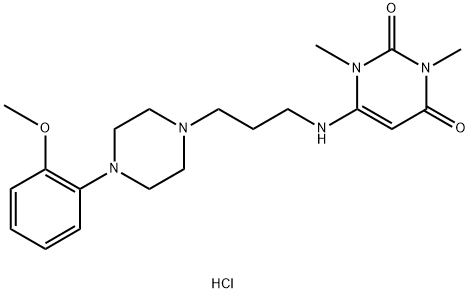
- SMILES :O(C1C=CC=CC=1N1CCN(CCCNC2=CC(=O)N(C)C(=O)N2C)CC1)C.Cl
安全信息
- 危险品标志 :Xn
- 危险类别码 :22-36/37/38
- 安全说明 :26-36
- WGK Germany :3
- RTECS号 :YQ9862000
盐酸乌拉地尔 化学药品说明书
盐酸乌拉地尔注射液
盐酸乌拉地尔性质、用途与生产工艺
- 高血压药物 盐酸乌拉地尔是一种选择性α受体阻滞剂,其降压作用具有中枢和外周双重机制,但主要以外周双重机制为主。在外周,它可阻断突触后α1受体、抑制儿茶酚胺的缩血管作用,从而降低外周血管阻力和心脏负荷;在中枢,通过兴奋5-羟色胺-1A受体,调节循环中枢的活性,防止因交感反射引起的血压升高及心率加快。双机制作用降压迅速,双通道代谢使用安全。目前,乌拉地尔已经得到国内外权威指南的一致推荐,是治疗高血压急症的一线治疗药物。2018年欧洲心脏病学会ESC发布的《妊娠期心血管疾病诊疗指南》、2017年中国医师协会急诊医师分会《中国急诊高血压诊疗专家共识》等,推荐乌拉地尔用于治疗急性主动脉夹层、急性脑缺血性卒中、急性脑出血、蛛网膜下腔出血、高血压脑病、急性心力衰竭、围术期高血压、嗜铬细胞瘤、急诊应激高血压、儿童高血压急症。
- 适应症 盐酸乌拉地尔适应各种类型高血压、高血压危象、重度和极重度高血压、难治性高血压,以及控制围手术期高血压,包括伴有肝、肾功能不全、冠心病、糖尿病等高血压患者及由于慢性阻塞性肺病引起的肺动脉高压。对前列腺肥大也有一定作用。
- 用法用量 注射剂:5ml:25mg;10ml:50mg。片剂:30mg:60mg。缓释片剂:30mg。 口服:每日30~180mg,分2次服,一般初始剂量每次30mg,每日2次,以后视病情适当调整。静脉注射:将本品12.5~25mg加入10ml氯化钠注射液或葡萄糖注射液中,静脉注射,观察血压变化,5~10分钟后如必要可重复注射12.5~25mg。静脉滴注:为了维持疗效或缓慢降压,可将本品25mg加于氯化钠注射液或葡萄糖注射液中静脉滴注,滴速一般为100~400μg/min。充血性心力衰竭、血压显著增高者,先用本品12.5~25mg加于10ml氯化钠注射液或葡萄糖注射液中静脉推注。一般情况可直接静脉点滴,滴速为100~400μg/min,据病情调整剂量和滴速。可每日1次或24小时连续使用,疗程一般3~6天,视病情也可长于6天。
-
不良反应
1.使用乌拉地尔后,个别病例可能出现头痛、头晕、恶心、呕吐、出汗、烦燥、乏力、心悸、心律失常、上脸部压迫感或呼吸困难等症状,其原因多为血压降得太快所致,通常在数分钟内即可消失,病人无需停药。血压过度降低,可抬高下肢,补充血容量即可改善。
2.过敏反应少见(如搔痒,皮肤发红,皮疹等)。
3.极个别病例在口服本药时出现血小板计数减少,但血清免疫学研究尚未证实其因果关系。 -
注意事项
1)伴有主动脉峡部狭窄或动、静脉分流的患者(透析分流除外)禁用注射剂。对血管扩张剂有禁忌证者、孕妇及哺乳期妇女禁用。
2)可见头痛、头晕、乏力、心悸、胃肠反应、过敏反应、直立性低血压和血压过度下降。
3)不可与碱性药物混合,因其酸性性质可能引起溶液浑浊或形成絮状物。
4)不提倡与血管紧张素转换酶合用。 -
参比制剂
1983年6月Takeda的盐酸乌拉地尔注射液在奥地利获批上市,商品名:Ebrantil,规格5ml:27.35mg盐酸乌拉地尔(相当于25mg乌拉地尔)、10ml:54.7mg盐酸乌拉地尔(相当于50mg乌拉地尔)。随后TAKEDA的乌拉地尔注射液相继在欧盟多个国家(德国、瑞士、波兰、法国、西班牙等)获批上市。
2012年CFDA批准原研Takeda的盐酸乌拉地尔注射液上市,规格:5ml:25mg,产地为奥地利。
仿制药参比制剂目录第二十三批公示稿中公布了乌拉地尔注射液参比为欧盟上市及原研进口Takeda GmbH的Ebrantil(5ml:25mg、10ml:50mg)。 - 生物活性 Urapidil HCl是Urapidil的盐酸盐形式,是α1-肾上腺素能受体拮抗剂和5-HT1A受体激动剂,pIC50分别为6.13和6.4。
-
靶点
Target Value 5-HT1A - 用途 用于治疗各种类型高血压、高血压
盐酸乌拉地尔上下游产品信息
上游原料
下游产品
盐酸乌拉地尔 试剂级价格
- 更新日期:2025/02/08
- 产品编号:HY-B0354A
- 产品名称:盐酸乌拉地尔 Urapidil hydrochloride
- CAS编号:64887-14-5
- 包装:25mg
- 价格:221元
- 更新日期:2025/02/08
- 产品编号:HY-B0354A
- 产品名称:盐酸乌拉地尔 Urapidil hydrochloride
- CAS编号:64887-14-5
- 包装:10 mM * 1 mLin DMSO
- 价格:243元
盐酸乌拉地尔生产厂家
- 公司名称:Service Chemical Inc.
- 联系电话:--
- 电子邮件:sales@chemos-group.com
- 国家:德国
- 产品数:6350
- 优势度:71
- 公司名称:BIOTREND Chemicals AG
- 联系电话:--
- 电子邮件:info@biotrend.ch
- 国家:德国
- 产品数:1250
- 优势度:62
64887-14-5, 盐酸乌拉地尔相关搜索: