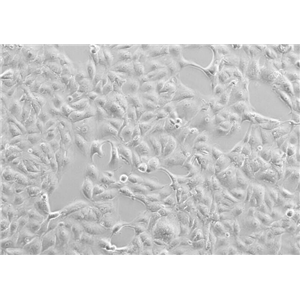
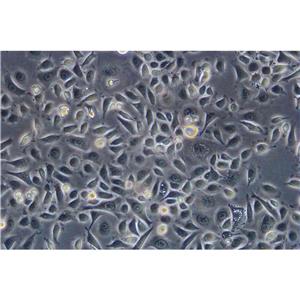
"DLD-1人结直肠腺癌上皮复苏细胞保种中心|带STR证书
传代比例:1:2-1:4(首次传代建议1:2)
生长特性:贴壁生长
细胞复苏后贴壁细胞较少的问题分析:总结1:复苏过程没有问题,是否是从拿出直接放入温水,还有培养箱,二氧化碳浓度,培养基、PH值等环节。要么加GAO浓度FBS 15-20%,看看能否帮助贴壁,当然也需要考虑血清问题,还有确信拿来的细胞没问题。总结2:首先应该怀疑冻存,实际上复苏出问题的可能非常小,因为操作简单,而且死板。1、你冻存的时候是不是消化的时间过长,这是一般人所注意不到的,即使书上也不讲这个问题,太长的消化时间会让细胞复苏时失去贴壁能力,表现为先贴后死,原因是在你复苏的时候细胞已进入凋亡程序,不可逆转的死亡。2、你的冻存HAO不HAO,是什么,甘油还是DMSO,质量非常重要,否则也会死亡。3、你的冻存的量加的是不是太多,AC推荐是不超过7%,大于5%,太多也不HAO。4、你在冻存的时候是不是把DMSO混均匀,这个有一些影响,但不算太大。5、你的冻存是否按部就班,就是所温度梯度是不是把握严格,很多人容易忘却这个事情,因为这个东西流程长。6、如果你细胞污染,你是否能很快看到,我比我的导师能早一天看到污染。从这个角度讲建议去除离心这步。7、你的细胞在冻存前是否过密。还有,不赞成孵箱污染这个概念的,所有在一个孵箱里的细胞都污染一个细菌的话,这个细菌是源于孵箱的,但这不代表孵箱污染,因为孵箱无论你如何处理都有大量的细菌,问题在操作。每次污染的原因都要尽可能的找,以后就不犯同样的问题,这个很重要,不能靠猜,否则你就有可能细胞养绝Zui后换课题,这个见得太多了,别不当会事。
换液周期:每周2-3次
CL MC/9 Cells;背景说明:肥大细胞;C57BL/6 x A/J;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:HFL 1细胞、Walker256-TC细胞、NOR-10细胞
HPB/ALL Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:SP-2/0-AG14细胞、H-1299细胞、HGBEC细胞
Neukoplast Cells;背景说明:NK细胞;淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:HKF细胞、Laboratory of Allergic Diseases 2细胞、TOV21G细胞
DLD-1人结直肠腺癌上皮复苏细胞保种中心|带STR证书
背景信息:DLD-1是1977-1979年间D.L.Dexter和同事分离的两株结直肠腺癌细胞株中的一株。在AC和其它地方进行的DNAfingerprinting和染色体组型分析表明这株细胞与HCT-15(CCL-225)相似,说明这两者是来自同一个人的不同克隆。他们的遗传起源可通过DNAfingerprinting证实,但染色体组型分析显示它们缺乏染色体标记一致改变或数目上一致改变。细胞的C阴性(C-)。DLD-1细胞的p53抗原表达呈阳性(p53抗原产生了一个C->
细胞系的选择需要考虑到细胞系的功能特点、生长速率、铺板效率、生长条件和生长特征、克隆效率、培养方式等因素,如果您想高产量表达重组蛋白,您可以选择可以悬浮生长的快速生长细胞系。细胞培养的操作步骤主要包括传代、换液、冻存和复苏。这些步骤确保了细胞能够在实验室环境中长期存活并继续增殖。传代是将细胞从一个容器转移到另一个容器的过程,以扩大细胞数量;换液是为了清除代谢废物并补充新鲜培养基;冻存则是为了长期保存细胞,而复苏则是重新激活冷冻保存的细胞使其恢复正常生长。
产品包装:复苏发货:T25培养瓶(一瓶)或冻存发货:1ml冻存管(两支)
来源说明:细胞主要来源ATCC、ECACC、DSMZ、RIKEN等细胞库
X63-Ag8 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:H187细胞、SW 1783细胞、H1930细胞
Hs 604.T Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:H2073细胞、L(TK-)细胞、U266-B1细胞
Mel624 Cells;背景说明:黑色素瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NCIH847细胞、CAL 148细胞、SK Mel 24细胞
LU165 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:WIL2-S细胞、hMSC-BM细胞、HCT 116细胞
DLD-1人结直肠腺癌上皮复苏细胞保种中心|带STR证书
物种来源:人源、鼠源等其它物种来源
形态特性:上皮细胞样
很多朋友讨论细胞培养问题,见到很多很HAO的经验总结,这里说一些我个人的经验,因为一些比较殊的原因,我自己培养接触过近300种细胞,常用于做实验的,累积有百余种,可以说遇到过许多各式各样古怪的细胞。这里挑细胞消化开始做我的第一篇专题,并不是因为细胞消化Zui重要,而是近期看到大家频繁讨论这个话题,我就抛砖引玉,下面几点拙见,可能与其它朋友总结的一些经验有点出入,仅供大家参考。许多同学对细胞消化做了许多研究,得出了很多有价值的经验,也见到很多人的困惑。其实细胞培养,尤其是细胞系的培养,就消化而言,不是太难,做得多了,善于总结经验,就能把细胞越养越HAO。一般的程序步骤,细节操作,我这里就不讲了,只讲一些基本操作背后的知识,如果不对之处,欢迎指正,总结下来,细胞培养中消化很重要,但其实消化并不是细胞培养的关键所在(虽然很重要),关键所在是细胞来源,血清质量和水源(自己配制溶的话)。我看到版上许多人养细胞遇到各种各样的问题,很多时候boleneck没有找到,虽然通过其它方法有所改善,但仍然是事倍功半。因为人们往往注意自己的操作,总觉得自己没有经验,而忽视试剂,溶尤其是细胞的质量,后者其实才是许多细胞培养实验室常见的问题。
RSC-364 Cells;背景说明:滑膜 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NCI-H-128细胞、KMBC细胞、MES-SA细胞
HGC-27 Cells;背景说明:未分化胃癌,能分泌粘液素。;传代方法:消化3-5分钟,1:2,3天内可长满;生长特性:贴壁生长;形态特性:上皮样;相关产品有:FLS细胞、H510细胞、Roswell Park Memorial Institute 7951细胞
P30-OHKUBO Cells;背景说明:详见相关文献介绍;传代方法:10^5 cells/60mm dish;生长特性:悬浮生长;形态特性:淋巴母细胞;相关产品有:BALB/3T3 (clone A31)细胞、SW13细胞、Renal Carcinoma细胞
NT2 Cells;背景说明:畸胎瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:T1-73细胞、C 643细胞、NFHIOSE-80细胞
OVCAR3 Cells;背景说明:该细胞1982年由T.C. Hamilton等建系,源自一位60卵巢腺癌的腹水,是卵巢癌抗药性研究的模型。;传代方法:1:2—1:4传代,每周换液2—3次;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:BLO-11细胞、SNB.19细胞、NCI-H711细胞
LC-1 sq Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:CEM/C1细胞、NCI-H1618细胞、Bac1 2F5细胞
H-1238 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:ARH77细胞、Anip[973]细胞、THLE-3细胞
VMRC-LCD Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:M059K细胞、NBL-S细胞、NCI-H1522细胞
DHL6 Cells;背景说明:详见相关文献介绍;传代方法:1:3—1:6传代,3—4天换液1次;生长特性:悬浮生长 ;形态特性:淋巴母细胞样;相关产品有:KASUMI6细胞、C22细胞、LM(TK-)细胞
BT325 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:QGY细胞、J82细胞、HuH7细胞
KNS-42 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:多边形;相关产品有:P-388D1细胞、mRMEC细胞、T47-D细胞
NCTC clone 1469 Cells;背景说明:1952年建系,源于正常C3H/An小鼠的肝脏组织,表达H-2K抗原,鼠痘病毒阴性。;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:淋巴母细胞;相关产品有:Hs 729T细胞、Centre Antoine Lacassagne-27细胞、WM 239细胞
M2-10B4 Cells;背景说明:骨髓;纤维原细胞;C57BL/6J X C3H/HeJ;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:CMT 64细胞、IOSE-Van细胞、H522细胞
NOZC-1 Cells;背景说明:患者有癌性腹膜炎。细胞为中等分化的管状胆囊癌。会分泌AFP和CEA。倍增时间48小时,板植率14-19%。细胞可在裸鼠中成瘤,形态与原发肿瘤相似。;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:上皮细胞样;相关产品有:F442A细胞、MFE-280细胞、Hs 636.T细胞
LM2-4175 Cells;背景说明:乳腺癌;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Spodoptera frugiperda clone 9细胞、MHCC97细胞、T-98G细胞
253JBV Cells;背景说明:膀胱癌;淋巴结转移;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:BT549细胞、Hs 578.T细胞、BJ [Human fibroblast]细胞
HCT-15 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:HEK293E细胞、J-82细胞、U373 MG细胞
DLD-1人结直肠腺癌上皮复苏细胞保种中心|带STR证书
Abcam HCT 116 XIAP KO Cells(提供STR鉴定图谱)
AG08578 Cells(提供STR鉴定图谱)
BayGenomics ES cell line KST030 Cells(提供STR鉴定图谱)
BayGenomics ES cell line XB708 Cells(提供STR鉴定图谱)
BP13(R100) Cells(提供STR鉴定图谱)
CO3 Cells(提供STR鉴定图谱)
DA03797 Cells(提供STR鉴定图谱)
Eph4 A6 Cells(提供STR鉴定图谱)
GM06111 Cells(提供STR鉴定图谱)
Bac1 2F5 Cells;背景说明:巨噬细胞;SV40转化;BALB/c x A.CA;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:X63Ag8.653细胞、PanC1细胞、Hu-P-T4细胞
T 98 G Cells;背景说明:详见相关文献介绍;传代方法:按1:3传代;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:FHs74Int细胞、MLA144细胞、MPC-83细胞
MES13 Cells;背景说明:肾小球系膜;SV40转化;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:FTC-133细胞、COLO201细胞、A-2780细胞
MMAc-SF Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:HEB细胞、Kit-225-K6细胞、MB157细胞
BT-20 Cells;背景说明:该细胞1958年由E.Y. Lasfargues 和 L. Ozzello 建系,源自一位74岁白人女性的乳腺癌组织。该细胞表达WNT3和WNT78。TNF alpha抑制该细胞生长。该细胞雌激素受体阴性,但表达5'外显子缺失的雌激素mRNA。;传代方法:1:2—1:4传代,2—3天换液一次;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:Ramos (RA 1)细胞、H-1694细胞、MC-4细胞
NCIH187 Cells;背景说明:经典小细胞肺癌;胸腔积液转移;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:J774.A1细胞、CMT.64细胞、HMEC1细胞
AD-2 Cells(提供STR鉴定图谱)
SNU-C2B Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:MDA-MB-435细胞、H-82细胞、HuLEC-5a细胞
Lu99A Cells;背景说明:详见相关文献介绍;传代方法:1:10传代;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:B16-F1细胞、Renal Carcinoma细胞、MBT2细胞
Ly8 Cells;背景说明:弥漫大B淋巴瘤;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:Vx-2细胞、LU451细胞、CWR22-Rv1细胞
MDA-MB-361 Cells;背景说明:该细胞源自40岁女性乳腺癌的脑转移组织。;传代方法: 1:2—1:6传代,每周换液2—3次;生长特性:松散贴壁生长;形态特性:上皮细胞样;相关产品有:LICR-LON-HN6细胞、FU-MMT-1细胞、Walker256-TC细胞
KU-812F Cells;背景说明:慢性粒细胞白血病;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:E304细胞、LAN-6细胞、BpRc1细胞
NIH:OVCAR-3 Cells;背景说明:该细胞1982年由T.C. Hamilton等建系,源自一位60卵巢腺癌的腹水,是卵巢癌抗药性研究的模型。;传代方法:1:2—1:4传代,每周换液2—3次;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:Super Tube细胞、HDLM-2细胞、IMR32细胞
AQ-Mel Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:4传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:星形的;相关产品有:SUM149PT细胞、NCI522细胞、Jurkat E6.1细胞
UCLA-SO-M14 Cells;背景说明:详见相关文献介绍;传代方法:1:3传代;生长特性:混合生长;形态特性:详见产品说明书;相关产品有:C22细胞、NCIH1563细胞、MLE 12细胞
GM25857 Cells(提供STR鉴定图谱)
HAP1 NSUN3 (-) 3 Cells(提供STR鉴定图谱)
HBL-100 Cells;背景说明:该细胞由E.V.Gaffney及其同事从一位没有乳癌家族史的供者乳汁中建立,培养出来的细胞染色体组型在第7代时就不正常;电镜照片显示有微丝、张力原纤维和桥粒;Southern转移表明有整合型SV40病毒基因,当作正常细胞。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:NS-I/1细胞、SKMel-28细胞、Hs27细胞
MILE SVEN 1 Cells;背景说明:MS1是1994年建株的胰岛内皮细胞株。原代培养的胰岛内皮细胞用抗G418的温度敏感型SV40大T抗原(tsA-58-3)转染。抗性克隆用克隆环分离,并筛选吸收dil-Ac-LDL的。这株细胞保留了内皮细胞的许多特性,如吸收乙酰化LDL和表达八因子相关抗原及BEGF受体。;传代方法:消化3-5分钟。1:2。3天内可长满。;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:AN3 CA细胞、Ha Fe细胞、GM04154细胞
H211 Cells;背景说明:详见相关文献介绍;传代方法:3-4天换液1次。;生长特性:悬浮生长;形态特性:详见产品说明书;相关产品有:UCLA-SO-M21细胞、HCa/16A3-F细胞、HGE细胞
NCIH520 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:6传代;2-3天换液1次;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:SUDHL-16细胞、A 172细胞、DC2.4细胞
NCIH2052 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:6传代;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:G361mel细胞、A10细胞、Radiation Effects Research Foundation-Lung Cancer-MS细胞
hTERT-RPE1 Cells;背景说明:视网膜色素上皮;hTERT永生;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Hs821T细胞、STTG1细胞、DR2R 1610细胞
PC-14 Cells;背景说明:肺腺癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SW 982细胞、DV90细胞、C33A细胞
H920 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:HG2855细胞、SPCA-1细胞、MA-c细胞
Hs 413.We Cells(提供STR鉴定图谱)
KMITL-PX-E1 Cells(提供STR鉴定图谱)
MLC-1-B Cells(提供STR鉴定图谱)
NSG-70-WNT5A-GFP Cells(提供STR鉴定图谱)
REF-WT10A Cells(提供STR鉴定图谱)
U2OS TRH1 HiTSeeker Cells(提供STR鉴定图谱)
UMGi014-B.3 Cells(提供STR鉴定图谱)
HC50562 Cells(提供STR鉴定图谱)
LS-174T Cells;背景说明:LS 174T是LS 180 (ATCC CL 187)结肠腺癌细胞株的胰蛋白酶化变种。 它比亲本更易传代,象LS 180一样生成大量的癌胚抗原(CEA)。 电镜研究表明有丰富的微丝和细胞质粘液素液泡。 直肠抗原3阳性。 p53抗原表达阴性,但mRNA表达阳性。 与ATCC CL-187来源于同一个肿瘤。LS 174T细胞角蛋白染色阳性。 癌基因c-myc, N-myc, H-ras, N-ras, Myb, 和 fos的表达呈阳性。 癌基因k-ras和sis的表达未做检测。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:H4-II-EC3细胞、NCIH1869细胞、SKCol1细胞
Hs840_T Cells;背景说明:详见相关文献介绍;传代方法:1:4—1:8传代,每周换液2—3次;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:LIXC002细胞、578T细胞、EoL-1 cell细胞
Hep 3B2.1-7 Cells;背景说明:肝癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:MDAMB134细胞、LAPC4细胞、BT-325细胞
Dunn LM8 Cells;背景说明:Dunn's骨肉瘤;雌性;C3H;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:343MG细胞、Fortner's melanotic melanoma #3细胞、BMSCs(mBMSCs)细胞
NUGC3 Cells;背景说明:详见相关文献介绍;传代方法:1:6传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:VMRC-RCZ细胞、SU-DHL6细胞、16-HBEo细胞
NUGC3 Cells;背景说明:详见相关文献介绍;传代方法:1:6传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:VMRC-RCZ细胞、SU-DHL6细胞、16-HBEo细胞
CPA 47 Cells;背景说明:肺血管;内皮 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:HCC1954-BL细胞、CEM T4细胞、FHL-124细胞
NCI H747 Cells;背景说明:详见相关文献介绍;传代方法:1:2—1:4传代,每周换液2次;生长特性:贴壁生长;形态特性:上皮样;相关产品有:NKL细胞、HeLa-S3细胞、Colon 26细胞
HARAB Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:EA. hy 926细胞、Jurkat FHCRC细胞、FUOV1细胞
DMS 53 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代,每周2-3次;生长特性:贴壁生长;形态特性:上皮样;相关产品有:CCRF-CEM C7细胞、VB细胞、Eca 109细胞
NWA Cells;背景说明:这株细胞有EB病毒基因组。;传代方法:1:2传代。3天内可长满。;生长特性:悬浮生长 ;形态特性:淋巴母细胞样;相关产品有:NCI H2106细胞、OCI AML3细胞、Natural Killer-92细胞
OCI AML4 Cells;背景说明:急性髓系白血病;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:CCRF细胞、H-1770细胞、T-HEECs细胞
EU-2 Cells;背景说明:儿童急性髓系白血病;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:TE-11细胞、Roswell Park Memorial Institute 7951细胞、NCI-H1404细胞
SW480E Cells;背景说明:SW480源自一位51岁白人男性患者的原位直肠腺癌,而SW620源自同一病人一年后的淋巴结转移灶。该细胞CSAp和直肠抗原3阴性;角蛋白阳性;p53基因第273位密码子的G→A突变引起Arg→His替代,309位密码子的C→T突变导致Pro→Ser替代;细胞p53蛋白表达水平升高;癌基因c-myc、K-ras、H-ras、N-ras、myb、sis和fos的表达呈阳性;未检测到癌基因N-myc的表达;不表达Matrilysin(一种与肿瘤侵袭相关的金属蛋白酶)。;传代方法:1:2传代,1-2天换液一次;生长特性:贴壁生长;形态特性:上皮样;相关产品有:MDA-361细胞、NCI-H650细胞、SU-DH-L5细胞
A2058 Cells;背景说明:详见相关文献介绍;传代方法:1:6-1:12传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:SW-480细胞、AMC-HN8细胞、A7r5细胞
STBCi093-B Cells(提供STR鉴定图谱)
NF639 Cells;背景说明:乳腺癌;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:MKN74细胞、MDAPCa-2b细胞、SJRH 30细胞
CCD841CoN Cells;背景说明:结肠上皮细胞;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Molm 14细胞、Hep2细胞、Hs742T细胞
X63-AG 8.653 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:LAN-5细胞、OVCAR433细胞、H-157细胞
RPMI-8402 Cells;背景说明:急性T淋巴细胞白血病;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:SuperTube细胞、ABE8.1/2细胞、HDMEC细胞
CAKI.1 Cells;背景说明:该细胞超微结构中包含许多微绒毛、少许微丝、许多小线粒体、发达的高尔基休和内质网、许多脂滴和多层体、次级溶酶体,没有发现病毒颗粒。;传代方法:1:2-1:4传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:SK-ChA1细胞、NKM1细胞、HGMC细胞
U-118MG Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:PK-15细胞、293EBNA细胞、HPDEC细胞
NCIH322 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:SW-1116细胞、H-865细胞、Henrietta Lacks cells细胞
Adeno-293 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:VMRC-LCD细胞、TSCC1细胞、8402细胞
HuH7 Cells;背景说明:详见相关文献介绍;传代方法:消化3-5分钟。1:2。3天内可长满。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:CAL-120细胞、MeT 5A细胞、M 1细胞
KYSE-270 Cells;背景说明:详见相关文献介绍;传代方法:1:5传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:MCA 38细胞、BALB/3T3 (clone A31)细胞、H1395细胞
NCI-H838 Cells;背景说明:该细胞于1984年建系,源于一位59岁患有非小细胞肺癌的白人男性吸烟者,从患者淋巴结转移灶分离而来。;传代方法:1:3-1:6传代;2-3天换液1次。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:hTERT-RPE-1细胞、SNU216细胞、130 T细胞
FTC133 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:HCC1395细胞、Capan2细胞、MC3T3E1细胞
TOG Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:神经元细胞;相关产品有:Nb2a细胞、4T1.2细胞、KMS11细胞
RWPE1 Cells;背景说明:肿瘤抑制基因: p53 + [PubMed: 9214605] pRB + [PubMed: 9214605] 一位正常男性前列腺组织切片的周围区域的上皮细胞用单拷贝的人乳头瘤病毒的18(HPV-18)进行转化,建立了RWPE-1 (ATCC CRL-11609) 细胞株 [PubMed: 9214605]. 在三维Matrigel培养时,在雄激素作用下,RWPE-1细胞形成腺胞并向培养基中分泌PSA。[PubMed: 11170142]. 当与Matrigel或基质细胞混合注射雄性裸鼠时,RWPE-1细胞也能形成腺胞[PubMed: 11304724] 并产生PSA。 来源于RWPE-1的细胞再用Kirstin鼠类肿瘤病毒转染Ki-ras基因,建立了能成瘤的RWPE-2细胞株(ATCC CRL-11610) [PubMed: 9214605] 和 RWPE2-W99 (ATCC CRL-2853) 细胞株。 另外,用N--N-(MNU)处理RWPE-1,建立了一系列模拟前列腺癌进程中不同时期的成瘤细胞株。 它们是 WPE1-NA22 (ATCC CRL-2849), WPE1-NB14 (ATCC CRL-2850, WPE1-NB11 (ATCC CRL-2851) 和 WPE1-NB26 (ATCC CRL-2852) 细胞株。 据提供者报道,RWPE-1 细胞株(ATCC CRL-11609)经过检测,乙肝、丙肝、人免疫缺陷病毒都呈阴性。;传代方法:1:3传代,2-3天传一代。;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:C2-C12细胞、NCIH2172细胞、CAL 51细胞
DLD-1人结直肠腺癌上皮复苏细胞保种中心|带STR证书
BayGenomics ES cell line RRN167 Cells(提供STR鉴定图谱)
BayGenomics ES cell line YHA213 Cells(提供STR鉴定图谱)
H220-11 Cells(提供STR鉴定图谱)
P4H9 Cells(提供STR鉴定图谱)
Ad2-3Y1-3 Cells(提供STR鉴定图谱)
HOCE Cells(提供STR鉴定图谱)
" "PubMed=3335022
Alley M.C., Scudiero D.A., Monks A., Hursey M.L., Czerwinski M.J., Fine D.L., Abbott B.J., Mayo J.G., Shoemaker R.H., Boyd M.R.
Feasibility of drug screening with panels of human tumor cell lines using a microculture tetrazolium assay.
Cancer Res. 48:589-601(1988)
PubMed=2041050; DOI=10.1093/jnci/83.11.757
Monks A., Scudiero D.A., Skehan P., Shoemaker R.H., Paull K.D., Vistica D.T., Hose C.D., Langley J., Cronise P., Vaigro-Wolff A., Gray-Goodrich M., Campbell H., Mayo J.G., Boyd M.R.
Feasibility of a high-flux anticancer drug screen using a diverse panel of cultured human tumor cell lines.
J. Natl. Cancer Inst. 83:757-766(1991)
PubMed=8422623; DOI=10.1002/1097-0142(19930115)71:2<315::aid-cncr2820710208>3.0.CO;2-B
Tibbetts L.M., Doremus C.M., Tzanakakis G.N., Vezeridis M.P.
Liver metastases with 10 human colon carcinoma cell lines in nude mice and association with carcinoembryonic antigen production.
Cancer 71:315-321(1993)
PubMed=8464898; DOI=10.1073/pnas.90.7.2842; PMCID=PMC46192
Browning M.J., Krausa P., Rowan A.J., Bicknell D.C., Bodmer J.G., Bodmer W.F.
Tissue typing the HLA-A locus from genomic DNA by sequence-specific PCR: comparison of HLA genotype and surface expression on colorectal tumor cell lines.
Proc. Natl. Acad. Sci. U.S.A. 90:2842-2845(1993)
PubMed=7874267; DOI=10.1007/BF02349278
Ikuta S., Itoh F., Hinoda Y., Toyota M., Makiguchi Y., Imai K., Yachi A.
Expression of cytoskeletal-associated protein tyrosine phosphatase PTPH1 mRNA in human hepatocellular carcinoma.
J. Gastroenterol. 29:727-732(1994)
PubMed=7972006; DOI=10.1073/pnas.91.23.11045; PMCID=PMC45163
Okamoto A., Demetrick D.J., Spillare E.A., Hagiwara K., Hussain S.P., Bennett W.P., Forrester K., Gerwin B.I., Serrano M., Beach D.H., Harris C.C.
Mutations and altered expression of p16INK4 in human cancer.
Proc. Natl. Acad. Sci. U.S.A. 91:11045-11049(1994)
PubMed=8197130; DOI=10.1073/pnas.91.11.4751; PMCID=PMC43866
Bicknell D.C., Rowan A.J., Bodmer W.F.
Beta 2-microglobulin gene mutations: a study of established colorectal cell lines and fresh tumors.
Proc. Natl. Acad. Sci. U.S.A. 91:4751-4755(1994)
PubMed=7621404; DOI=10.1016/0165-4608(94)00225-z
Chen T.-R., Dorotinsky C.S., McGuire L.J., Macy M.L., Hay R.J.
DLD-1 and HCT-15 cell lines derived separately from colorectal carcinomas have totally different chromosome changes but the same genetic origin.
Cancer Genet. Cytogenet. 81:103-108(1995)
PubMed=7651727
Kastrinakis W.V., Ramchurren N., Rieger K.M., Hess D.T., Loda M., Steele G., Summerhayes I.C.
Increased incidence of p53 mutations is associated with hepatic metastasis in colorectal neoplastic progression.
Oncogene 11:647-652(1995)
PubMed=9290701; DOI=10.1002/(SICI)1098-2744(199708)19:4<243::aid-mc5>3.0.CO;2-D
Jia L.-Q., Osada M., Ishioka C., Gamo M., Ikawa S., Suzuki T., Shimodaira H., Niitani T., Kudo T., Akiyama M., Kimura N., Matsuo M., Mizusawa H., Tanaka N., Koyama H., Namba M., Kanamaru R., Kuroki T.
Screening the p53 status of human cell lines using a yeast functional assay.
Mol. Carcinog. 19:243-253(1997)
PubMed=9294210; DOI=10.1073/pnas.94.19.10330; PMCID=PMC23362
Ilyas M., Tomlinson I.P.M., Rowan A.J., Pignatelli M., Bodmer W.F.
Beta-catenin mutations in cell lines established from human colorectal cancers.
Proc. Natl. Acad. Sci. U.S.A. 94:10330-10334(1997)
PubMed=9515795
Sparks A.B., Morin P.J., Vogelstein B., Kinzler K.W.
Mutational analysis of the APC/beta-catenin/Tcf pathway in colorectal cancer.
Cancer Res. 58:1130-1134(1998)
PubMed=9809040; DOI=10.1016/S0165-4608(98)00081-8
Vermeulen S.J., Chen T.-R., Speleman F., Nollet F., Van Roy F.M., Mareel M.M.
Did the four human cancer cell lines DLD-1, HCT-15, HCT-8, and HRT-18 originate from one and the same patient?
Cancer Genet. Cytogenet. 107:76-79(1998)
PubMed=10674020; DOI=10.1016/S0959-8049(99)00206-3
Ku J.-L., Yoon K.-A., Kim D.-Y., Park J.-G.
Mutations in hMSH6 alone are not sufficient to cause the microsatellite instability in colorectal cancer cell lines.
Eur. J. Cancer 35:1724-1729(1999)
PubMed=10612807; DOI=10.1002/(SICI)1098-2264(200002)27:2<183::aid-gcc10>3.0.CO;2-P; PMCID=PMC4721570
Ghadimi B.M., Sackett D.L., Difilippantonio M.J., Schrock E., Neumann T., Jauho A., Auer G., Ried T.
Centrosome amplification and instability occurs exclusively in aneuploid, but not in diploid colorectal cancer cell lines, and correlates with numerical chromosomal aberrations.
Genes Chromosomes Cancer 27:183-190(2000)
PubMed=10700188; DOI=10.1038/73536
Gayther S.A., Batley S.J., Linger L., Bannister A.J., Thorpe K., Chin S.-F., Daigo Y., Russell P., Wilson A., Sowter H.M., Delhanty J.D.A., Ponder B.A.J., Kouzarides T., Caldas C.
Mutations truncating the EP300 acetylase in human cancers.
Nat. Genet. 24:300-303(2000)
PubMed=11226274; DOI=10.1073/pnas.041603298; PMCID=PMC30173
Abdel-Rahman W.M., Katsura K., Rens W., Gorman P.A., Sheer D., Bicknell D.C., Bodmer W.F., Arends M.J., Wyllie A.H., Edwards P.A.W.
Spectral karyotyping suggests additional subsets of colorectal cancers characterized by pattern of chromosome rearrangement.
Proc. Natl. Acad. Sci. U.S.A. 98:2538-2543(2001)
PubMed=11414198; DOI=10.1007/s004320000207
Lahm H., Andre S., Hoeflich A., Fischer J.R., Sordat B., Kaltner H., Wolf E., Gabius H.-J.
Comprehensive galectin fingerprinting in a panel of 61 human tumor cell lines by RT-PCR and its implications for diagnostic and therapeutic procedures.
J. Cancer Res. Clin. Oncol. 127:375-386(2001)
PubMed=11416159; DOI=10.1073/pnas.121616198; PMCID=PMC35459
Masters J.R.W., Thomson J.A., Daly-Burns B., Reid Y.A., Dirks W.G., Packer P., Toji L.H., Ohno T., Tanabe H., Arlett C.F., Kelland L.R., Harrison M., Virmani A.K., Ward T.H., Ayres K.L., Debenham P.G.
Short tandem repeat profiling provides an international reference standard for human cell lines.
Proc. Natl. Acad. Sci. U.S.A. 98:8012-8017(2001)
PubMed=11668190; DOI=10.1177/002215540104901105
Quentmeier H., Osborn M., Reinhardt J., Zaborski M., Drexler H.G.
Immunocytochemical analysis of cell lines derived from solid tumors.
J. Histochem. Cytochem. 49:1369-1378(2001)
PubMed=12068308; DOI=10.1038/nature00766
Davies H.R., Bignell G.R., Cox C., Stephens P.J., Edkins S., Clegg S., Teague J.W., Woffendin H., Garnett M.J., Bottomley W., Davis N., Dicks E., Ewing R., Floyd Y., Gray K., Hall S., Hawes R., Hughes J., Kosmidou V., Menzies A., Mould C., Parker A., Stevens C., Watt S., Hooper S., Wilson R., Jayatilake H., Gusterson B.A., Cooper C.S., Shipley J.M., Hargrave D., Pritchard-Jones K., Maitland N.J., Chenevix-Trench G., Riggins G.J., Bigner D.D., Palmieri G., Cossu A., Flanagan A.M., Nicholson A., Ho J.W.C., Leung S.Y., Yuen S.T., Weber B.L., Seigler H.F., Darrow T.L., Paterson H.F., Marais R., Marshall C.J., Wooster R., Stratton M.R., Futreal P.A.
Mutations of the BRAF gene in human cancer.
Nature 417:949-954(2002)
PubMed=12615714
Hempen P.M., Zhang L., Bansal R.K., Iacobuzio-Donahue C.A., Murphy K.M., Maitra A., Vogelstein B., Whitehead R.H., Markowitz S.D., Willson J.K.V., Yeo C.J., Hruban R.H., Kern S.E.
Evidence of selection for clones having genetic inactivation of the activin A type II receptor (ACVR2) gene in gastrointestinal cancers.
Cancer Res. 63:994-999(2003)
PubMed=16418264; DOI=10.1073/pnas.0510146103; PMCID=PMC1327731
Liu Y., Bodmer W.F.
Analysis of p53 mutations and their expression in 56 colorectal cancer cell lines.
Proc. Natl. Acad. Sci. U.S.A. 103:976-981(2006)
PubMed=16854228; DOI=10.1186/1476-4598-5-29; PMCID=PMC1550420
Bandres Elizalde E.M., Cubedo E., Agirre X., Malumbres R., Zarate R., Ramirez N., Abajo A., Navarro A., Moreno I., Monzo M., Garcia-Foncillas J.
Identification by real-time PCR of 13 mature microRNAs differentially expressed in colorectal cancer and non-tumoral tissues.
Mol. Cancer 5:29.1-29.10(2006)
PubMed=18258742; DOI=10.1073/pnas.0712176105; PMCID=PMC2268141
Emaduddin M., Bicknell D.C., Bodmer W.F., Feller S.M.
Cell growth, global phosphotyrosine elevation, and c-Met phosphorylation through Src family kinases in colorectal cancer cells.
Proc. Natl. Acad. Sci. U.S.A. 105:2358-2362(2008)
PubMed=19927377; DOI=10.1002/gcc.20730; PMCID=PMC2818350
Knutsen T., Padilla-Nash H.M., Wangsa D., Barenboim-Stapleton L., Camps J., McNeil N.E., Difilippantonio M.J., Ried T.
Definitive molecular cytogenetic characterization of 15 colorectal cancer cell lines.
Genes Chromosomes Cancer 49:204-223(2010)
PubMed=20570890; DOI=10.1158/0008-5472.CAN-10-0192; PMCID=PMC2943514
Janakiraman M., Vakiani E., Zeng Z.-S., Pratilas C.A., Taylor B.S., Chitale D., Halilovic E., Wilson M., Huberman K., Ricarte Filho J.C.M., Persaud Y., Levine D.A., Fagin J.A., Jhanwar S.C., Mariadason J.M., Lash A., Ladanyi M., Saltz L.B., Heguy A., Paty P.B., Solit D.B.
Genomic and biological characterization of exon 4 KRAS mutations in human cancer.
Cancer Res. 70:5901-5911(2010)
PubMed=20606684; DOI=10.1038/sj.bjc.6605780; PMCID=PMC2920028
Bracht K., Nicholls A.M., Liu Y., Bodmer W.F.
5-fluorouracil response in a large panel of colorectal cancer cell lines is associated with mismatch repair deficiency.
Br. J. Cancer 103:340-346(2010)
PubMed=22460905; DOI=10.1038/nature11003; PMCID=PMC3320027
Barretina J.G., Caponigro G., Stransky N., Venkatesan K., Margolin A.A., Kim S., Wilson C.J., Lehar J., Kryukov G.V., Sonkin D., Reddy A., Liu M., Murray L., Berger M.F., Monahan J.E., Morais P., Meltzer J., Korejwa A., Jane-Valbuena J., Mapa F.A., Thibault J., Bric-Furlong E., Raman P., Shipway A., Engels I.H., Cheng J., Yu G.-Y.K., Yu J.-J., Aspesi P. Jr., de Silva M., Jagtap K., Jones M.D., Wang L., Hatton C., Palescandolo E., Gupta S., Mahan S., Sougnez C., Onofrio R.C., Liefeld T., MacConaill L.E., Winckler W., Reich M., Li N.-X., Mesirov J.P., Gabriel S.B., Getz G., Ardlie K., Chan V., Myer V.E., Weber B.L., Porter J., Warmuth M., Finan P., Harris J.L., Meyerson M.L., Golub T.R., Morrissey M.P., Sellers W.R., Schlegel R., Garraway L.A.
The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity.
Nature 483:603-607(2012)
PubMed=22490663; DOI=10.1016/j.bbrc.2012.03.122
Saiki Y., Yoshino Y., Fujimura H., Manabe T., Kudo Y., Shimada M., Mano N., Nakano T., Lee Y., Shimizu S., Oba S., Fujiwara S., Shimizu H., Chen N., Nezhad Z.K., Jin G., Fukushige S., Sunamura M., Ishida M., Motoi F., Egawa S., Unno M., Horii A.
DCK is frequently inactivated in acquired gemcitabine-resistant human cancer cells.
Biochem. Biophys. Res. Commun. 421:98-104(2012)
PubMed=23272949; DOI=10.1186/1755-8794-5-66; PMCID=PMC3543849
Schlicker A., Beran G., Chresta C.M., McWalter G., Pritchard A., Weston S., Runswick S., Davenport S., Heathcote K., Castro D.A., Orphanides G., French T., Wessels L.F.A.
Subtypes of primary colorectal tumors correlate with response to targeted treatment in colorectal cell lines.
BMC Med. Genomics 5:66.1-66.15(2012)
PubMed=24042735; DOI=10.1038/oncsis.2013.35; PMCID=PMC3816225
Ahmed D., Eide P.W., Eilertsen I.A., Danielsen S.A., Eknaes M., Hektoen M., Lind G.E., Lothe R.A.
Epigenetic and genetic features of 24 colon cancer cell lines.
Oncogenesis 2:e71.1-e71.8(2013)
PubMed=24755471; DOI=10.1158/0008-5472.CAN-14-0013
Mouradov D., Sloggett C., Jorissen R.N., Love C.G., Li S., Burgess A.W., Arango D., Strausberg R.L., Buchanan D., Wormald S., O'Connor L., Wilding J.L., Bicknell D.C., Tomlinson I.P.M., Bodmer W.F., Mariadason J.M., Sieber O.M.
Colorectal cancer cell lines are representative models of the main molecular subtypes of primary cancer.
Cancer Res. 74:3238-3247(2014)
PubMed=25960936; DOI=10.4161/21624011.2014.954893; PMCID=PMC4355981
Boegel S., Lower M., Bukur T., Sahin U., Castle J.C.
A catalog of HLA type, HLA expression, and neo-epitope candidates in human cancer cell lines.
OncoImmunology 3:e954893.1-e954893.12(2014)
PubMed=25984343; DOI=10.1038/sdata.2014.35; PMCID=PMC4432652
Cowley G.S., Weir B.A., Vazquez F., Tamayo P., Scott J.A., Rusin S., East-Seletsky A., Ali L.D., Gerath W.F.J., Pantel S.E., Lizotte P.H., Jiang G.-Z., Hsiao J., Tsherniak A., Dwinell E., Aoyama S., Okamoto M., Harrington W., Gelfand E.T., Green T.M., Tomko M.J., Gopal S., Wong T.C., Li H.-B., Howell S., Stransky N., Liefeld T., Jang D., Bistline J., Meyers B.H., Armstrong S.A., Anderson K.C., Stegmaier K., Reich M., Pellman D., Boehm J.S., Mesirov J.P., Golub T.R., Root D.E., Hahn W.C.
Parallel genome-scale loss of function screens in 216 cancer cell lines for the identification of context-specific genetic dependencies.
Sci. Data 1:140035-140035(2014)
PubMed=25485619; DOI=10.1038/nbt.3080
Klijn C., Durinck S., Stawiski E.W., Haverty P.M., Jiang Z.-S., Liu H.-B., Degenhardt J., Mayba O., Gnad F., Liu J.-F., Pau G., Reeder J., Cao Y., Mukhyala K., Selvaraj S.K., Yu M.-M., Zynda G.J., Brauer M.J., Wu T.D., Gentleman R.C., Manning G., Yauch R.L., Bourgon R., Stokoe D., Modrusan Z., Neve R.M., de Sauvage F.J., Settleman J., Seshagiri S., Zhang Z.-M.
A comprehensive transcriptional portrait of human cancer cell lines.
Nat. Biotechnol. 33:306-312(2015)
PubMed=25877200; DOI=10.1038/nature14397
Yu M., Selvaraj S.K., Liang-Chu M.M.Y., Aghajani S., Busse M., Yuan J., Lee G., Peale F.V., Klijn C., Bourgon R., Kaminker J.S., Neve R.M.
A resource for cell line authentication, annotation and quality control.
Nature 520:307-311(2015)
PubMed=25841592; DOI=10.1016/j.jprot.2015.03.019
Piersma S.R., Knol J.C., de Reus I., Labots M., Sampadi B.K., Pham T.V., Ishihama Y., Verheul H.M.W., Jimenez C.R.
Feasibility of label-free phosphoproteomics and application to base-line signaling of colorectal cancer cell lines.
J. Proteomics 127:247-258(2015)
PubMed=25926053; DOI=10.1038/ncomms8002
Medico E., Russo M., Picco G., Cancelliere C., Valtorta E., Corti G., Buscarino M., Isella C., Lamba S., Martinoglio B., Veronese S., Siena S., Sartore-Bianchi A., Beccuti M., Mottolese M., Linnebacher M., Cordero F., Di Nicolantonio F., Bardelli A.
The molecular landscape of colorectal cancer cell lines unveils clinically actionable kinase targets.
Nat. Commun. 6:7002.1-7002.10(2015)
PubMed=25944804; DOI=10.1158/1078-0432.CCR-14-2457
Bazzocco S., Dopeso H., Carton-Garcia F., Macaya I., Andretta E., Chionh F., Rodrigues P., Garrido M., Alazzouzi H., Nieto R., Sanchez A., Schwartz S. Jr., Bilic J., Mariadason J.M., Arango D.
Highly expressed genes in rapidly proliferating tumor cells as new targets for colorectal cancer treatment.
Clin. Cancer Res. 21:3695-3704(2015)
PubMed=26295583; DOI=10.1371/journal.pone.0135958; PMCID=PMC4546578
Vidyasekar P., Shyamsunder P., Arun R., Santhakumar R., Kapadia N.K., Kumar R., Verma R.S.
Genome wide expression profiling of cancer cell lines cultured in microgravity reveals significant dysregulation of cell cycle and microRNA gene networks.
PLoS ONE 10:E0135958-E0135958(2015)
PubMed=26589293; DOI=10.1186/s13073-015-0240-5; PMCID=PMC4653878
Scholtalbers J., Boegel S., Bukur T., Byl M., Goerges S., Sorn P., Loewer M., Sahin U., Castle J.C.
TCLP: an online cancer cell line catalogue integrating HLA type, predicted neo-epitopes, virus and gene expression.
Genome Med. 7:118.1-118.7(2015)
PubMed=26537799; DOI=10.1074/mcp.M115.051235; PMCID=PMC4762531
Holst S., Deuss A.J.M., van Pelt G.W., van Vliet S.J., Garcia-Vallejo J.J., Koeleman C.A.M., Deelder A.M., Mesker W.E., Tollenaar R.A.E.M., Rombouts Y., Wuhrer M.
N-glycosylation profiling of colorectal cancer cell lines reveals association of fucosylation with differentiation and caudal type homebox 1 (CDX1)/villin mRNA expression.
Mol. Cell. Proteomics 15:124-140(2016)
PubMed=28179481; DOI=10.1158/1535-7163.MCT-16-0578
Tanaka N., Mashima T., Mizutani A., Sato A., Aoyama A., Gong B., Yoshida H., Muramatsu Y., Nakata K., Matsuura M., Katayama R., Nagayama S., Fujita N., Sugimoto Y., Seimiya H.
APC mutations as a potential biomarker for sensitivity to tankyrase inhibitors in colorectal cancer.
Mol. Cancer Ther. 16:752-762(2017)
PubMed=28192450; DOI=10.1371/journal.pone.0171435; PMCID=PMC5305277
Fasterius E., Raso C., Kennedy S.A., Rauch N., Lundin P., Kolch W., Uhlen M., Al-Khalili Szigyarto C.
A novel RNA sequencing data analysis method for cell line authentication.
PLoS ONE 12:E0171435-E0171435(2017)
PubMed=28196595; DOI=10.1016/j.ccell.2017.01.005; PMCID=PMC5501076
Li J., Zhao W., Akbani R., Liu W.-B., Ju Z.-L., Ling S.-Y., Vellano C.P., Roebuck P., Yu Q.-H., Eterovic A.K., Byers L.A., Davies M.A., Deng W.-L., Gopal Y.N.V., Chen G., von Euw E.M., Slamon D.J., Conklin D., Heymach J.V., Gazdar A.F., Minna J.D., Myers J.N., Lu Y.-L., Mills G.B., Liang H.
Characterization of human cancer cell lines by reverse-phase protein arrays.
Cancer Cell 31:225-239(2017)
PubMed=28683746; DOI=10.1186/s12943-017-0691-y; PMCID=PMC5498998
Berg K.C.G., Eide P.W., Eilertsen I.A., Johannessen B., Bruun J., Danielsen S.A., Bjornslett M., Meza-Zepeda L.A., Eknaes M., Lind G.E., Myklebost O., Skotheim R.I., Sveen A., Lothe R.A.
Multi-omics of 34 colorectal cancer cell lines -- a resource for biomedical studies.
Mol. Cancer 16:116.1-116.16(2017)
PubMed=29101300; DOI=10.15252/msb.20177701; PMCID=PMC5731344
Frejno M., Zenezini Chiozzi R., Wilhelm M., Koch H., Zheng R.-S., Klaeger S., Ruprecht B., Meng C., Kramer K., Jarzab A., Heinzlmeir S., Johnstone E., Domingo E., Kerr D.J., Jesinghaus M., Slotta-Huspenina J., Weichert W., Knapp S., Feller S.M., Kuster B.
Pharmacoproteomic characterisation of human colon and rectal cancer.
Mol. Syst. Biol. 13:951-951(2017)"