
1YR企业会员
发布人:武汉恩玑生命科技有限公司
发布日期:2025/10/31 15:06:51
在肿瘤免疫研究中,精准表征肿瘤免疫微环境(TME)中免疫细胞的类型、分布及功能状态,是理解肿瘤免疫逃逸机制、筛选免疫治疗获益人群的关键。传统免疫组化(IHC)技术仅能单次检测 1-2 个生物标志物,且依赖 chromogenic 底物(如 DAB)显色,存在信号叠加干扰、低表达标志物漏检等问题,无法满足 TME “多细胞互作” 的复杂分析需求。
多重免疫荧光(mIF)技术的出现突破了这一限制,可同时检测多个生物标志物并保留组织空间结构。其中,基于酪胺信号放大(TSA)原理的 Opal mIF 技术,通过酶促反应实现信号高效放大,还能避免一抗种属交叉反应,成为 TME 研究的核心工具。然而,该技术在实际应用中仍面临诸多挑战:缺乏标准化的实验流程(如抗体染色顺序、荧光染料配对)、数字图像分析(DIA)的主观性、预分析变量(如组织厚度)对结果的干扰,导致实验重复性差、数据可信度低,难以推广至临床研究。
Viratham Pulsawatdi A等人的研究聚焦结直肠癌(CRC)福尔马林固定石蜡包埋(FFPE)组织,旨在解决以下三大核心问题:
1. 技术标准化:建立从样本染色到图像分析的完整 Opal mIF工作流程,明确关键优化参数(如抗体染色顺序、Opal-抗体配对、光谱解混),确保实验可重复性。
2. 方法学验证:通过与传统 chromogenic IHC 对比,验证 mIF 技术在生物标志物定量检测中的准确性,确认其能否替代传统技术用于 TME 免疫分型。
3. 临床适用性:评估该标准化工作流程在 CRC 临床样本中的应用潜力,明确其能否高效、精准地表征 TME 免疫细胞组成,为后续免疫治疗相关研究提供可靠技术支撑。
1. 样本选择:
l 优化阶段:使用扁桃体组织(高免疫细胞丰度,作为阳性对照)和 CRC 手术切除 FFPE 组织(4 μm 厚),验证抗体特异性与染色条件。
l 验证阶段:构建包含 6 种正常组织(扁桃体、胎盘、结肠上皮、淋巴结、阑尾、脾脏)的组织微阵列(TMA),通过连续切片分别进行 chromogenic IHC 和 mIF 染色,实现方法学对比。
l 应用阶段:选取 10 例 CRC 患者全组织切片(5 例用于 MP1,5 例用于 MP2),测试标准化工作流程的临床适用性。
2. 核心技术路线:
3. 抗体组合设计
l MP1组合:CD3、CD4、CD8、CD20、CK(细胞角蛋白)、DAPI;
l MP2组合:CD4、CD68、FOXP3、CK、DAPI;
l 设计考虑:共表达标志物(如CD4与FOXP3)需分配至不同荧光通道,避免光谱重叠与空间干扰。
1. 最终优化的两个 mIF 抗体组合(MP1 与 MP2):
抗体组合
包含标志物
核心功能
Opal-抗体配对(基于丰度与共表达)
MP1(6-plex)
CD3、CD4、CD8、CD20、CK、DAPI
表征 T 细胞亚群(CD3+、CD4+、CD8+)与 B 细胞(CD20+),区分肿瘤细胞(CK+)
CD3-Opal 540(中亮度)、CD4-Opal 620(中亮度)、CD8-Opal 690(低亮度)、CD20-Opal 650(高亮度)、CK-Opal 570(中亮度
MP2(5-plex)
CD4、CD68、FOXP3、CK、DAPI
表征调节性 T 细胞(CD4+、FOXP3+)与巨噬细胞(CD68+)
CD4-Opal 620(中亮度)、CD68-Opal 570(中亮度)、FOXP3-Opal 650(高亮度)、CK-Opal 480(高亮度)
(MP1组合关键参数优化结果)
(高通量图像获取的优化结果)
2. 关键技术参数标准:
l 组织厚度:3-4 μm(过厚会导致 autofluorescence 升高,信号强度偏差 > 40%;过薄则组织完整性受损);
l 信号平衡:各通道信号强度 20-25 counts(通过 INFORM 软件监测,确保低表达标志物不被掩盖);
l 光谱解混:必须去除 autofluorescence(FFPE 组织 autofluorescence 强度与厚度正相关,可通过 autofluorescence 通道验证切片厚度一致性)。
通过 TMA 连续切片对比,mIF 与 chromogenic IHC 在生物标志物定量检测中表现出极高相关性:
1. 对于 MP1 面板,除 CD8(因抗原稳定性导致相关性 rₛ=0.88)外,CD20、CD3、CD4、CK 的 Spearman 相关系数均 > 0.9(P<0.0001),Bland-Altman 分析显示所有标志物的检测偏差均在 95% 一致性界限内(如 CD20偏差= 9.315,CD3偏差= 4.940)。
2. 对于 MP2 面板,CD4、CD68、CK 的相关性 rₛ>0.9(P<0.0001),仅 FOXP3 因在正常组织中表达极低(<0.5%)导致相关性略低(rₛ=0.85),但仍满足临床检测需求。
这些结果证实,优化后的 mIF 技术可准确替代传统 IHC,用于生物标志物定量检测,且能同时获取多标志物信息,效率显著提升。
(mIF 与传统 IHC 技术染色对比结果)
在 10 例 CRC 临床样本中,该标准化工作流程表现出以下优势:
1. 高效性:从组织切片到数据分析可在 24 小时内完成(传统 mIF 手动操作需 3 天),且能同时检测 5-6 个标志物,大幅缩短实验周期。
2. 精准性:成功识别出 CRC TME 中的关键免疫细胞亚群,如 CD8 + 细胞毒性 T 细胞、CD4+、FOXP3 + 调节性 T 细胞、CD68 + 巨噬细胞,并准确区分肿瘤巢(CK+)与间质区域的免疫细胞分布差异(如间质区 FOXP3+Treg 比例显著高于肿瘤巢)。
3. 稳定性:10 例样本中仅 3 例因 autofluorescence 超出解混范围被排除,其余 7 例检测结果一致性高,无明显批间差异,证实其临床适用性。
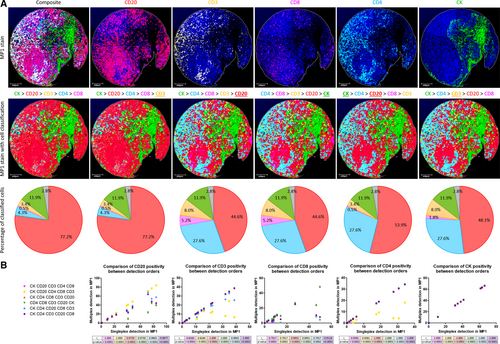
(MP1组合标准化工作流程细胞检测顺序优化结果)
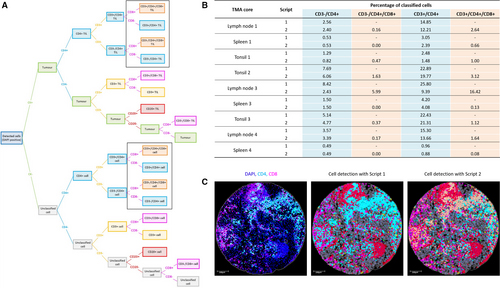
(在MP1组合中使用定制脚本进行细胞分类结果)
1. 填补技术空白:首次系统梳理 Opal mIF 技术的关键影响因素(如抗体染色顺序、组织厚度、光谱解混),提供可直接复用的标准化工作流程,解决了该技术长期存在的 “实验重复性差” 问题。
2. 方法学创新:通过与传统 IHC 的严格对比,验证了 mIF 技术在生物标志物定量中的准确性,为后续 TME 多维度研究(如免疫细胞空间互作、动态变化)提供了可靠技术基础,推动肿瘤免疫微环境研究从 “单标志物” 向 “多组学整合” 发展。
1. 免疫治疗获益人群筛选:该工作流程可快速量化 CRC TME 中 CD8+T 细胞 / FOXP3+Treg 比例、CD68 + 巨噬细胞丰度等关键指标,这些指标已被证实与免疫检查点抑制剂(如 PD-1 抗体)疗效相关,未来可用于筛选潜在获益患者。
2. 治疗疗效监测:通过对比治疗前后患者 TME 免疫细胞组成变化(如 CD8+T 细胞浸润增加与否),可动态评估免疫治疗效果,为临床方案调整提供依据。
本研究不仅构建了一个标准化、可扩展、高通量的多重免疫荧光分析平台,更为肿瘤免疫微环境的精准刻画与临床转化提供了坚实的方法学基础。随着免疫治疗时代的到来,TSA技术的应用愈加广泛:
1. 疾病诊断:在癌症研究中,TSA多重荧光染色可以帮助医生更准确地判断肿瘤的类型和恶性程度,为治疗提供重要依据。
2. 药物研发:通过观察药物对细胞的影响,帮助科学家们开发更有效的药物。
3. 基础研究:帮助科学家们更好地理解细胞的生理和病理过程。
为助力广大科研工作者,EnkiLife 推出了TSA多重荧光染色试剂盒。本试剂盒适用范围广泛,温和抗体洗脱,可实现一张切片释放7重信息,提供一站式组份,开盒即用,大幅提升实验效率!
示例图片:
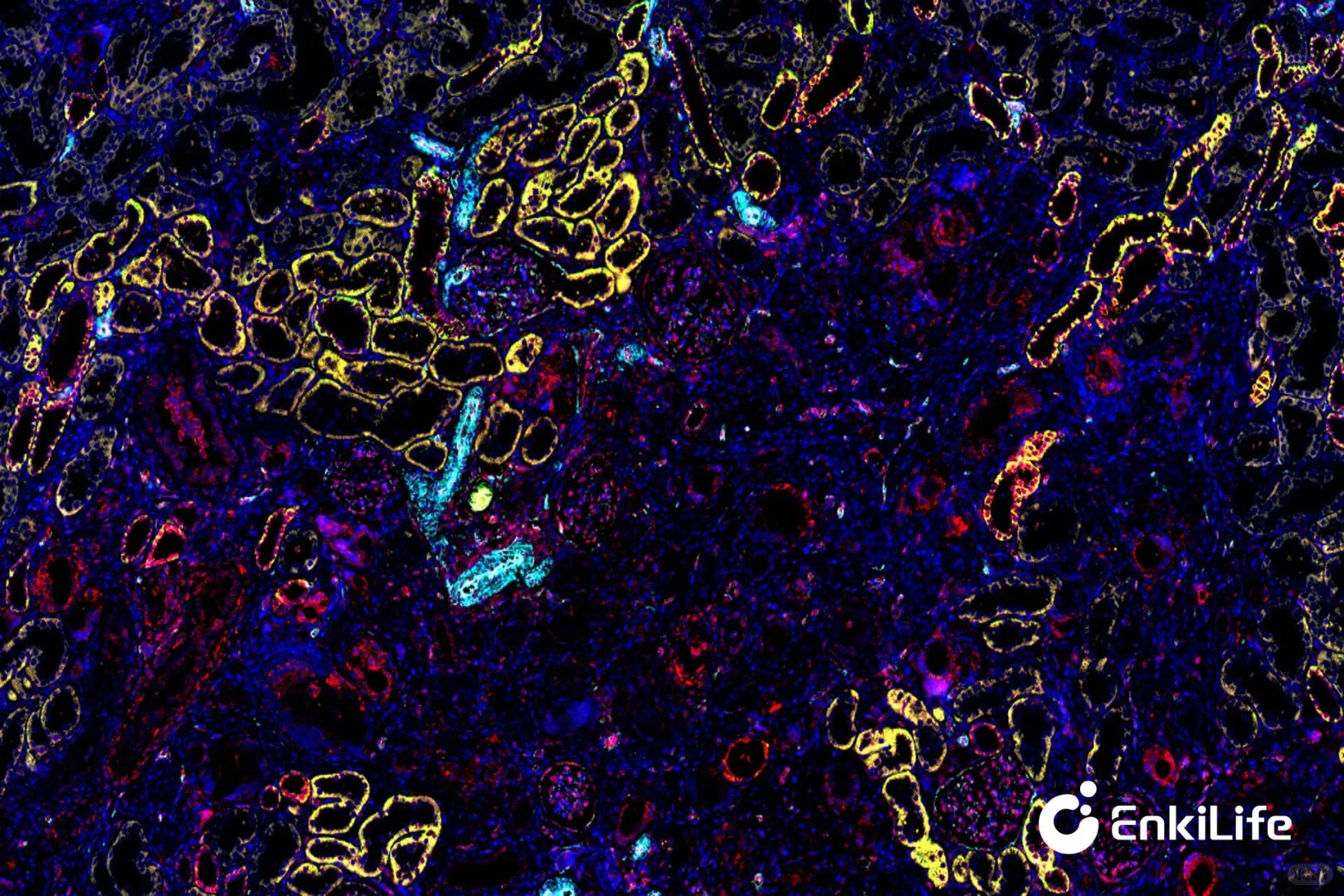
测试样本:鼠肾
AQP4:在内髓集合管的主要细胞、皮质和外髓集合管中可见到阳性染色。
CD31:广泛用于标记血管内皮;表达于肾小球毛细血管内皮和各级血管中。
TGFβ1:表达在高血压和纤维化模型中显著上调;可在肾小球上皮细胞(主要是足细胞)和间质成纤维细胞中检测到。
ZO-1:作为一种紧密连接的支架蛋白,它维持了肾小球滤过屏障和管状上皮极性。
Collagen I:在纤维化或硬化模型中,它广泛地积累在间质和肾小球中。
1. A robust multiplex immunofluorescence and digital pathology workflow for the characterisation of the tumour immune microenvironment. Viratham Pulsawatdi A, et al. Mol Oncol. 2020. [PMID: 32671911]
相关新闻资讯