
9YR企业会员
发布人:成都普思生物科技股份有限公司
发布日期:2025/12/12 14:15:09
按照国家药品监督管理局等四部门《关于结束中药配方颗粒试点工作的公告》等要求,我局已完成第十八批15个中药配方颗粒品种的质量标准、以及第三批3个中药配方颗粒品种外省标准转化成本省的试行标准的审核工作,另对1个四川省标准进行修订。为确保标准科学性、合理性和适应性,现公开征求意见,公示期为10天。公示期间,若有异议,请书面反馈至四川省药品检验研究院,并附相关说明及实验数据。
四川省药品监督管理局
2025年12月8日
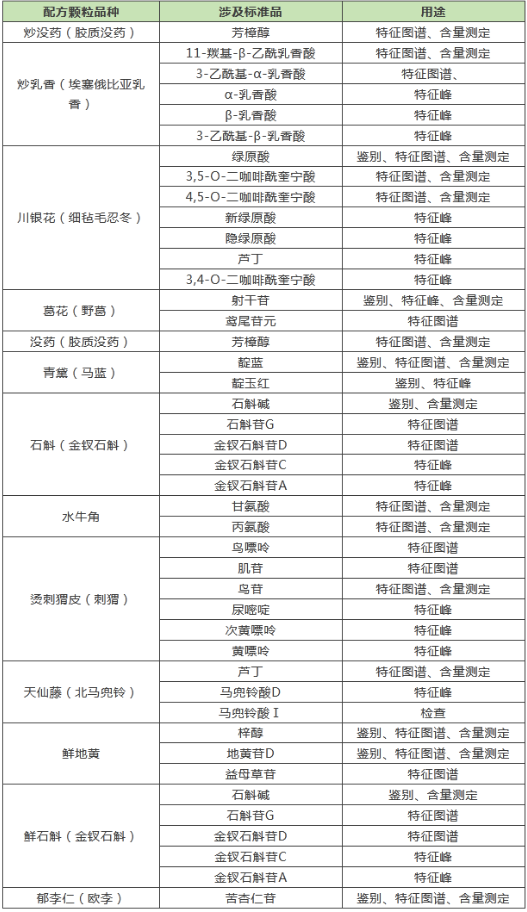
此次公示中,四川省药品监督管理局又新增了一批上报评审、转化配方颗粒品种。对照品作为精准衡量中药配方颗粒质量的关键标尺,其供应的稳定性与准确性直接影响到标准的有效执行以及产品质量的可靠程度。以下四川省配方颗粒标准涉及对照品普思生物均有供应,欢迎咨询!
新增四川省配方颗粒标准涉及对照品
相关新闻资讯