
8YR企业会员
发布人:成都普思生物科技股份有限公司
发布日期:2024/12/23 8:47:21
化学单体质谱分析(正常反馈时间1天)
组分系列化合物质谱分析(正常反馈时间3-5天)
复杂样品和化药杂质分析(二维色谱分析)
1.质量平衡法
含量=HPLC纯度*[100%-水分%-溶残%-炽灼残渣%]
或含量=HPLC纯度*[100%-干燥失重%-炽灼残渣%]
2.核磁定量法
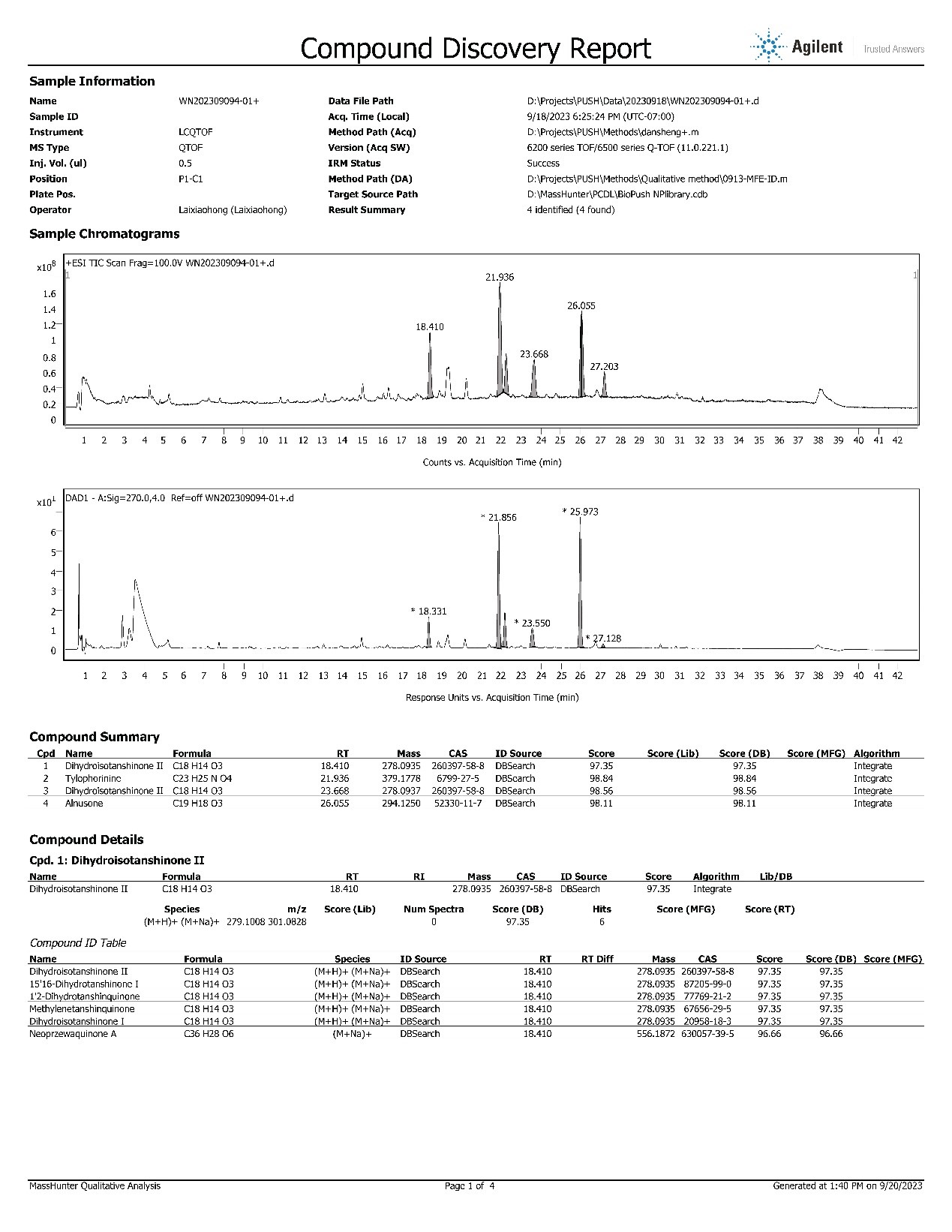
三、化合物结构鉴定
利用UV、IR、MS、(1H13,C)NMR、HSQC、HMBC、NOESY、COSY、CD、X-ray等现代波谱技术,对化合物平面结构及立体结构进行研究。
四、中药材检测(CNAS认可)
中药材常规检测项目(约30项)均包含在CNAS认可能力范围以内。自2019年1月通过初评后,又连续3次通过复评审,并且每年参加中检院组织的能力验证,获得满意结果10次以上,检测结果持续准确可靠。

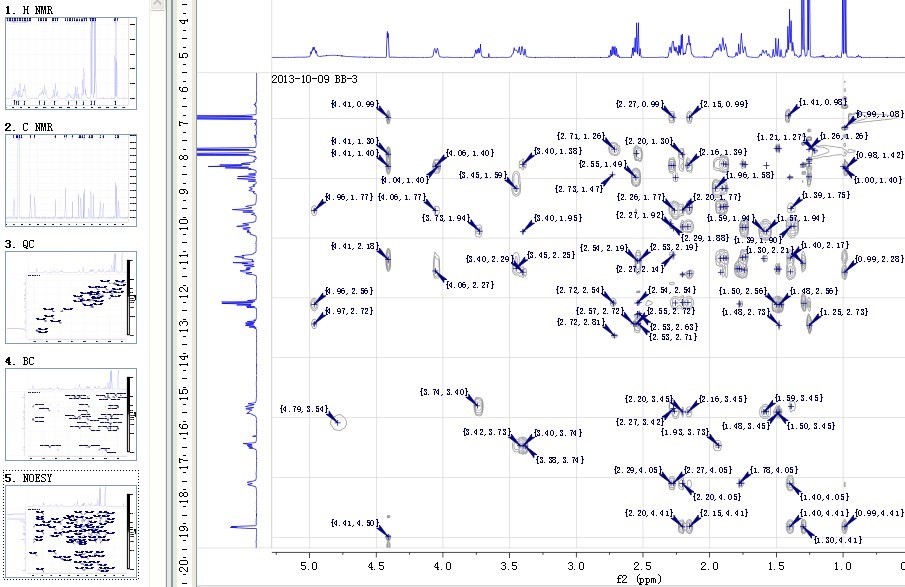
综合提取、分离、色谱和质谱分析等方法,对药材/植物内特征成分进行系统化研究,深入系统的发现植物药效物质成分。一般完成周期约6-8周。
先对原料进行成分初步分析再制定纯化方案,主要通过色谱分离方法,对制定目标单一成分或系列成分进行分离(包含百克级-KG级原料的生产)。一般完成周期5-30个工作日。
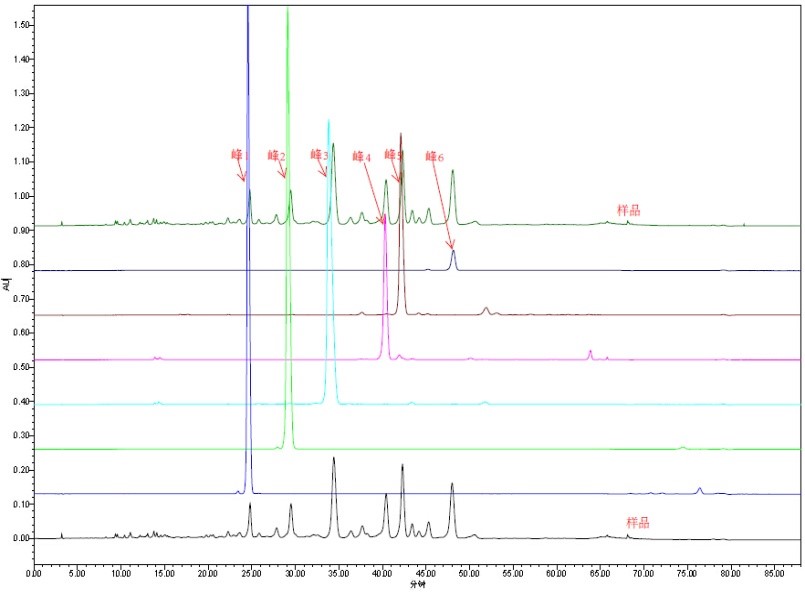
通过天然产物中的部分结构元素或中间体,用化学合成的方法来构建目标化合物。优势在于有效利用天然产物中的已有结构,减少分离成本和全合成的步骤。一般完成周期2-4周。
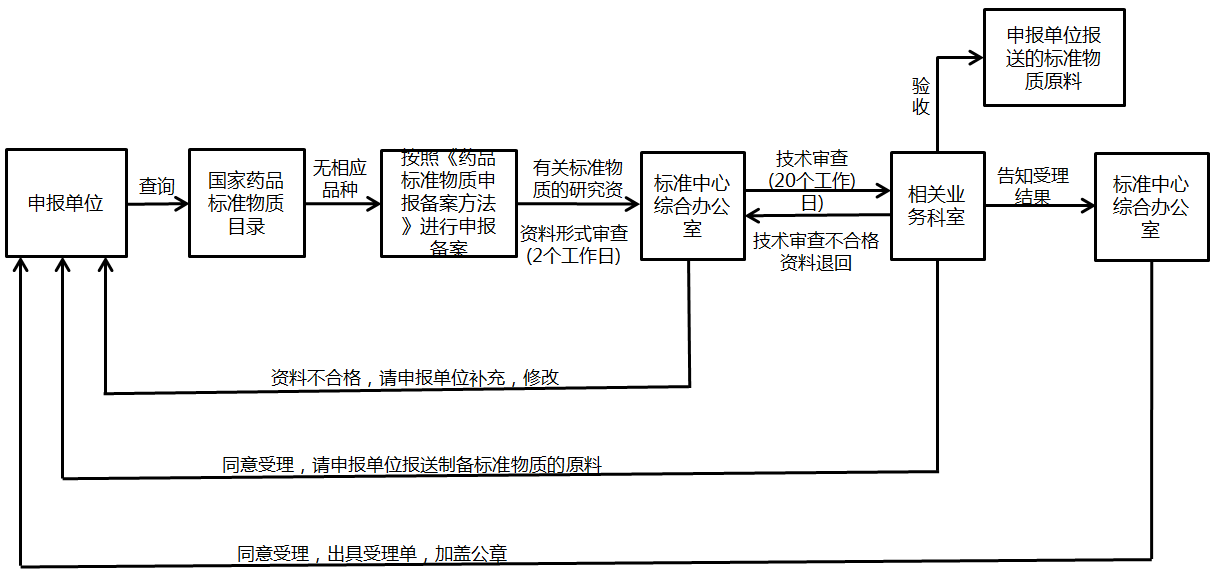
为了保证药品的质量和安全,药检部门需提前获得核准的药品标准中新增标准物质原料及有关研究资料,按照《药品注册检验程序和技术要求规范》中相关要求,药品生产单位需进行药品标准物质原料申报备案。一般完成周期6-8周。
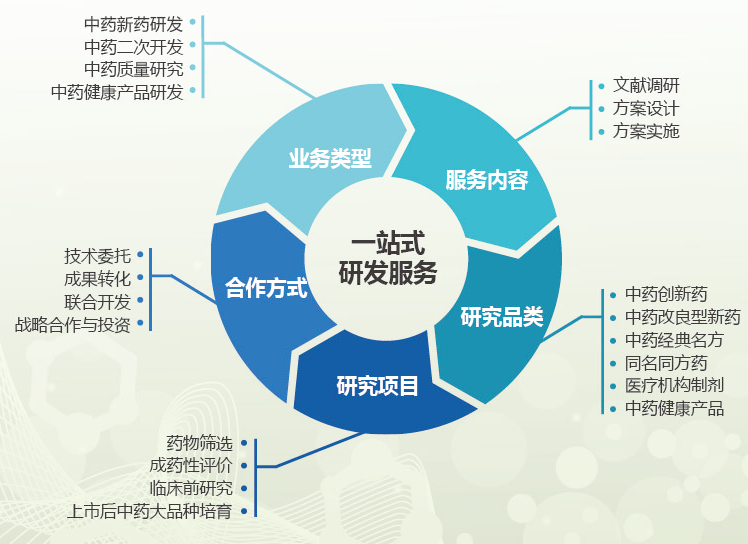
竭诚为企业提供包括中药新药研发、同名同方及经典名方等中药研发的优质研发技术服务。根据中医药特点和中药“三结合”审评体系要求,帮助企业布局中药新药研发战略规划、开展中药新药立项评估、设计新药研发路径和研究计划,降低中药新药研究风险。
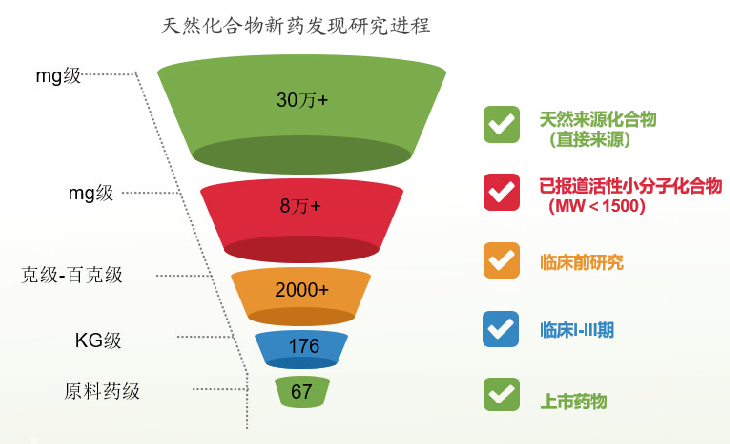
1. 中药新化合物发现与活性筛选研究
包括天然活性成分、中药提取物及中药复方制剂等在内的新药探索期的活性筛选及药效学研究,从而为其能否进行新药开发提供判定依据。
2. 中药新药临床前系统研究
基于现行中药新药注册管理办法及相关指导原则,开展包括临床前药学、药效学、安全性评价等在内的系统研究,为新药临床注册申报及IND获取提供依据。
3. 经典名方研究
基于现行经典名方研究指导原则,开展经典名方物质基准研究、制剂工艺及质量研究、安全性评价研究等,并协助企业开展生产放大研究和进行注册申报。
4. 改良型新药及同名同方药开发研究
按照现行中药注册管理办法,开展以临床应用优势为导向的改良型新药和以质量一致性为导向的同名同方药研究。
5. 组分中药的配伍研究及高端制剂研究
按照中医理论开展活性配伍筛选,确定最佳活性配伍比例,完成临床前药学各项研究。
▽▽想了解更多信息请点击普思官网查看
www.push-herbchem.com
咨询联系:18080489829(微信同号),3004654993(qq)
相关新闻资讯