甘氨酸又称氨基乙酸或氨基醋酸,结构简式H2N—CH2—COOH,是所有氨基酸中结构最为简单的氨基酸,也是唯一没有旋光异构体的α-氨基酸。1820年化学家布拉孔诺用盐酸处理明胶得到一种有甜味的物质,他最初误以为是糖类化合物,后经分析才知是一种含氮且有羧基的化合物,并可用来制造氨气。因此命名为甘氨酸。常呈四边柱状,无色单斜晶体,密度1.1607克/厘米3,熔点232~236℃(分解),可溶于水,微溶于无水乙醇、丙酮、吡啶,不溶于乙醚等有机溶剂。可被酰化成N-酰基甘氨酸或分子间失水得1,5-哌嗪二酮。以动物胶和丝蛋白中含量最多。有甜味,是中性氨基酸,等电点pH为6。在水溶液中被茚三酮氧化生成甲醛,可溶解在强酸或强碱中,呈两性,能被酒精沉淀析出。常用α-卤代酸与浓氨水作用制取。分子中含有羧基和氨基,具有两性,既能和碱反应又能和酸反应。存在于低级动物的筋肉中。营养学上属于人体非必需的氨基酸。用于药物的合成,可直接用以治疗各种肌肉麻痹和抗胃酸剂等,也用作金霉素的缓冲剂。
甘氨酸在动物体内参与许多重要化合物的合成,与氨、甲酸、二氧化碳可生成嘌呤类物质; 与琥珀酸能合成卟啉类物质。是肌酸、甘氨胆酸、谷胱甘肽等的合成原料之一。在人体内起解毒作用,如当芳香类物质等进入人体后,甘氨酸与它们结合成无毒物,再经肝脏氧化后排出体外。例如与苯甲酸(防腐剂)作用生成马尿酸排出体外。在羟甲基酶催化下形成丝氨酸。近年来甘氨酸又用作氨基酸农药,例如每1万米2(15亩) 甘蔗田用飞机喷洒85%甘氨酸溶液2.5公斤,能使甘蔗糖分增加12.9%。1973年德国化学家斯密司制成的N-磷酸甲酯甘氨酸是一种有效的除草剂,每1万米2使用1.5公斤即可消灭杂草。甘氨酸还可用于制造一些抗癌药,例如用甘氨酸与重氮化合物作用制成的一系列抗癌药物对胃癌等有显著功效。甘氨酸现已大量生产。
【食品行业应用】
甘氨酸主要用于食品工业,它具有呈味、抑菌、螯合、防氧化作用,在食品中起改善味质、防止油脂氧化、咸味调和、增加甜味的功能。甜度是蔗糖的0.8倍,具有与糖不同的柔和甜味,在饮料和酒中作矫味剂,还可除苦味。甘氨酸能一定程度呈虾、墨鱼味,用于调味酱,如甘氨酸19.5份,天然氨基酸8份,琥珀酸钠0.5份,可制成具有虾仁味粉汤料。由于甘氨酸是两性离子,起缓冲作用,对食盐和食醋有减弱效果。一般盐腌品加入量为0.3%~0.7%,酸渍品0.05%~0.5%。甘氨酸即有防腐作用,又有营养、改善风味的功能。在鱼块、鱼丸、火腿、腊肠、花生酱中加入量为1%~2%,在防腐的同时,又可抑制产品发臭,并具有螯合和抗氧化的作用。
【氨基酸】
氨基酸是蛋白质的组成单位。蛋白质是由肽类所组成,肽类的肽链是由氨基酸组成。不同蛋白质是由氨基酸组成不同顺序与长短的肽链所组成。与遗传有关的基因实际上也是不同顺序的氨基酸链。
目前,与人体有关的共有28种氨基酸。这28种氨基酸排列成不同顺序与不同长度的肽链来组成身体各部分的蛋白质。根据统计共有100多种蛋白质。我们膳食中的蛋白质并不直接构成身体中的蛋白质,而是经过消化吸收以后,主要在肝脏中转变成氨基酸,这些氨基酸再根据人体的需要,重新组合成体内的100多种蛋白质。因此,严格地说不是蛋白质而是氨基酸才是人体所需要的营养素。
在这28种氨基酸中,有9种(约32%)是必需由膳食中蛋白质的氨基酸直接供应的,它们在人体内不能由所摄取的蛋白质中的其他氨基酸来合成。它们是亮氨酸、异亮氨酸、缬氨酸、赖氨酸、蛋氨酸、色氨酸、苏氨酸、苯丙氨酸和组氨酸。其中组氨酸尚存在争论。一般认为对4岁以下的婴幼儿,组氨酸是必需氨基酸,较大年龄则自己能合成。非必需氨基酸并不是不重要,有时它们的重要性要胜过必需氨基酸。例如牛磺酸、精氨酸和谷氨酰胺,在某些疾病或应激条件下,它们非常重要,因此称条件性必需氨基酸。
甘氨酸是最小的氨基酸分子。它是很多重要的生化物质如蛋氨酸、胆碱、一些重要的激素、神经递质与脱氧核糖核酸的基本结构。
甘氨酸能预防肌肉退化,它能提供肌肉组织肌酸,并利用它来合成脱氧核糖核酸和核酸。甘氨酸是合成核酸、胆酸与体内其他非必需氨基酸的必需物质。它是很多抗胃酸药的原料。在皮肤与结缔组织中有高浓度的甘氨酸,它能修补损伤的组织和促进组织痊愈。
甘氨酸对维持中枢神经系统的功能和前列腺健康是必要的。它是神经传导的抑制剂,所以它能预防癫痫的发作,能抑制狂躁症与多动症。
体内甘氨酸过多,会导致疲劳,但如果适量则会觉得轻松有力。甘氨酸在体内能转变为丝氨酸。
二甲基甘氨酸 (DMG) 是甘氨酸的衍生物。在肉类、谷类与干果类中都有。服用 DMG能使身体维持在有力的状态下,精神能高度集中。DMG能促进身体的免疫系统,并能降低高胆固醇血和高脂血。它能改进体内氧的消耗,使体内血压及血糖正常化。它也能预防癫痫的发作。目前DMG已作为一种保健食品在国外市场上销售。
【甘氨酸及其代谢】
在营养上甘氨酸属于非必需氨基酸。首先可由其它氨基酸转变而产生:
①丝氨酸经丝氨酸羟甲基转移酶的催化生成甘氨酸及甲烯四氢叶酸;
②苏氨酸经苏氨酸醛缩酶的催化分解为甘氨酸及乙醛。在植物体内,甘氨酸全新合成可从6磷酸葡萄糖通过乙醛酸与谷氨酸的转氨基作用来完成。
甘氨酸除了构成蛋白质外,还参与合成多种重要的非蛋白质含氮物质,如血红蛋白、细胞色素等的卟啉环、嘌呤碱、甘氨胆酸及肌酸等。
肌酸的生物合成,首先在肾内经转脒基酶催化下,甘氨酸从精氨酸获得一个脒基,形成胍基乙酸及鸟氨酸。
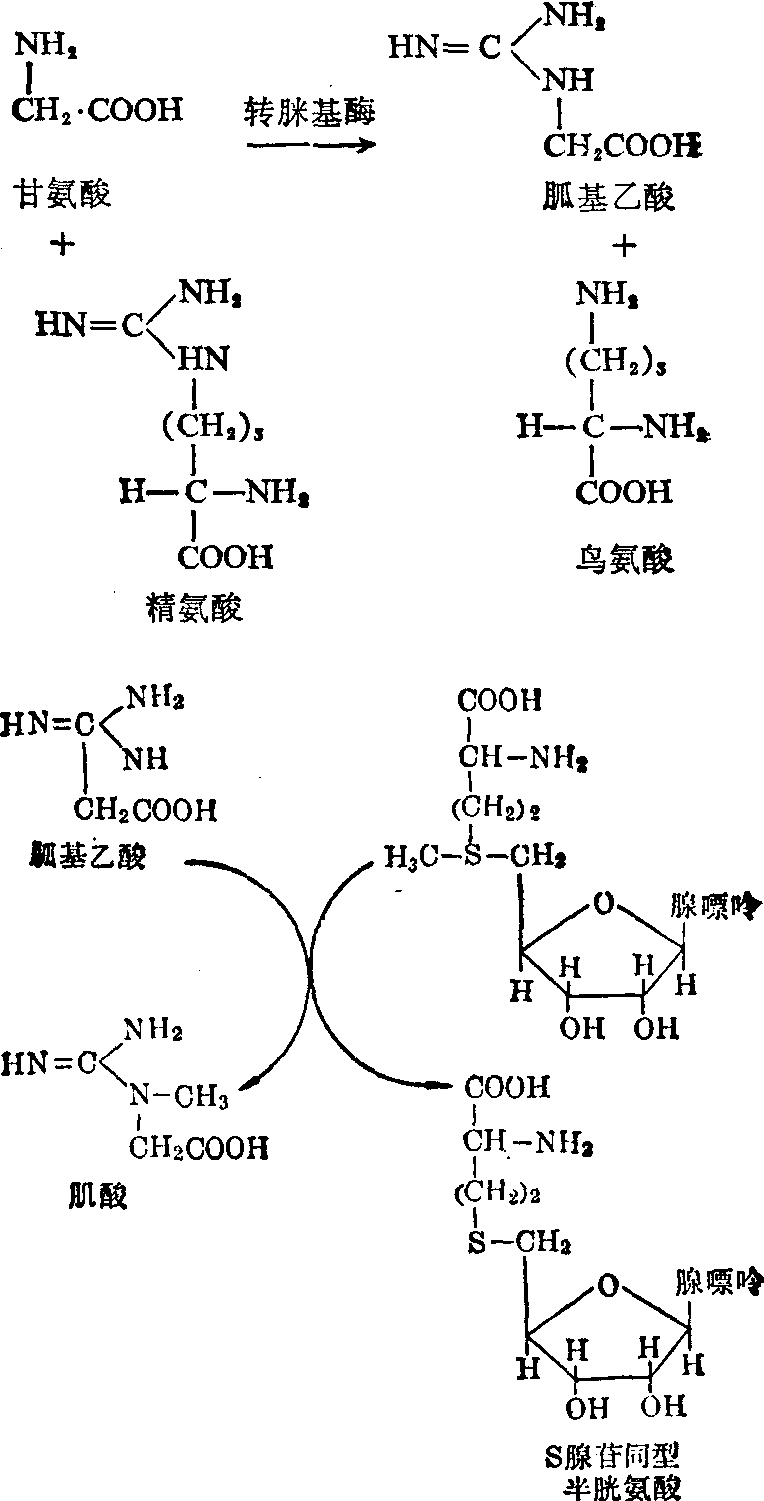
继之在肝内经转甲基酶催化,从S腺苷蛋氨酸转移一个甲基到胍基乙酸上,合成肌酸。肌酸多以磷酸肌酸的形式存在于肌肉中,储存能量,用以补充ATP的消耗,并以肌酸酐从尿中排出。
甘氨酸与甲烯四氢叶酸化合,可逆地再合成丝氨酸,从而进入糖异生的途径。甘氨酸是谷胱甘肽的组成成分。甘氨酸在肝脏内与胆酸合成为甘氨胆酸,增高胆酸的溶解性,以便由肝内排出,在肠道内发挥促进脂肪消化吸收的功能。甘氨酸还是一种解毒剂,能与苯甲酸结合为马尿酸,也能与阿司匹林(乙酰水杨酸)结合为甘氨水杨酸,以解除其毒性,并便利其从尿液内排出。
甘氨酸参与合成的非蛋白质含氮物质
非蛋白质含氮物 生理重要性
嘌呤碱 核酸的碱基
卟啉环 金属卟啉蛋白质的辅基
肌酸 以磷酸肌酸储存高能键
丝氨酸 组成蛋白质的氨基酸
谷胱甘肽 保护酶蛋白膜蛋白质的SH基
马尿酸 解毒作用
甘氨水杨酸 解毒作用
关于甘氨酸的分解代谢,动物的肝、肾内早已证明具有一种黄素蛋白,即甘氨酸氧化酶,能对甘氨酸起作用,将甘氨酸氧化脱氨形成乙醛酸,并放出NH3和H2O2,HCOOH,后者则可被激活,形成活性一碳单位,并以N10-甲酰四氢叶酸(见“一碳单位”条)为载体。最近在肝组织的线粒体内发现甘氨酸的裂解体系,其中需要磷酸参加,能将甘氨酸转化为CO2、氨及甲烯四氢叶酸。在病理情况下,乙醛酸可氧化成草酸,由尿液排出体外,也是形成肾结石的前体物质。
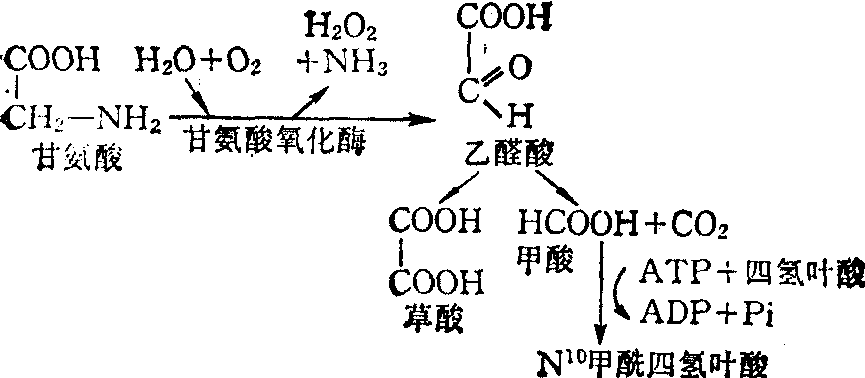
甘氨酸的氧化过程
【主要用途】
食品添加剂,在食品、清凉饮料等加工中,可起稳定作用,可单独使用或与谷氨酸钠、DL-丙氨酸和枸橼酸配合使用;用作甜味剂、pH调节剂、调味料、防氧化剂,也是我国GB2760—1996规定允许使用的食用香料;医药用作氨基酸制剂、解毒剂、金霉素缓冲剂、咪唑酸乙酯中间体、抗帕金森氏病药物、L-多巴(LDopa)的合成原料、二氧化碳吸收剂,电镀液添加剂、螯合剂等及苏氨酸的合成原料;农药用于制备非选择、无残留芽后除草剂草甘磷和杀虫剂异丙啶。
【制备方法】
1,蚕丝用6mol/l 盐酸在110~120℃下水解,然后进一步提纯,可制得甘氨酸成品。
2,以α-氯乙酸为原料,在50℃下,通入氨气进行反应,加热除去未反应的氨,然后用活性炭脱色,结晶、重结晶,可制得本品。本法除去氯化铵可用离子交换树脂。
3,甘氨酸钡盐法(即Strecker法)。以甲醛、氰化钠、氯化铵为原料,在冰醋酸中反应,生成N-亚甲基氨基乙腈,在乙醇溶液中,加入硫酸,生成氨基乙腈硫酸盐,进一步加入氢氧化钡,生成甘氨酸钡,分离后,加入硫酸,生成硫酸钡沉淀,过滤,除去沉淀,浓缩滤液,冷却析出甘氨酸的结晶,用吡啶洗涤后,再在水中重结晶,可得精制。
相关反应方程式如下:
2HCHO+NaCN+NH4Cl→H2C=NCH2CN+2H2O+NaCl
H2C=NCH2CN+H2SO4+2C2H5OH→H2NCH2CN·H2SO4+CH2(CH2OH)2
2H2NCH2CN·H2SO4+3Ba(OH)2→(H2NCH2COO)2Ba+2BaSO4+2NH3+2H2O
(H2NCH2COO)2Ba+H2SO4→H2NCH2COOHC2H5NO2+BaSO4
4,以碳酸氢铵与氰化钠反应,以甲叉氨基乙膊与氢溴酸反应。在装有搅拌器,温度计及两个加料斗的1000ml四口烧瓶中,加入定量的乌洛托品和水,搅拌在一个加料斗中装入94.5g (1mol)氯乙酸和45mol水配制的氯乙酸溶液。另一个加料斗中装入氨甲醇溶液(甲醇中通入氨气制成,氨含量12g/100ml),在45~50℃下同时滴加上述两种溶液,控制pH=8~9,2—2.5小时同时加气。换上回流冷凝器,慢慢升温,3小时升至65℃,恒温反应0.5~1.0小时。再降温至5~10℃,加入适量甲醇,搅拌1小时,过滤,用160—200ml甲醇洗涤滤饼两次,即得粗品。再接通常的方法将粗品精制,干燥,干燥,即得产品。过程中产生的母液按通常的方法回收甲醇和氯化铵。
【参考资料】
中国医学百科全书编辑委员会 编;张昌颖 主编.中国医学百科全书·十七 生物化学。
陈仁惇 编著.营养保健食品.北京:中国轻工业出版社.2001.第65-66-67。
袁运开,顾明远 主编.科学技术社会辞典·化学.杭州:浙江教育出版社.1992。
http://www.chemicalbook.com/ProductChemicalPropertiesCB5336487.htm
http://baike.baidu.com/view/513071.htm
http://zh.wikipedia.org/wiki/%E7%94%98%E6%B0%A8%E9%85%B8
