天然硼标准溶液
天然硼标准溶液
天然硼标准溶液 性质
| 熔点 | 2300°C |
|---|---|
| 沸点 | 2550°C |
| 密度 | 2.34 g/mL at 25 °C (lit.) |
| 堆积密度 | 200-300kg/m3 |
| 储存条件 | no restrictions. |
| 溶解度 | 可溶于水中 |
| 形态 | 片状 |
| 比重 | 2.34~2.37 |
| 颜色 | 深灰色 |
| PH值 | 4 (20°C in H2O) |
| Flame Color | Bright green |
| 电阻率 (resistivity) | 1.5E12 μΩ-cm, 20 °C |
| 水溶解性 | insoluble H2O [MER06] |
| 晶体结构 | Trigonal (rhombohedral) a = 1017 pm α = 65°12' hR105, R3m, β-B type |
| Merck | 13,1333 |
| 暴露限值 | ACGIH: TWA 2 mg/m3; STEL 6 mg/m3 |
| 稳定性 | 稳定的。要避免的物质包括强氧化剂和强酸。暴露在空气中可能分解-在氮气下储存。高度易燃。 |
| InChIKey | UORVGPXVDQYIDP-UHFFFAOYSA-N |
| CAS 数据库 | 7440-42-8(CAS DataBase Reference) |
| NIST化学物质信息 | Boron(7440-42-8) |
| EPA化学物质信息 | Boron (7440-42-8) |
天然硼标准溶液 用途与合成方法
硼由汉弗莱·戴维爵士和JL Gay-Lussac爵士于1808年发现。硼是一种三价非金属元素,广泛存在于蒸发矿砂,硼砂和方钠石中。硼从未作为地球上的游离元素被发现。硼以木炭灰色碎片或黑色粉末或结晶状出现。是一种非常硬的黑色材料,具有很高的熔点;并且以许多多态形式存在。
硼有几种形式,最常见的是无定形硼,一种深色粉末,对氧气,水,酸和碱不反应。它与金属反应形成硼化物。硼是植物必需的微量元素。硼酸钠在生化和化学实验室中用于制备缓冲液。硼酸主要由硼酸盐矿物与硫酸反应生成。硼酸是用于纺织品的重要化合物。硼在经济上最重要的化合物是十水合四硼酸钠或硼砂,用于绝缘玻璃纤维和过硼酸钠漂白剂。硼的化合物用于有机合成,制造特定类型的玻璃以及用作木材防腐剂。硼丝强度高,重量轻,因此用于先进的航空航天结构。
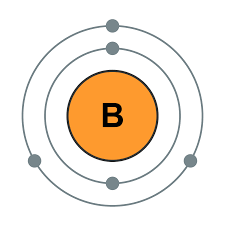
硼是元素周期表第2周期ⅢA族元素,化学符号B,原子序数5,相对原子质量10.811,外围电子排布式2s22p1,价电子数(3)少于价轨道数(4),是缺电子原子,可形成缺电子化合物。硼为非金属元素,天然存在的硼由两种稳定的同位素硼-10(丰度为19.78%)和硼-11(丰度为80.22%)组成。硼有无定形和结晶形两种单质,无定形硼为棕黑色或黑色粉末;结晶形硼为乌黑色或银灰色有光泽,硬度与金刚石相近。共价半径82pm,离子半径20pm,电离势800.0kJ/mol,电负性2.0,主要氧化数+3。无定形硼密度2.3g/cm3,晶形硼密度2.31g/cm3,熔点2300℃,沸点2550℃。晶态硼已知有八种同素异形体。单质硼晶体是由B-12正十二面体的基本结构单元组成的。结晶硼属于原子晶体,因此,结晶硼的硬度大,熔点、沸点高,化学性质不够活泼。

硼在自然界中总是以含氧化合物的形式存在,主要是硼酸及各种硼酸盐。硼酸含于某些温泉水中,各种硼酸盐中最为人们熟悉的是硼砂,此外在工业上重要的还有硼镁矿2MgO·B2O3·H2O和硼钙矿2CaO·3B2O3·5H2O。
公元前2000年古埃及、罗马、巴比伦人曾用硼砂生产玻璃和焊接黄金。硼的化学加工始于18世纪初,1702年霍姆贝(G.Homubbi)用天然硼砂矿与硫酸亚铁反应首先制得了硼酸,1808年英国化学家戴维(H.Davy)和法国化学家盖·吕萨克(J.L.Gay-Lus-sac)及泰勒尔(L.J.Thenard)几乎是同时用金属钾还原硼酸首先制得了元素硼,但所得硼纯度只有50%。1892年法国人穆瓦桑(H.Moissan)用金属镁还原硼酸酐制得纯度为98.3%的硼。1909年温得劳布(E.Weintnaub)用氢和三氯化硼混合气流在冷铜阳极的电弧上还原才制得纯度超过99%的高纯硼。
自从本世纪60年代合成出了一系列硼氢化合物开始,人们看到硼化学的前景,随后不仅对硼原子成键特点、硼单质和化合物的结构研究有较大的突破,而且研制出一系列在现代工业和国防中有重要应用价值的硼化合物,致使硼成为20年来无机化学领域内研究得最多的一种元素。
纳米硼粉是一种高能量的燃烧组分,元素硼的体积热值(140kj/cm3)和质量热值(59kg/g)远大于镁、铝等其他单分子含能材料,且硼粉是很好的 燃料,特别是纳米硼粉有较高的燃烧效率,因此将纳米硼粉添加到火炸药或推进剂中能显著提高含能材料体系的能量。
硼的地壳丰度为9×10-4%,海水中含硼48×10-5%。已发现约150多种硼矿,主要有硼砂矿、硼酸矿、硼酸盐矿、硅硼酸盐矿等。天然硼砂矿(Na2O·B2O3·10H2O) 主要产于干旱地区盐湖和干盐湖的蒸发沉积物及淤泥中,与石盐、天然碱、无水芒硝、钾芒硝、石膏等共生,在干旱地区还呈硼霜产于土壤表面;硼镁石(2MgO·B2O3·H2O),产于侵入体及镁质石灰岩或白云岩的接触带中,与硼镁铁矿等无水硼酸盐矿物、金云母、硅镁石等共生; 硼镁铁矿( (MgFe)2Fe (BO3)O2),产于蛇纹化石白云石大理岩或镁矽卡岩中,常与磁铁矿、硅镁石、透辉石、金云母等共生。此外,还有硬硼钙石 (2CaO·3B2O3·10H2O),碱性干盐湖往往沉积有硼酸盐矿。
世界硼酸盐储量约335~748Mt,资源分布很集中,仅美国和土耳其便占世界硼总储量的95%。中国青海、西藏和辽宁(营口、凤城、宽甸、集安)都有丰富的硼资源。
硼在玻璃搪瓷工业、航天航空工业、核工业、冶金工业等部门都有广泛的应用。硼纤维强度高(室温下断裂强度达2744~3430MPa)、弹性模量高(39200~411600MPa),是优良的增强材料。硼纤维与金属(铝、镁、钛等)、各种树脂(环氧树脂、聚胺等)和陶瓷制成的复合材料,是优良的高温结构材料。这种高温结构材料用于军事工业和航天航空工业,如硼纤维增强铝基复合材料、硼纤维增强钛基复合材料用于制造航空发动机的压气叶片、风扇和飞机、卫星的耐热部件。硼化钛颗粒增强体陶瓷具有优良的耐磨性和高的韧性(可达10MPa·m1/2以上),被用来制造加热设备和点火装置的电导部件和超高温工作条件下的耐磨结构件。硼化锆陶瓷用于火箭喷管和高温发热元件。硼是热中子堆理想的控制材料,天然硼具有足够大的中子吸收截面,可直接用作反应堆控制材料。10B(n,a)7Li反应的热中子吸收截面大,可用作反应堆的中子吸收剂和屏蔽材料。硼钢、碳化硼、硼硅玻璃等以棒材、板材或水溶液等形式用作各种反应堆的控制材料。10BF3用于制作中子计数器。硼在高温下性质特别活泼,容易与氮、氧作用,在冶金工业中用作除气剂和改善金属晶粒结构的添加剂。硼铁、硼硅、硼铝、硼镍等广泛用于炼制合金结构钢、弹簧钢、低合金高强度钢、耐热钢、不锈钢等。硼可提高铸铁的韧性、耐磨性,含硼铸铁广泛用于汽车、拖拉机、机床等制造业。元素硼还用作烯族有机物的聚合、脱氢反应的催化剂,硼化镧陶瓷用作电子装置的阴极材料,单晶LaB6用作场致发射体的大功率管、磁控管的阴极材料。硼酸锂单晶用于制造远红外、可见光及紫外波段高功率脉冲激光的倍频、和频、参量振荡和放大器以及腔内倍频器。
工业上有4种制取元素硼的方法,它们是卤化物氢还原法、金属热还原法、熔盐电解法和热分解法。
(1)卤化物氢还原法。使氢和三氯化硼的混合气流在热的钽丝或钨丝上分解沉积出晶形硼,反应为:2BCl3+3H2→2B+6HCl。
此法可得到纯度高达99.999%的高纯硼。
(2)金属热还原法。原料有硼酸、硼氧化物、氟硼酸盐、氢硼化物,还原剂可采用金属锂、铍、钠、镁、铝、钾、钙、铁、锌、汞以及半金属硅。较多采用镁还原硼酸,其反应为:2HBO3+5Mg→2B+5MgO+H2O。
(3)熔盐电解法。有3种熔盐体系:a.B2O3+KCl体系;b.KBF4-KCl体系;c.KBF4-KF-KCl体系或KBF4-KCl-NaCl体系。电解时采用碳化硼阳极,产品元素硼纯度较低,一般在87%~99.8%水平。
(4)热分解法。还原原料限于卤硼化物和氢硼化物,如溴化硼、碘化硼、乙硼烷等,分解温度在1073~1773K范围。此法可获较高纯度的硼。
硼在动物和人类中的营养重要性已得到广泛研究。越来越多的证据表明硼可能是动物和人类必不可少的元素。许多营养学家认为,饮食中更多硼的摄入会给身体(例如中枢)状况带来益处。硼对人类的不良健康影响是有限的。但是,摄入/吸入会引起粘膜刺激和硼中毒。已知短期在工作区接触硼会刺激眼睛,上呼吸道和鼻咽,但随着进一步接触的停止,刺激会消失。短时间内摄入大量硼(约30g硼酸)会影响胃,肠,肝,肾。
硼单质有无定形和结晶形两种,前者为棕黑色到黑色粉末,后者呈乌黑色到银灰色,并有金属光泽,无定形硼相对密度为2.3,晶态硼具有由多个硼原子组成的各种多面体的基本结构单元 (如B12二十面体),是原子晶体。熔点约为2300℃,沸点为2550℃,相对密度为2.34,硬度仅次于金刚石,较脆。在室温下无定形硼在空气中缓慢氧化,在800℃左右时能自燃。硼与盐酸或氢氟酸即使长期煮沸也不起作用,它能被热浓硝酸和重铬酸钠与硫酸的混合物缓慢侵蚀和氧化,过氧化氢和过硫酸铵也能缓慢氧化结晶硼。这些试剂与无定形硼作用激烈; 与碱金属碳酸盐和氢氧化物混合物共熔时,所有各种形态的硼都被完全氧化; 氟、氯、溴与硼作用形成相应的卤化硼; 约在600℃时硼与硫激烈反应生成一种硫化硼的混合物; 硼在氮或氨气中加热到1000℃以上时则形成氮化硼; 温度在1800~2000℃时硼和氢仍不发生反应; 硼与硅在2000℃以上时反应生成硼化硅; 高温时硼能与许多金属和金属氧化物反应,生成金属硼化物。由于硼在高温时特别活泼,因此冶金上用做铁、锰和其他金属的合金剂、钢和铜的脱氧剂,也用于锻铁的热处理,增加合金钢高温强固性。硼还用于原子反应堆和高温技术中,棒状和条状的硼钢在原子反应堆中广泛用做控制棒。由于硼具有低密度、高强度和高熔点等性质,可用来制作导弹和火箭中所用的某些结构材料。硼的化合物在农业、医药、玻璃工业等方面用途也很广泛。它是植物生长必需的微量营养元素。用活泼金属高温还原硼的氧化物,用氢还原硼的卤化物,用碳热还原硼砂,热分解硼氢化合物以及电解熔融硼酸盐或其他含硼化合物等都可制得单质硼,用这些方法所得的粗产品均应经真空除气或控制卤化,才可能得到高纯硼。
无定形硼的化学性质比较活泼,室温时在空气中缓慢氧化,700℃以上能燃烧,生成氧化硼B2O3并放出大量的热,常温下跟氟化合生成三氟化硼BF3,加热时跟氯、溴、硫等化合,高温时还与碳、氮或氨反应,分别得到硬度很大的碳化硼B4C、氮化硼(BN);加热时跟水蒸气反应生成氢氧化硼并放出氢气,2B+6H2O=2B(OH)3+2H2。硼和氧的亲和力很强,它能从许多金属氧化物或非金属氧化物中夺取氧,所以硼可做还原剂。硼跟某些金属化合生成金属硼化物。硼很难和氢化合。硼不跟盐酸和氢氟酸反应。但可被浓硫酸或浓硝酸氧化:(1)B+2HNO3=H3BO3+2N2O (2)2B+3H2SO4=2H3BO3+2NO2。
硼跟氢氧化钠溶液反应生成偏硼酸钠并放出氢气:2B+2NaOH+2H2O=2NaBO2+3H2。
硼跟硅在2000℃以上时反应生成硼化硅。过氧化氢或过硫酸铵能缓慢氧化结晶硼,热浓硝酸和重铬酸钠与硫酸的混合物也能缓慢地氧化晶态硼。上述试剂跟无定形硼反应激烈。跟碱金属碳酸盐和氢氧化物混合共熔时,各种形态的硼都能被完全氧化。由于硼在高温时化性很活泼,因此被用做冶金时的除气剂,煅铁热处理时,硼能增加合金钢的高温强固性。因硼有吸收中子的特性,棒状或条状硼钠在原子反应堆中用做控制棒,由于硼有低密度、高强度和高熔点等特性,可用来制导弹和火箭的结构材料。制发动机启动装置和变压器热断电器。热电偶中也用到硼。用硼、钴、钛、镍可制成耐高温超硬质金属陶瓷。硼在自然界中丰度不大,没有游离态,主要矿物有硼砂和硼镁矿。1808年,英国戴维和法国的盖吕萨克、泰纳、用钾还原硼酸制得硼。通常将三氧化二硼及卤化硼用氢气或活泼金属还原:3Mg+B2O3=3MgO=2B。
将氢气和三溴化硼或三氯化硼的混合气体通过1200~1400℃的钨丝或钽丝可得到硼:2BBr3(气)+2H2=(1200-1400)=2B+6HBr(气)。
电解熔融的KBF4,可以得到更纯的硼。
2Na+H2→2NaH
6NaH+8BF3·(C2H5)2O→6NaBF4+B2H6+8(C2H5)O
B2H6→2B+3H2
2BCl3+31-12→2B+6HCl
2BC13+3H2→2B+6HCI
Na2B4O7+4Al→4B+Na2Al2O4+A12O3
安全信息
| 危险品标志 | Xn,F |
|---|---|
| 危险类别码 | 22-11-63-62 |
| 安全说明 | 16-24/25-45-36/37/39-27-26 |
| 危险品运输编号 | UN 3178 4.1/PG 2 |
| WGK Germany | - |
| RTECS号 | ED7350000 |
| 自燃温度 | 700°C |
| TSCA | Yes |
| 危险等级 | 4.1 |
| 包装类别 | III |
| 海关编码 | 28045000 |
| 毒害物质数据 | 7440-42-8(Hazardous Substances Data) |
MSDS信息
天然硼标准溶液 化学药品说明书
天然硼标准溶液 价格(试剂级)
| 更新日期 | 产品编号 | 产品名称 | CAS号 | 包装 | 价格 |
|---|---|---|---|---|---|
| 2025-02-08 | XW74404287 | 硼粉 | 7440-42-8 | 250G | 1759 |
| 2025-02-08 | XW74404286 | 硼粉 | 7440-42-8 | 50G | 428 |

