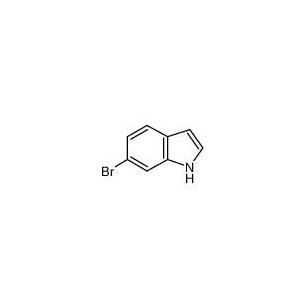
关于6-溴吲哚的合成及应用
发布日期:2024/9/30 9:29:23
吲哚类化合物是由一个氮原子取代吡咯环上的碳原子的吡咯与苯并联的化合物,作为重要的含氮杂环类化合物之一,吲哚类化合物独特的骨架结构成为该类化合物的优点。6-溴吲哚作为重要的吲哚类化合物之一,拥有良好的杀菌抗虫抗病作用,是众多农药分子的核心骨架,在植物病虫害防治领域有着重要的应用,加上其高效、绿色、低毒的特性,已经得到广泛的研究。

合成方法
方法一:氮气保护下,加入原料6-溴-2-吲哚酮0.5mmol、频哪醇硼烷1.2mmol和催化剂Y[N(SiMe3)2]3 0.05mmol,甲苯3mL,120℃反应36h,产物分离收率90%[1]。
方法二:在DMF(110 mL)溶液中加入4-溴-2-硝基甲苯(14.0g,65.0mmol)和N,N-二甲基甲酰胺二甲基缩醛(17.3mL,130mmol)和吡咯烷(5.4mL,65mmol)。油浴加热至105~110℃ 21h,得到鲜红色溶液冷却至室温,用乙醚(400mL)稀释,用H2O(4×150mL)提取。结合水层用乙醚(100mL)再次萃取。合并的有机层在真空中浓缩成一种红色的油,在静置时结晶。将红色固体放入80%的HOAc(500mL)中,在油浴中加热至70℃。将锌粉(80g,1.2mol)分四份加入1h,加热至85~90℃ 2h,冷却过滤。滤液用乙醚(4×150mL)提取,用饱和NaHCO3(6×200mL)、盐水(3×100mL)洗涤,用MgSO4干燥,蒸发得到绿色固体粗品。快速色谱法(己烷/DCM(1:1))得到6-溴吲哚为浅蓝色固体(8.43g,65%)。己烷重结晶得到6-溴吲哚纯品(6.59g,51%)为白色固体[2]。
应用
1、专利CN202110254550.6关于苯并杂环取代的菲啶季铵盐类衍生物及其制备方法和应用中,实施例1取6-溴吲哚(1.5g,7.65mmol)溶于DMF中,N2保护下,0℃加入NaH(0.37g,9.25mmol),搅拌30min后加入碘甲烷(15.3mmol),转移至室温搅拌2h,TLC检测反应完全。反应液加乙酸乙酯,有机相用饱和NH4Cl溶液洗三次,饱和NaCl溶液洗三次,无水硫酸镁干燥。减压旋干,制砂。硅胶柱层析(洗脱剂纯PE),得6-溴-1-甲基-1H-吲哚为无色油状物,收率93.1%[3]。
2、专利CN202111298424.7一种杂环酮类化合物与其组合物及其制备方法和应用中,实施例16化合物I-16的合成中,对于步骤一中的中间体A-016的合成如下:将6-溴吲哚(1eq)溶于无水DMSO(0.7M) 中,置于0℃低温反应浴中。分批少量加入叔丁醇钾(1.2eq),搅拌30min,0℃缓慢滴加2-(溴甲基)-1,3-二甲苯(1.2eq),反应瓶移至室温,搅拌4h。点板监测反应完全后,乙酸乙酯萃取反应液,合并有机相,饱和食盐水洗,无水硫酸钠干燥。抽滤,浓缩,柱层析纯化,得白色固体6-溴-1-(2,6-二甲基苄基) -1H-吲唑(中间体A-016),收率54%[4]。
3、专利CN202110281530.8关于一种γ-咔啉衍生物的合成方法中,实施例4合成化合物(4-1),在25mL反应瓶中加入6-溴吲哚(5mmol) 、DMF(10mL)以及NaH(5mmol)。反应混合物在0℃下搅拌10分钟,再加入2-氯嘧啶(6mmol),然后升到室温至130℃反应,TLC检测至反应完全。进行后处理提纯:加入水(20mL)淬灭,用EA(20mLX3)萃取,合并有机相,用饱和NaCl(20mLX2)洗涤。分液后用无水硫酸镁干燥,减压除去有机溶剂,用硅胶柱层析分离纯化[V(石油醚):V(乙酸乙酯)=15:1],即得到纯净的产物,白色固体,产率:78%[5]。
参考文献
[1]温州医科大学. 稀土硅胺化物作为催化剂在制备吲哚或吲哚衍生物中的应用:CN201911019734.3[P]. 2021-03-02.
[2]P. Scott Wiens;Jerry L. Johnson;Gordon W. Gribble;. (2021). Concerning the preparation of 6-bromotryptamine . Tetrahedron, (), –. doi:10.1016/j.tet.2021.132055
[3]山东大学. 苯并杂环取代的菲啶季铵盐类衍生物及其制备方法和应用:CN202110254550.6[P]. 2021-06-11.
[4]中国药科大学. 一种杂环酮类化合物与其组合物及其制备方法和应用:CN202111298424.7[P]. 2022-02-08.
[5]江汉大学. 一种γ-咔啉衍生物的合成方法:CN202110281530.8[P]. 2021-06-18.
欢迎您浏览更多关于6-溴吲哚的相关新闻资讯信息