SK LU 1的应用
发布日期:2023/5/24 10:58:11
背景[1-3]
SK LU 1细胞来源于一位60岁患有腺癌疾病的女性高加索人的肺组织。
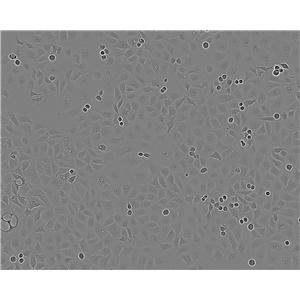
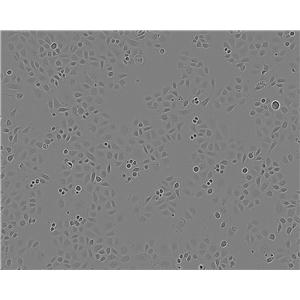
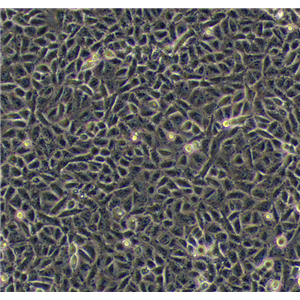
SK LU 1细胞
细胞特性:
1)来源:肺;
2)形态:上皮细胞样,贴壁生长;
3)含量:>1x10^6细胞数;
4) 规格:T25瓶或者1mL冻存管包装。
一.SK LU 1培养基及培养冻存条件准备:
1)准备MEM(推荐iCell-0012)培养基;优质胎牛血清10%;双抗1%。
2)SK LU 1培养条件:气相:空气,95%;二氧化碳,5%。温度:37摄氏度,培养箱湿度为70%-80%。
3)SK LU 1冻存液:90%血清,10%DMSO,现用现配。
二.SK LU 1细胞处理:
1)冻存SK LU 1细胞的复苏:
将含有1mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,加入到含4-6mL完全培养基的离心管中混合均匀。在1000RPM条件下离心3-5min,弃去上清液,完全培养基重悬细胞。然后将细胞悬液加入含6-8ml完全培养基的培养瓶(或皿)中37℃培养过夜。第二天显微镜下观察细胞生长情况和细胞密度。
2)SK LU 1细胞传代:如果细胞密度达80%-90%,即可进行传代培养。
对于贴壁SK LU 1细胞传代可以参考以下方法:
1.弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
2.加入0.25%(w/v)胰蛋白酶-0.53 mM EDTA于培养瓶中(T25瓶1-2mL,T75瓶2-3mL),置于37℃培养箱中消化1-2分钟(难消化的细胞可以适当延长消化时间),然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加入3-4ml含10%FBS的培养基来终止消化。
3.轻轻打匀后吸出,在1000RPM条件下离心3-5min,弃去上清液,补加1-2mL培养液后吹匀。将细胞悬液按1:2的比例分到新T25瓶中,添加6-8ml按照说明书要求配置的新的完全培养基以保持细胞的生长活力,后续传代根据实际情况按1:2~1:5的比例进行。
3)SK LU 1细胞冻存:收到细胞后建议在培养前3代时冻存一批细胞种子以备后续实验使用。
下面T25瓶为例;
1.细胞冻存时按照细胞传代的过程收集消化好的细胞到离心管中,可使用血球计数板计数,来决定细胞的冻存密度。一般细胞的推荐冻存密度为1×10^6~1×107个活细胞/ml.
2.1000rpm离心3-5min,去掉上清。用配制好的细胞冻存液重悬细胞,按每1ml冻存液含1×10^6~1×107个活细胞/ml分配到一个冻存管中将细胞分配到冻存管中,标注好名称、代数、日期等信息。
3.将要冻存的细胞置于程序降温盒中,-80度冰箱中过夜,之后转入液氮容器中储存。
应用[4][5]
SK LU 1可以用于多通道鞘流二维光散射流式细胞术及其在肺癌检测中的应用研究
目前,肺癌诊断主要依靠组织活检,该方法对医师经验要求高,取材和染色步骤复杂,且具有一定的主观性。常规技术对小细胞与非小细胞肺癌的分类存在一定的分歧。研发一种新型的肺癌诊断方法具有重要的医学价值。无标记二维光散射技术在细胞分析领域具有独特优势,该技术与流式技术相结合可用于单细胞高通量分析。
随着微加工技术的发展,小型化微流体细胞仪成为流式细胞仪发展的重要方向。为进一步提高流式测量通量,实现并行检测目的,多通道流式细胞仪逐渐引起人们的兴趣。二维光散射技术与多通道鞘流技术相结合预期可实现肺癌高通量无标记检测。
通过光片技术,多通道三维水动力聚焦技术,以及无标记二维光散射技术的有机集成,构建了多通道鞘流二维光散射流式细胞术装置,该装置主要包含光片生成模块、多通道三维水动力聚焦模块和散射图样采集与处理模块。光片生成模块将纺锤形截面的激光压缩成片状光束;多通道三维水动力聚焦模块同时形成多个相互独立的聚焦流,提高检测通量;散射图样采集与处理模块采集颗粒或细胞的二维光散射图样并进行分析处理。
然后,利用该装置采集了小细胞肺癌细胞系(H69)细胞和人低分化肺腺癌细胞系(SK-LU-1)细胞的二维光散射图样。借助灰度共生矩阵提取的四个特征,论文通过SVM分类器实现了该两类肺癌细胞的自动化分类识别,分类准确率达92.75%。本文研究结果表明,多通道鞘流二维光散射流式细胞术具有无标记、高通量等优势,预期可为肺癌以及其他癌症诊断提供一种新型的检测方法。
参考文献
[1]Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].Freddie Bray BSc,MSc,PhD;;Jacques Ferlay ME;;Isabelle Soerjomataram MD,MSc,PhD;;Rebecca L.Siegel MPH;;Lindsey A.Torre MSPH;;Ahmedin Jemal PhD,DVM.CA:A Cancer Journal for Clinicians,2018(6)
[2]Review and perspectives on microfluidic flow cytometers[J].Ruey-Jen Yang;;Lung-Ming Fu;;Hui-Hsiung Hou.Sensors&Actuators:B.Chemical,2018
[3]Changing cancer survival in China during 2003–15:a pooled analysis of 17 population-based cancer registries[J].Hongmei Zeng;;Wanqing Chen;;Rongshou Zheng;;Siwei Zhang;;John S Ji;;Xiaonong Zou;;Changfa Xia;;Kexin Sun;;Zhixun Yang;;He Li;;Ning Wang;;Renqiang Han;;Shuzheng Liu;;Huizhang Li;;Huijuan Mu;;Yutong He;;Yanjun Xu;;Zhentao Fu;;Yan Zhou;;Jie Jiang;;Yanlei Yang;;Jianguo Chen;;Kuangrong Wei;;Dongmei Fan;;Jian Wang;;Fangxian Fu;;Deli Zhao;;Guohui Song;;Jianshun Chen;;Chunxiao Jiang;;Xin Zhou;;Xiaoping Gu;;Feng Jin;;Qilong Li;;Yanhua Li;;Tonghao Wu;;Chunhua Yan;;Jianmei Dong;;Zhaolai Hua;;Peter Baade;;Freddie Bray.The Lancet Global Health,2018(5)
[4]Global surveillance of trends in cancer survival 2000–14(CONCORD-3):analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries[J].Claudia Allemani;;Tomohiro Matsuda;;Veronica Di Carlo;;Rhea Harewood;;Melissa Matz;;Maja Nik?i?;;Audrey Bonaventure;;Mikhail Valkov;;Christopher J Johnson;;Jacques Estève;;Olufemi J Ogunbiyi;;Gulnar Azevedo e Silva;;Wan-Qing Chen;;Sultan Eser;;Gerda Engholm;;Charles A Stiller;;Alain Monnereau;;Ryan R Woods;;Otto Visser;;Gek Hsiang Lim;;Joanne Aitken;;Hannah K Weir;;Michel P Coleman;;S Bouzbid;;M Hamdi-Chérif;;Z Zaidi;;K Meguenni;;D Regagba;;S Bayo;;T Cheick Bougadari;;S S Manraj;;K Bendahhou;;A Fabowale;;D.The Lancet,2018(1012)
[5]张淑雨.多通道鞘流二维光散射流式细胞术及其在肺癌检测中的应用研究[D].山东大学,2020.
欢迎您浏览更多关于SK LU 1的相关新闻资讯信息