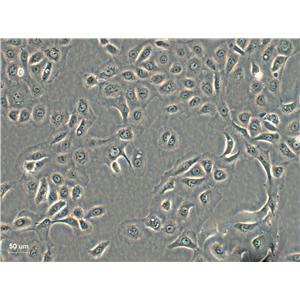
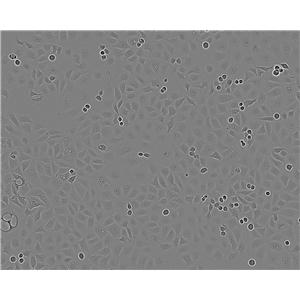
T84 人结肠腺癌肺转移细胞系的应用
发布日期:2023/5/24 10:57:13
背景[1-3]
T84人结肠腺癌肺转移细胞系是从一位72岁男性结肠癌患者的肺转移灶建立的可移植人类癌细胞株;肿瘤组织皮下接种于BALB/c裸鼠,并连续进行移植。在裸鼠身上的移植过程中,细胞株始终保持结肠癌的原始组织性状。在无胸腺小鼠中传代23代后建立了T84细胞。T84细胞单层生长到饱和并在接触细胞间展现出紧密连接和桥粒,有很多关于多肽类激素和神经递质并维持定向电解质传输的受体。T84细胞展现了接触细胞中的紧密连接和桥粒,角蛋白免疫过氧化物酶染色阳性。
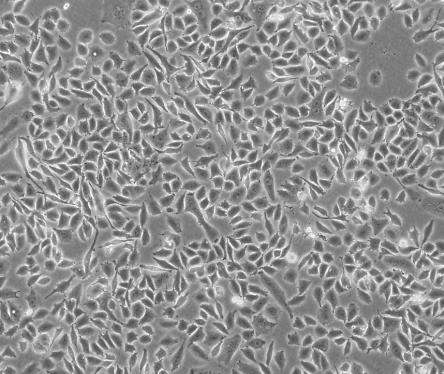
T84人结肠腺癌肺转移细胞系
T84人结肠腺癌肺转移细胞系细胞培养操作
1.冻存T84人结肠腺癌肺转移细胞系细胞的复苏
1.1在超净台中取配好的T84人结肠腺癌肺转移细胞系培养液5ml到15ml离心管中放至室温备用。
1.2快速将干冰或液氮保存的细胞株,放入37℃的水浴锅后不停晃动冻存管,使其解冻并达到37℃,此过程尽量保持在3分钟内完成。(备注:此处注意,管身或管内的液氮挥发完后才可放入,否则有炸裂风险)
1.3将化冻的细胞液快速转移至上述准备好培养基中,1000rpm、4min离心收集细胞并传代,传代方法如下:
2.T84人结肠腺癌肺转移细胞系细胞传代处理
2.1待长满瓶底至80%以上时,贴壁细胞弃掉培养瓶中的培养基,用1X PBS洗两遍。
2.2加1mL 0.25%的胰酶溶液,置于37℃培养箱中消化2-3分钟,直至看到有细胞从瓶底上脱落分离。
2.3加入2mLT84人结肠腺癌肺转移细胞系培养基终止消化,轻轻吹打将所有细胞从培养瓶表面吹落并转移到离心管中,1000rpm、4min离心收集细胞。
2.4收集好的细胞用T84人结肠腺癌肺转移细胞系培养基重悬,并轻轻吹打悬浮,若无特别说明,就按1:2~1:3的比例铺新的培养瓶,放进培养箱继续培养(每个细胞培养条件不同,大部分细胞5%CO2、37℃恒温培养)。
3.T84人结肠腺癌肺转移细胞系细胞冻存处理
3.1收集方法同上,
3.2收集好的细胞用细胞冻存液(若无特殊说明,一般细胞冻存液成分为:10%血清+80%培养基+10%DMSO)悬浮,并按4℃、1h,-20℃、30min,-80℃过夜,液氮长期的温度梯度进行保存。
应用[4][5]
T84人结肠腺癌肺转移细胞系可以用于细菌鞭毛蛋白增加T84细胞单层通透性的作用机制研究
在Transwell细胞跨膜培养系统中培养T84细胞单层(T84monolayer)模拟肠上皮屏障,通过对细菌鞭毛蛋白处理前后极化T84细胞单层的跨上皮电阻(Transepithelial electric resistance,TER)及对大分子物质辣根过氧化物酶(Horseradish peroxidase,HRP)流量的检测,研究细菌鞭毛蛋白对T84细胞单层通透性的影响,进而探讨鞭毛蛋白与肠道屏障关系。
方法1.本实验采用T84细胞单层。为了评估T84细胞单层转运鞭毛蛋白及鞭毛蛋白对T84细胞单层通透性的影响,我们将细菌鞭毛蛋白及HRP加入到细胞跨膜培养系统肠腔侧中。采用酶联免疫吸附测定(Enzyme-linked immuneassay,ELISA)的方法检测基底侧样本中的鞭毛蛋白、HRP。HRP流量及T84细胞单层TER作为评价T84细胞单层的通透性指标。人肥大细胞系(Human mast cell line,HMC-1)来源于人肥大细胞白血病细胞,激活后具有肥大细胞特性,与T84细胞共培养于细胞跨膜培养系统中。
2. 不同浓度细菌鞭毛蛋白加入细胞培养系统肠腔侧与T84细胞共同孵育。2小时后测量TER及HRP流量来评价细菌鞭毛蛋白对肠上皮细胞系T84细胞单层的屏障功能的影响。
3. 细胞跨膜培养系统随机分为正常对照组、鞭毛蛋白组、HMC-1组、鞭毛蛋白+HMC-1组及酮替芬干预组并给予相应处理。共培养2小时后,测量各组TER及HRP流量。收集正常对照组、HMC-1组、鞭毛蛋白+HMC-1组和酮替芬干预组基底侧细胞上清液用ELISA方法检测组胺及类胰蛋白酶β2(Mast cell tryptase,MCT),从而评价不同处理组对肠上皮细胞系T84细胞单层的屏障功能的影响。
4. 为了观察T84细胞摄取鞭毛蛋白,细胞培养板中培养T84细胞,把细菌鞭毛蛋白按不同剂量加入到细胞培养系统中,37℃孵育。2小时后收集细胞培养板中T84细胞,用免疫细胞化学的方法检测胞浆内鞭毛蛋白。为了观察T84细胞单层转运鞭毛蛋白,将T84细胞培养在细胞跨膜培养系统中,在肠腔侧中加入鞭毛蛋白,2h后收集基底侧中培养基,用ELISA方法检测鞭毛蛋白。
5.所有实验结果经SPSS17.0统计软件分析,计量数据均采用均数±标准差描述,用Shapiro-Wilk检验方法进行正态性分析,Levene检验方法进行方差齐性分析,多组数据的比较用单因素方差分析(One-way ANOVA),对多组数据比较有统计学意义的再进行两两比较(LSD-t检验)。两组数据的比较采用两独立样本的t检验,相关性分析用Spearman秩相关。检验水准α=0.05,当P<0.05时认为差异具有统计学意义。
结果1.不同浓度鞭毛蛋白加入跨膜培养系统肠腔侧,其相对TER(comparative TER)变化为:当鞭毛蛋白浓度小于8mg/L时,增加肠腔侧鞭毛蛋白浓度,不引起上皮细胞跨膜电阻的下降。但当鞭毛蛋白浓度大于8mg/L时,随着鞭毛蛋白浓度增加,跨膜电阻逐渐下降,与正常对照组及小浓度鞭毛蛋白组比较,差异有统计学意义(F=2536.68,P<0.05)。不同浓度鞭毛蛋白加入跨膜培养系统肠腔侧,HRP流量变化如下:当鞭毛蛋白浓度小于8mg/L时,增加肠腔侧鞭毛蛋白浓度,不引起HRP流量的增加。但当鞭毛蛋白浓度大于8mg/L时,随着鞭毛蛋白浓度增加,HRP流量逐渐增加,与正常对照组及小浓度鞭毛蛋白组比较,差异有统计学意义(F=872.05,P<0.05)。
2. 各组处理对肠上皮细胞系T84细胞单层的屏障功能影响结果比较:①正常对照组与HMC-1组TER和HRP流量较处理前无明显变化,两组比较差异无统计学意义(P>0.05)。
②鞭毛蛋白组comparative TER值为(59.73±7.00)%较正常对照组明显降低(P<0.05)。同时鞭毛蛋白组的T84细胞单层HRP流量结果(0.08±0.01)%与正常对照组相比较有明显差异(P<0.05)。
③鞭毛蛋白+HMC-1组comparative TER值为(39.35±0.81)%,较鞭毛蛋白组降低(P<0.05)。同时鞭毛蛋白+HMC-1组的T84细胞单层HRP流量结果(0.27±0.03)%与鞭毛蛋白组相比有明显差异(P<0.05)。
④酮替芬干预组comparative TER值为(45.25±3.64)%,较鞭毛蛋白+HMC-1组明显升高(P<0.05)。同时酮替芬干预组的T84细胞单层HRP流量结果(0.19±0.04)%与鞭毛蛋白+HMC-1组相比有明显差异(P<0.05)。
3.光学显微镜下观察免疫细胞化学结果:鞭毛蛋白孵育过的T84细胞(鞭毛蛋白组)细胞质被染成棕褐色,而正常生长T84细胞(阴性对照组)细胞质为淡蓝色。
参考文献
[1]For the Assessment of Intestinal Permeability,Size Matters[J].Vojdani,Aristo.Alternative Therapies in Health and Medicine,2013(1)
[2]Interleukin 23 Production by Intestinal CD103+CD11b+Dendritic Cells in Response to Bacterial Flagellin Enhances Mucosal Innate Immune Defense[J].Melissa A.Kinnebrew;;Charlie G.Buffie;;Gretchen E.Diehl;;Lauren A.Zenewicz;;Ingrid Leiner;;Tobias M.Hohl;;Richard A.Flavell;;Dan R.Littman;;Eric G.Pamer.Immunity,2012(2)
[3]Crohn's disease[J].Daniel C Baumgart;;William J Sandborn.The Lancet,2012(9853)
[4]Ulcerative colitis[J].Ingrid Ordás;;Lars Eckmann;;Mark Talamini;;Daniel C Baumgart;;William J Sandborn.The Lancet,2012(9853)
[5]杨万荷.细菌鞭毛蛋白增加T84细胞单层通透性的作用机制研究[D].郑州大学,2013.
欢迎您浏览更多关于T84 人结肠腺癌肺转移细胞系的相关新闻资讯信息