6-羟基-4-嘧啶甲酸的制备及其应用
发布日期:2022/11/1 10:14:19
简介
6-羟基-4-嘧啶甲酸的CAS号是6299-87-2,分子式是C5H4N2O3,分子量是140.1。熔点是268-270°C,沸点是305.2±52.0°C(Predicted),密度是1.63±0.1g/cm3,以及酸度系数(pKa)是2.77±0.20(Predicted)。
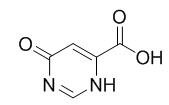
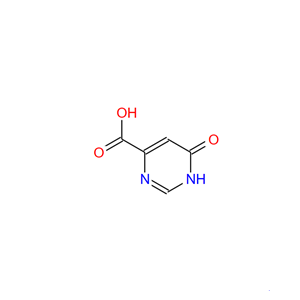
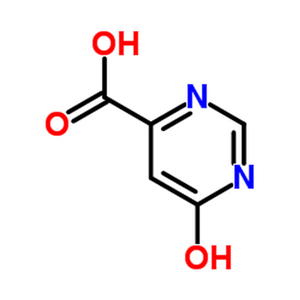
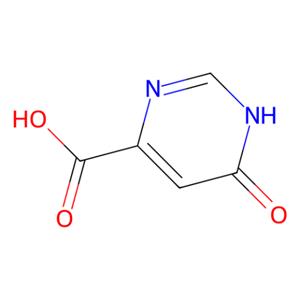
图1 6-羟基-4-嘧啶甲酸的结构式。
合成
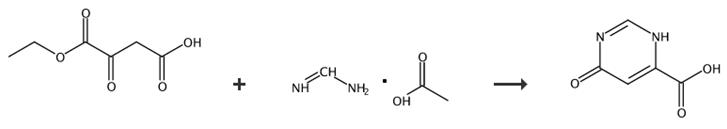
图2 6-羟基-4-嘧啶甲酸的合成路线[1-3]。
方法一:在1 L圆底烧瓶中,向500 mL水中的氢氧化钠溶液(10 g)中添加55 g乙基草酸钠(1.05 eq,0.26 mol)和26 g乙酸甲脒(1 eq,0.25 mol)。将反应混合物在室温下搅拌16小时。小心地将浓缩HCl添加到混合物中,直到pH=1,细固体沉淀,并在0°C下搅拌反应混合物1小时。过滤固体,然后用水和乙醚清洗。然后将白色固体留在40°C加热的真空炉中20小时。甲醇中的三饱和反应使标题化合物6-羟基-4-嘧啶甲酸的产率达到25%。核磁共振氢谱(d6 DMSO):12.88(1H,OH),8.24(s,1H),6.83(s,2H)。合成路线如图2所示。
方法二:将63.5 g(287 mmol)草酸二乙酯钠和30.2 g(288 mmol)乙酸甲脒添加到3.6 L水中24.1 g(0.597 mol)NaOH中。将混合物在室温下搅拌过夜。然后添加活性炭,并将混合物回流1小时。混合物在加热和冷却后过滤,用含水HCl酸化。将溶液旋转蒸发至干燥。残留物含有所需的产品6-羟基-4-嘧啶甲酸,在下一步中使用,无需进一步纯化。产量:83.0克。合成路线如图2所示。
方法三:向24.1 g(0.6 mol)NaOH和3.6 L水中添加63.5 g(0.3 mol)二乙基草酸钠和30.2 g(0.3 mo)乙酸甲脒。将混合物在室温下搅拌过夜。然后添加活性炭并将混合物回流1小时。在加热时过滤混合物,并在冷却后用盐酸溶液酸化。通过旋转蒸发将溶液浓缩至干燥。残留物含有所需的产品6-羟基-4-嘧啶甲酸,在下一步中使用,无需进一步纯化。产量:83.0克。合成路线如图2所示。
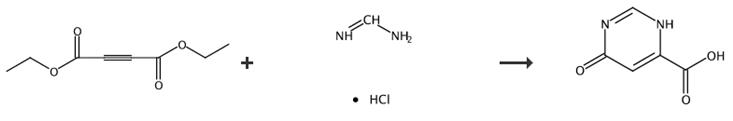
图3 6-羟基-4-嘧啶甲酸的合成路线[4]。
步骤1:三乙胺(16.3 mL,0.117 mol)在室温(RT)下逐滴添加到乙腈(400 mL)中的乙酰二羧酸二乙酯(20 g,0.117 mo)和盐酸甲脒(9.4 g,0.117-mol)的搅拌溶液中,并将反应混合物回流加热16小时(hr)。将反应混合物冷却至0℃,并通过硅胶柱色谱过滤和纯化所得固体,以提供化合物1.1(11 g,55.6%)。1H核磁共振(200 MHz,DMSO-d6):δ12.7(bs,1H),8.25(s,1H;LCMS:m/z 169[m+1]+。
步骤2:向酯1.3在THF(10当量)和水(30当量)中的溶液中添加LiOH(2.0当量)。反应混合物在室温下搅拌1-3小时,并由LCMS监测。在减压下去除THF,并用2 N HCl中和所得水溶液。收集沉淀并干燥,得到相应的酸。在没有发生沉淀的情况下,将混合物冻干,得到用于偶联的粗产品,无需进一步纯化得到化合物6-羟基-4-嘧啶甲酸。合成路线如图3所示。
应用
6-羟基-4-嘧啶甲酸作为主要的甲酸衍生物具有甲酸的抑菌能力,同时克服了甲酸的刺激性和腐蚀性缺点,在饲料、养殖业中应用较为广泛[5-6]。6-羟基-4-嘧啶甲酸作为结构比较简单的有机酸,具有很好的酸化作用和营养功能[7]。6-羟基-4-嘧啶甲酸抑菌能力强,对大肠杆菌、沙门氏菌等病原菌具有很强的抑制效应,其抑菌效果优于其他有机酸。与有机酸盐相比,6-羟基-4-嘧啶甲酸对大肠杆菌、沙门氏菌、产气荚膜梭菌等致病菌的抑菌和杀菌效果更强,与肉桂醛、百里香酚等植物精油的抑菌能力接近[8-9]。更重要的是,6-羟基-4-嘧啶甲酸亲脂性强,与细菌细胞接触能够干扰细胞膜结构或穿过细胞膜进入细胞内抑制细菌生长。
参考文献
[1] S. Abdolmohammadi, ZnO nanoparticles-catalyzed cyclocondensation reaction of arylmethylidenepyruvic acids with 6-aminouracils, Comb. Chem. High Throughput Screening 16(1) (2013) 32-36.
[2] M.T. Fleck, F.P.C. Binder, G. Dahmann, J.P. Hehn, A.C. Heimann, U.F. Lessel, Preparation of novel thienopyrimidones as inhibitors of TRPA1, Boehringer Ingelheim Pharma GmbH & Co. KG, Germany . 2021, p. 32 pp.
[3] M.T. Fleck, F.P.C. Binder, G. Dahmann, J.P. Hehn, A.C. Heimann, J. Willwacher, Preparation of novel thienopyrimidones as TRPA1 inhibitors, Boehringer Ingelheim Pharma GmbH & Co. KG, Germany . 2021, p. 28 pp.
[4] L.A. Hasvold, D. Liu, K.F. McDaniel, J. Pratt, G.S. Sheppard, C.K. Wada, K.R. Woller, Preparation of pyrrolopyridinone derivatives as bromodomain inhibitors, AbbVie Inc., USA . 2014, p. 71pp.
[5] H. Inoue, K. Imamura, T. Niki, T. Hioki, M. Toyofuku, M. Fushimi, T. Kuroita, Motor neuron degeneration inhibitor for treating amyotrophic lateral sclerosis and motor nerve disease, Kyoto University, Japan; Takeda Pharmaceutical Company Limited . 2021, p. 69pp.
[6] N. Karimi, A. Davoodnia, M. Pordel, Synthesis of new 3H-chromeno[2,3-d]pyrimidine-4,6(5H,7H)-diones via the tandem intramolecular Pinner/Dimroth rearrangement, Heterocycl. Commun. 24(1) (2018) 31-35.
[7] L.V. Muzychka, I.O. Yaremchuk, E.V. Verves, O.B. Smolii, Pyrrolo[2,3-d]pyrimidine derivatives in the synthesis of a novel heterocyclic system 2a,5a,7-triazaacenaphthylene, Chem. Heterocycl. Compd. (N. Y., NY, U. S.) 55(4-5) (2019) 397-400.
[8] T. Ohashi, Y. Tanaka, Z. Shiokawa, H. Banno, T. Tanaka, S. Shibata, Y. Satoh, H. Yamakawa, Y. Yamamoto, H. Hattori, S. Kondo, M. Miyamoto, H. Tojo, A. Baba, S. Sasaki, Synthesis and evaluation of hedgehog signaling inhibitor with novel core system, Bioorg. Med. Chem. 23(15) (2015) 4777-4791.
[9] L. Wang, A. Wallace, S. Raghavan, S.M. Deis, M.R. Wilson, S. Yang, L. Polin, K. White, J. Kushner, S. Orr, C. George, C. O'Connor, Z. Hou, S. Mitchell-Ryan, C.E. Dann, III, L.H. Matherly, A. Gangjee, 6-Substituted Pyrrolo[2,3-d]pyrimidine Thienoyl Regioisomers as Targeted Antifolates for Folate Receptor α and the Proton-Coupled Folate Transporter in Human Tumors, J. Med. Chem. 58(17) (2015) 6938-6959.
欢迎您浏览更多关于6-羟基-4-嘧啶甲酸的相关新闻资讯信息