大鼠输尿管上皮细胞的应用
发布日期:2021/12/31 10:11:13
背景[1-3]
大鼠输尿管上皮细胞分离自输尿管组织,分离的大鼠输尿管上皮细胞采用先中性蛋白酶消化、然后机械分离法使输尿管分层、最后胶原酶消化,并通过上皮细胞专用培养基培养筛选制备而来。
输尿管上接肾盂,下连膀胱,是一对细长的管道,呈扁圆柱状,位于腹膜后,为一肌肉粘膜所组成管状结构,沿腰大肌内侧的前方垂直下降进入骨盆。输尿管有三个狭窄部:一个在肾盂与输尿管移行处(输尿管起始处);一个在越过小骨盆入口处;最后一个在进入膀胱壁的内部。这些狭窄是结石、血块及坏死组织容易停留的部位。输尿管——膀胱连接处有一种特殊结构,即瓦耳代尔鞘,它能有效地防止膀胱内尿液返流到输尿管。临床上将输尿管分为上、中、下三段,也可称为腹段、盆段、膀胱段。
其中,腹段自肾盂输尿管交界处,到跨越髂动脉处;盆段,自髂动脉到膀胱壁;膀胱段,自膀胱壁内斜行至膀胱粘膜、输尿管开口。输尿管管壁分为4层,黏膜层、固有层、肌层、外膜。黏膜层表面为移行上皮,约有4-5层细胞;固有层由细密的结缔组织构成,内含胶原纤维和少量弹性纤维;输尿管肌层主要由内纵和外环两层平滑肌组成;外膜为疏松结缔组织,营养血管由外膜进入输尿管。其中,输尿管上皮细胞主要分布于黏膜层。
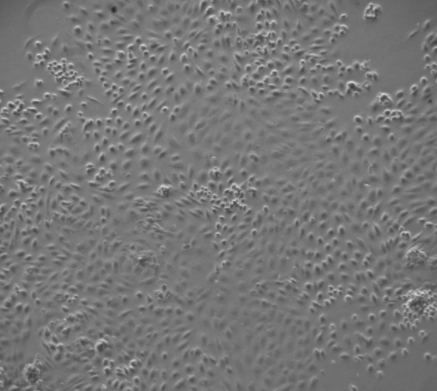
大鼠输尿管上皮细胞
使用方法:
1.取出T25细胞培养瓶,用75%酒精消毒瓶身,拆下封口膜,放入37℃、5%CO2、饱和湿度的细胞培养箱中静置3-4h,以稳定细胞状态。
2.贴壁细胞消化
1)吸出T25细胞培养瓶中的培养基,用PBS清洗细胞一次;
2)添加0.25%胰蛋白酶消化液1mL至T25培养瓶中,轻微转动培养瓶至消化液覆盖整个培养瓶底后,吸出多余胰蛋白酶消化液,37℃温浴1-3min;倒置显微镜下观察,待细胞回缩变圆后,再加入5ml完全培养基终止消化;
3)用吸管轻轻吹打混匀,按传代比例接种T25培养瓶传代,然后补充新鲜的完全培养基至5mL,置于37℃、5%CO2、饱和湿度的细胞培养箱中静置培养;
4)待细胞完全贴壁后,培养观察;之后按照换液频率更换新鲜的完全培养基。
应用[4][5]
用于梗阻性肾病中肾小管周围毛细血管损伤和依那普利保护作用的实验研究
慢性梗阻性肾病中肾小管周围毛细血管(peritubular capillary,PTC)的损伤可引起明显的肾小管上皮细胞凋亡和间质纤维化,其机制仍未完全阐明。
通过建立大鼠单侧输尿管完全梗阻(complete unilateral ureteral obstruction,CUUO)模型,来观察PTC的密度、形态学变化以及血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)蛋白的表达水平,分析其相关性以及与肾小管上皮细胞凋亡和间质纤维化之间的关系;进一步应用依那普利进行干预治疗,观察其对PTC和肾小管的保护作用。
方法:选用42只刚断乳雄性Sprague-Dawley(SD)大鼠进行动物实验。在氯氨酮麻醉下,36只大鼠用4-0丝线双重结扎左侧肾盂输尿管连接部,制成单侧输尿管完全梗阻(CUUO)模型。术后0、1、7、14、28天,分别随机选择6只CUUO模型大鼠,麻醉下收获肾脏标本后,采取断髓法处死。治疗组随机选6只CUUO模型大鼠,从第五天开始在其饮用水中加入依那普利(200mg/L),直至第14天收集肾脏标本。假手术(SO)组6只大鼠仅剖腹暴露输尿管后不作结扎,术后第14天收集肾脏标本。所有肾脏标本常规病理切片,分别用HE、PAS和Masson染色观察组织学变化。用电镜技术研究肾小管上皮细胞和PTC的形态学变化,用Flk-1标记PTC后进行密度测定。
用TUNEL方法检测原位细胞凋亡,免疫组织化学方法检测VEGF蛋白表达水平。用Leica图像分析系统对VEGF蛋白的表达强度和间质纤维化程度进行半定量检测。
结果:肾脏梗阻周,肾小管上皮细胞胞浆里的VEGF染色在局部有增强,Flk-1阳性PTC数量变化不显著,肾小管上皮细胞凋亡和肾间质纤维化很少见。第二、四周,VEGF表达逐渐下降,直至在一些肾小管内完全消失。
与此同时,Flk-1梗阻性肾病中肾小管周围毛细血管损伤和依那普利保护作用的实验研究中文摘要阳性的PTC数量减少,肾小管扩张或萎缩明显,间隙增宽;电镜技术显示肾小管上皮细胞、PTC内皮细胞的死亡形式主要为凋亡;T切阿EL方法显示肾小管上皮细胞凋亡在第14天达到高峰,PTC内皮细胞的凋亡呈升高趋势,直至实验结束;在梗阻第二周时,VEGF表达面积百分比与PTC密度正相关(r=0.668,P<0.05)。
而与凋亡的PTC内皮细胞平均数负相关(r一0.707,P<0.05);PTC密度与凋亡的肾小管上皮细胞平均数(r=一0.863,P<0.01)和间质纤维化面积百分比(r二一0.858,P<0.01)之间均呈负相关;依那普利治疗组梗阻肾脏的平均PTC密度为26.55士4.OS/HPF,明显高于非治疗组的梗阻肾脏(19.34士3.98/H PF,P<0.05)。
参考文献
[1]Molecular basis of renal fibrosis[J].Allison A.Eddy.Pediatric Nephrology.2000(3-4)
[2]Peritubular capillary loss is associated with chronic tubulointerstitial injury in human kidney:Altered expression of vascular endothelial growth factor[J].Yeong-Jin Choi,Subenduu Chakraborty,Vinh Nguyen,Charlie Nguyen,Byung Kee Kim,Sang In Shim,Wadi N.Suki,Luan D.Truong.Human Pathology.2000(12)
[3]Angiotensin II and gene expression in the kidney[J].S Klahr,J Morrissey.American Journal of Kidney Diseases.1998(1)
[4]Reduced angiotensinogen expression attenuates renal interstitial fibrosis in obstructive nephropathy in mice.Fern RJ,Yesko CM,Thornhill BA,et al.Journal of Clinical Investigation,The.1999
[5]樊彩斌.梗阻性肾病中肾小管周围毛细血管损伤和依那普利保护作用的实验研究[D].苏州大学,2004.
欢迎您浏览更多关于Rat Ureteral Epithelial Cells的相关新闻资讯信息