-
種類
チオ硫酸は遊離酸として単離することがほぼ不可能であるため、通常は塩の状態で販売されています。通常の化学試薬製品として販売されていることが多いです。
主な種類には、チオ硫酸ナトリウム、チオ硫酸ナトリウム五水和物、チオ硫酸マグネシウム、チオ硫酸マグネシウム六水和物チオ硫酸アンモニウム、チオ硫酸バリウムなどがあります。それぞれ、25g , 100g , 500gなど、実験室で扱いやすい容量規格で提供されている製品が多いです。
最も多く販売されているものはチオ硫酸ナトリウムですが、水溶液の状態で製品化されているものもあります。工業用製品には、「無水チオ硫酸ソーダ」としてチオ硫酸ナトリウムが販売されています。工業用途においては、25kgなど大スケールでの提供が一般的です。
-
化学的性質
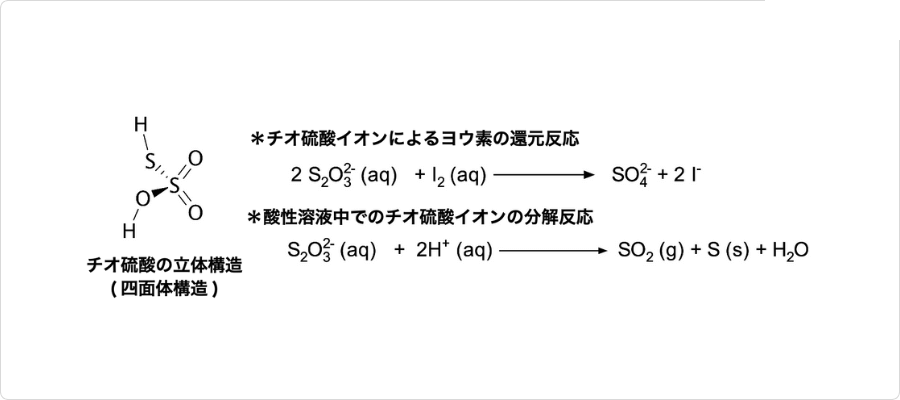
図チオ硫酸の化学的性質
チオ硫酸イオンは4面体構造をとり、硫黄原子は中心と1つの頂点に、酸素原子は他の頂点に位置しています。チオ硫酸塩並びにそのイオンであるチオ硫酸イオンは、酸化還元剤や金属のとしての働きがあります。
-
解説
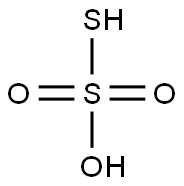
チオ硫酸 (Thiosulfuric acid) とは、硫黄のオキソ酸の一種で、水素イオンとチオ硫酸イオンの化合物です。
化学式では H2S2O3と表記される分子量114.14 の2価の無機酸であり、酸解離定数はpKa1 = 0.6、pKa2 = 1.6となっています。CAS登録番号は13686-28-7です。チオ硫酸塩のアンモニア塩、アルカリ金属塩、アルカリ土類金属塩は水溶性が大きく、中性ないしはアルカリ性水溶液は比較的安定です。
-
製造法
化学式H2S2O3。水素イオンとチオ硫酸イオンとの化合物。非常に分解しやすく不安定で、遊離酸としても、水溶液としてもまだ得られていない。金属元素と化合してチオ硫酸塩をつくる。遊離酸は室温で不安定であり,水溶液としても得られていない。-78℃のジエチルエーテル中で液体硫化水素H2Sと三酸化硫黄SO3を反応させ,-30℃で減圧蒸留して溶媒を除去することによりエーテル化物としてとり出されている。 SO3+H2S―→H2S2O3一般式MI2S2O3で示されるチオ硫酸塩thiosulfateは亜硫酸塩MI2SO3水溶液と硫黄を加熱して反応させると生成する。安定であり多くの塩が知られている。
株式会社平凡社 世界大百科事典 第2版について 情報
-
物理的性質
Thiosulfuric acid is a sulfur oxoacid. The free acid
cannot be prepared by acidifying thiosulfate salts
as the acid readily decomposes in water. Anhydrous methods of producing
the acid are:
H2S+ SO3→H2S2O3·nEt2O (in diethyl ether at 78°C)
Na2S2O3+2HCl/2NaCl+H2S2O3·2Et2O
(in diethyl ether at 78°C)
HSO3Cl+H2S→HCl+H2S2O3 (low temperature)
The anhydrous acid also decomposes below 0°C:
H2S2O3→H2S+ SO3
There is another isomeric form, a white crystalline
adduct of hydrogen sulfide and sulfur trioxide, H2S·SO3, which can also be prepared at low temperature.
-
使用用途
チオ硫酸自体は非常に分解しやすく不安定な物質であるため、そのままの状態で工業利用されることはありません。通常は塩の状態で取り扱われます。
例えば、無水チオ硫酸ソーダ () は脱塩素処理剤、染色助剤、皮革用のクロムなめし還元剤、バラスト水の薬剤処理中和剤、入浴剤、使い捨てカイロの原料、などの用途があります。他にも、結晶チオ硫酸ソーダやチオ硫酸ソーダ液が同様の用途で使用が可能です。
また、細菌の体内ではチオ硫酸単体をなど高付加価値のアミノ酸の合成に使っていることが知られています。