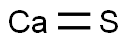-
種類
硫化カルシウムは、一般には主に研究開発用試薬製品として販売されています。
容量の種類には10g、25g、100g、500gなどがあり、実験室で取り扱いやすい容量での提供が中心です。通常、室温で保管可能な試薬製品として取り扱われています。
-
性質
硫化カルシウムは、分子量72.14、融点2,525℃であり、常温での外観は無色の結晶です。密度は2.8g/mLです。冷水に極めて溶けにくい性質を持ちます (溶解度: 0.015g/100mL (10°C)) 。
-
解説
硫化カルシウム,CaS(72.14).酸化カルシウムを赤熱して硫化水素を通じると得られる.無色の立方晶系結晶.密度2.56 g cm-3.2000 ℃ 以上で分解する.乾燥空気中で酸化されてチオ硫酸カルシウムを生じる.湿った空気中では水分と二酸化炭素を吸収して硫化水素を発生する.水に微溶.水溶液は加水分解して硫化水素カルシウムCa(HS)2と水酸化カルシウムを生じ,アルカリ性を示す.酸を作用させると硫化水素を発生する.ほかに四硫化物,五硫化物がある.脱毛作用があるので皮なめしに用いられる.そのほか,潤滑油添加剤,電子エミッター材料,蛍りん光体としてペイントやニスの成分などに用いられる.また,多硫化物は農業用殺虫殺菌剤(石灰硫黄合剤)として用いられる.
-
構造
硫化カルシウムの結晶は立方晶系結晶です。結晶構造中では、1つの硫黄原子が八面体を形成する6つのカルシウム原子に取り囲まれた構造をしており、また、それぞれのカルシウム原子は6つの硫黄原子に取り囲まれた構造をしています。
-
合成
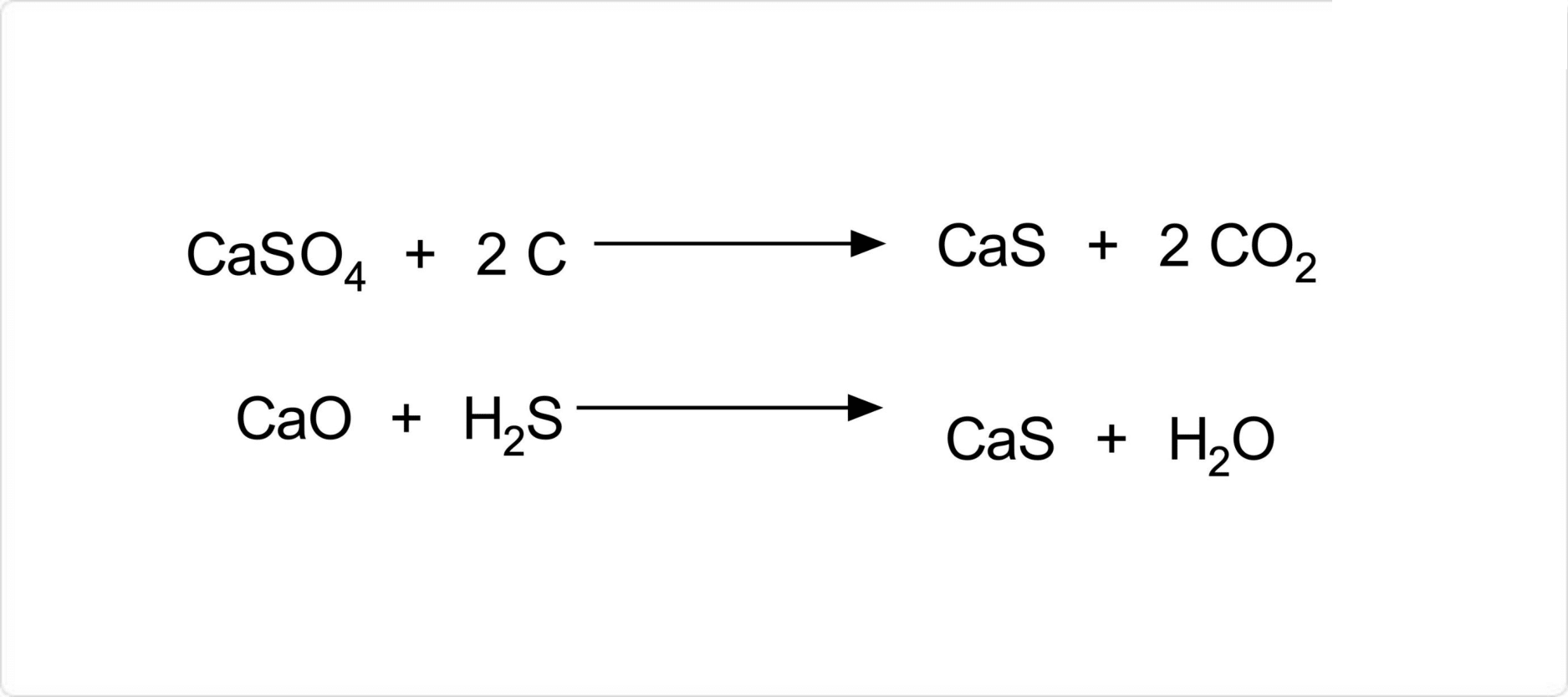
図. 硫化カルシウムの合成
硫化カルシウムは、と炭素を無酸素条件下で900℃に加熱することで合成が可能です。この反応は、すなわち硫酸カルシウムの炭素還元反応でもあります。
また、酸化カルシウムを赤熱するまで加熱してを通じる方法によっても硫化カルシウムを得ることができます。
-
特徴
原論文中5.6790 kXとあるものを1 kX=1.002077 Å(for CuKα)により換算
-
化学的特性
CALCIUM SULFIDE is OFF-WHITE POWDER
-
物理的性質
Calcium sulfide is slightly soluble in water but insoluble in alcohol. It reacts with acids, producing hydrogen sulfide gas.
Calcium sulfide is pale yellow to light gray with a bitter
taste. It is hygroscopic, producing an odor of H2S in
moist air.
-
天然物の起源
Calcium sulfide occurs in nature as the mineral oldhamite. It has several applications. The ‘luminous’ calcium sulfide is used in phosphors, luminous paints and varnishes. Calcium sulfide also is used as an additive to lubri cants; and as a flotation agent in ore extraction.
-
使用
CALCIUM SULFIDE is used in electron emitters. Luminous CaS used for making luminous paints or varnishes.
-
製造方法
Calcium sulfide can be
prepared by the direct reaction of the elements, calcined
in an inert atmosphere, at a 1:1.05 molecular ratio:
Ca+S+heat→CaS
This white material crystallizes in a cubic structurelike
rock salt and the bonding is highly ionic. This is
consistent with its description as an ionic solid.
CaS can also be produced by the “carbothermic
reduction” of calcium sulfate, which entails the conversion
of carbon, usually as charcoal, to CO2:
CaSO4+ 2C→CaS+ 2CO2
This can react further:
3CaSO4+ CaS→4CaO+ 4SO2
Thus, this type of preparation cannot be used to
prepare a pure CaS salt.
Calcium sulfide is available commercially as the pure
sulfide as well as the polysulfide due to its extensive
usage in the past as an insecticide both agriculturally
and in home gardens.
-
一般的な説明
Crystal structure of CaS is cubic. Electrical conductivity of calcium sufide in the temperature range of 650oC-1000oC was studied in great detail. It was concluded that CaS could be used as a potential electrolyte in a sulfur concentration cell.2
-
使用用途
硫化カルシウムの主な使用用途は、潤滑油の添加物、電子エミッターの材料、塗料、ニス、食物保存剤などです。また、脱毛作用を利用して皮のなめしに使われます。処分場での埋め立て材にも使われており、石膏製ギプスのリサイクルや石炭製品の処理過程などでも用いられている物質です。
電子エミッターの材料としては、特に純度の高い硫化カルシウムに希土類元素を加えて、エレクトロルミネッセンス材料として使用する用途があります。また、四硫化物や五硫化物などの多硫化物は、農業用殺虫・殺菌剤への用途もあります。
-
化学反応
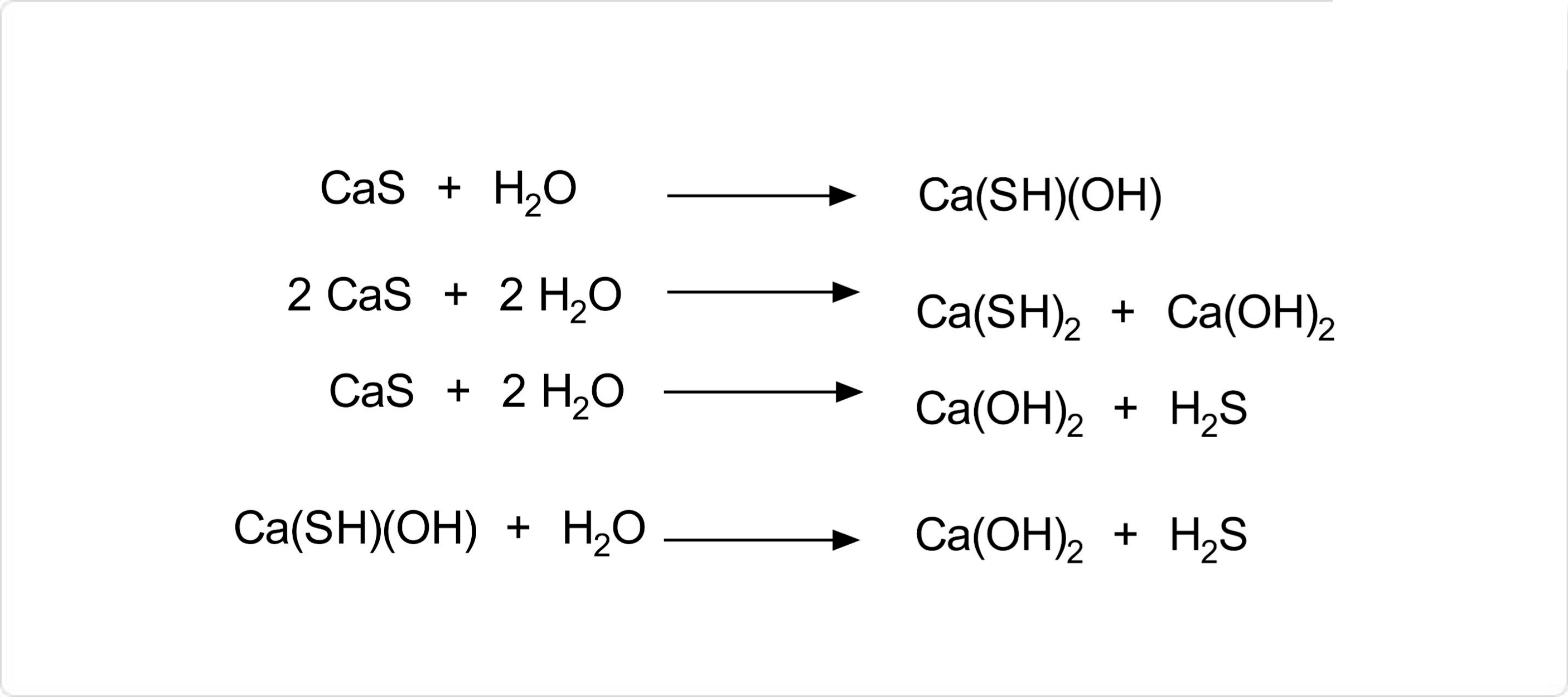
図. 硫化カルシウムの化学反応
硫化カルシウムは、湿度が高い環境下では、空気中の水分と反応して、水硫化カルシウム Ca(SH)2、Ca(OH)2、Ca(OH)(SH)の混合物を生じます。また、この時生じるCa(SH)(OH)はさらに水と反応して水酸化カルシウムと硫化水素を生成します。
乾燥空気中では、酸化が進行することにより硫化カルシウムからチオ硫酸カルシウムが生じます。また、希酸を加えることにより簡単に分解して硫化水素を発生します。例えば、塩酸との反応では、生成物は塩化カルシウムと硫化水素です。
-
有害性
硫化カルシウムは、前述の通り水に触れると可燃性/引火性ガス (硫化水素) を発生します。また、人体への有害性も知られており、具体的には以下のような症状などが挙げられます。
GHS分類においては、以下が指定されています。
- 皮膚腐食性/ 刺激性 : 区分2 (皮膚刺激)
- 眼に対する重篤な損傷性/眼刺激: 区分2 (強い眼刺激)
また、硫化カルシウムは自然界において、水生生物に非常に強い毒性を及ぼすことが知られている物質です。
-
保管
硫化カルシウムは加熱や酸との混触により、刺激性の有毒なガスやヒュームを生じます。大気中の水分とも徐々に反応し、硫化水素を発生することから、保管の際は密閉容器内での保管が必要です。熱、湿気を避け、また酸化剤、酸との混触を避ける必要があります。
参考文献
-
参考文献
O.J. Güntert, A. Faessler, Z. Krist., 107, 357 (1956), DOI: 10.1524/zkri.1956.107.5-6.357.