-
外観
赤褐色の結晶
-
性質
硫酸コバルト (II) の無水物の融点は735℃、七水和物の融点は74℃です。硫酸コバルト (II) の水和物は、空気中で風解します。水和物を250℃まで熱すると無水物が生じます。
硫酸コバルト (II) の無水物は、水、、などに溶かすことが可能です。
-
溶解性
水に可溶 (33g/100g水, 20℃)。エタノール, メタノールに難溶。水に溶けやすく、エタノールにやや溶けにくい。
-
解説
硫酸コバルトとは、コバルトの硫酸塩の無機化合物です。
硫酸コバルトには、硫酸コバルト (II) と硫酸コバルト (III) の2種類が存在します。硫酸コバルト (II) には、無水物、一水和物、七水和物が知られています。
硫酸コバルト (II) の七水和物は、濃紅色の柱状結晶です。別名、赤バン (英: bieberite) とも呼ばれています。日本で赤バンは、奈良県の堂ヶ谷鉱山や山梨県の鳳来鉱山などで確認されています。
-
用途
磁性体用、金属石けん?顔料原料、塗料?インキ乾燥剤、防錆材原料、飼料添加物、メッキ薬、触媒
-
用途
メッキ添加剤、触媒
-
構造
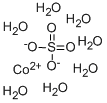
硫酸コバルト (II) の化学式はCoSO4で、モル質量は155.00g/molです。硫酸コバルト (II) の一水和物の化学式はCoSO4・H2O、モル質量は173.01g/molであり、七水和物の化学式はCoSO4・7H2O、モル質量は281.103g/molです。
硫酸コバルト (II) の無水物と一水和物は赤みを帯びた結晶であり、硫酸コバルト (II) の七水和物はFeSO4・7H2Oと同形の柱状晶を作っています。硫酸コバルト (II) の無水物の密度は3.71g/cm3、一水和物の密度は3.08g/cm3、七水和物の密度は2.03g/cm3です。
-
合成
をに溶かし、41.5℃以下で析出させることで、硫酸コバルト (II) の七水和物を生成できます。硫酸コバルト (III) は35℃で分解しますが、硫酸には分解せずに溶けます。硫酸コバルト (III) を加水分解すると、酸素が発生し、硫酸コバルト (II) を得ることが可能です。
-
危険性
マウスを用いた実験では、硫酸コバルト (II) の吸入によって、毒性や発癌性が確認されました。サルモネラ菌を使用した実験で、変異原性も確認されています。
カナダのケベック州にあるビール会社では、硫酸コバルト中毒によって、16名の死者を出しました。硫酸コバルト (II) は不燃性ですが、加熱によって分解するため、硫黄酸化物を含んだ有害ガスを生じます。
-
化学的特性
Cobalt sulphate appears as pink or red crystals. It is stable, non-flammable, and hygroscopic and undergoes dehydration at 41°C and 71°C.
-
使用
Usual source of water-soluble cobalt since it is the most economical and it shows less tendency to deliquesc or dehydrate than the chloride or nitrate. Used in storage batteries; in Co-electroplating baths; as drier for lithographic inks, varnishes; in ceramics, enamels, glazes to prevent discoloring; in Co pigments for decorating porcelain.
-
定義
ChEBI: A hydrate that is the heptahydrate form of cobalt(2+) sulfate.
-
一般的な説明
Pink to red monoclinic prismatic crystals or red granular solid. Odorless. Becomes anhydrous at 788°F.
-
空気と水の反応
Water soluble. The resulting solution is acidic.
-
反応プロフィール
Does not react strongly as either oxidizing agents or reducing agents but such behavior is not impossible. The aqueous solutions are acidic. May catalyze organic reactions.
-
火災危険
Literature sources indicate that Cobalt sulfate heptahydrate is nonflammable.
-
使用用途
硫酸コバルト (II) は、コバルトめっきや磁性材料、陶磁器の釉薬、コバルト塩の製造などに用いることが可能です。また、防錆材原料や各種や、ぺイント・インキの乾燥剤、や陶磁器の彩色用顔料、触媒、金属せっけん、不可視インク原料など、幅広い用途が挙げられます。
硫酸コバルト (II) は、医薬品分野では、貧血用薬にミネラル成分として配合されています。さらに、農業分野においても、同様の目的で、飼料添加物として使用可能です。
それに対して硫酸コバルト (III) は、強い酸化剤として使用されています。
-
産出
天然にはビーバーライト (英: beaverite) として、硫酸コバルト (II) が得られます。ビーバーライトとは、マグネシウムを含んだハイドロカルシルタイト (英: hydrocalcilutite) で、米国ミシガン湖にあるビーバー島 (英: Beaver Island) で産出されます。
-
職業ばく露
Many be used to catalyze organic reactions.
-
輸送方法
UN3288 Toxic solids, inorganic, n.o.s., Hazard Class: 6.1; Labels: 6.1-Poisonous materials, Technical Name Required.
-
純化方法
Crystallise it three times from conductivity water (1.3mL/g) between 100o and 0o depending on which hydrate is required. The heptahydrate crystallises below 44o and is efflorescent with m 97o . Between 44o and 70o the monoclinic hexahydrate CoSO4.6H2O m 41.5o is formed, and above 70o the monohydrate CoSO4.H2O m 71o is obtained. The pale reddish or lavender-coloured anhydrous salt is obtained by heating the hydrate above 250o, boiling with conc H2SO4 or heating with (NH4)2SO4).
-
不和合性
Aqueous solution reacts with bases, generating some heat. May react as either oxidizing agents or reducing agents
-
廃棄物の処理
Use a licensed professional waste disposal service to dispose of this material. All federal, state, and local environmental regulations must be observed.