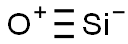-
外観
黒褐色~黒色, 塊
-
性質
一酸化ケイ素は気体で二原子分子として存在し、急速に冷えると茶色や黒のアモルファス固体を形成します。融点は1,702°Cで、沸点は1,880°Cです。ケイ素の酸化数は+2です。
一酸化ケイ素は、すぐにケイ素と二酸化ケイ素に不均化します。室温で空気によって容易に酸化して、材料を酸化から保護するSiO2表面層を与えます。
一酸化ケイ素の固体は黄褐色で、電気や熱の絶縁体です。固体は酸素中で燃焼します。水によって分解し、水素を放出します。温かい水酸化アルカリやフッ化水素酸に可溶です。
-
溶解性
熱水酸化ナトリウム溶液に溶ける。
-
反応
塩素分子やフッ素分子とともに一酸化ケイ素を濃縮して、光を当てると、平面状分子のOSiCl2やOSiF2と直線状分子であるOSiSが生成します。OSiCl2のSi-O結合長は149pmであり、OSiF2のSi-O結合長は148pmです。OSiSのSi-O結合長は149pmで、Si-Sは190pmです。
マイクロ波放電によって、濃縮した一酸化ケイ素と酸素原子から二酸化ケイ素が生成します。二酸化ケイ素は直線状の構造を有します。
アルミニウム、ナトリウム、パラジウム、金、銀などの共沈殿によって、さまざまな三原子分子を合成可能です。具体例として、PdSiOやAlSiOのような直線状の三原子分子だけでなく、AgSiOやAuSiOのような非直線状の三原子分子のほか、NaSiOなどの環状の三原子分子が挙げられます。
-
解説
化学式SiO。一酸化ケイ素は,別名モノックスmonox。密度2.24g/cm3の不透明な黒色ガラス状粉末で,融点1700℃以上。二酸化ケイ素SiO2に炭素または炭化ケイ素を反応させてつくる。空気中では表面が酸化され二酸化ケイ素の被膜を形成するので,薬品等に侵されにくい。水に入れると反応して水素を発生する。フッ化水素酸,あるいはフッ化水素酸と硝酸の混合物に可溶。温アルカリ溶液には溶けて水素を発生し,ケイ酸を生ずる。酸素中では燃える。
株式会社平凡社 世界大百科事典 第2版について 情報
-
用途
ガラスにスパッターして表面鏡の作製、光学ガラスに薄膜としてつけて摩擦や表面変化の防止、電子顕微鏡用の支持膜などに用いる。ファインセラミックス、超電導材料用
-
構造
一酸化ケイ素のモル質量は44.0849g/molで、密度は2.13g/cm3です。ケイ素原子と酸素原子が1:1の割合で結合している化合物です。2016年に一酸化ケイ素はケイ素と同様の構造を取る部分と、と同様の構造を取る部分で構成されることが明らかになりました。
ヘリウムで冷却するとアルゴンマトリックスに一酸化ケイ素がトラップされます。Si-O結合長は148.9pmであり、二酸化ケイ素の結合長に近く、一酸化炭素に見られる三重結合性は確認されません。
一酸化ケイ素の2〜4量体は、(Si-O)nと表される環状構造を有し、Si-Si結合を持っています。(Si-O)nは400〜800°Cでは数時間で、1,000〜1,440°Cでは急速に不可逆的にSiとSiO2へ不均化します。
-
合成法
1887年に初めてチャールズ・F・メイベリー (英: Charles F. Maybery) によって、シリカを木炭で還元するとガラス質の光沢を持つ一酸化ケイ素が形成されました。
ケイ素と二酸化ケイ素を熱すると、気体の一酸化ケイ素が生じます。原料の二酸化ケイ素は、鉱物や鉱石から分離可能です。
高温で二酸化ケイ素を一酸化炭素や水素分子で還元しても、一酸化ケイ素は得られます。
-
化学的特性
Silicon monoxide (SiO) is another oxide of silicon, used rarely in silicon processing but quite often in thin film, hybrid Ie manufacture. It is useful there because no silicon is available for in situ growth of the dioxide, and it is deposited easily by physical vapor deposition, a process quite similar to the vacuum deposition of aluminum described. Usually the condensed oxide is nonstoichiometric, being a mixture of SiO, Si02, and Si; often, it is designated SiOx .The value of x, which ranges between 1 and 2, is influenced by the deposition conditions.
The SiO source material is prepared by heating Si02 with Si, carbon, and hydrogen, or a hydrocarbon, to reduce the dioxide to the monoxide. Reduction takes place at roughly 1000°C, and SiO is formed in the vapor phase. This temperature is much too low to produce a significant vapor pressure of Si02, so the two oxides may be separated. The monoxide vapor is condensed out and subsequently powdered. This material, which is suitable for evaporation, is available commercially and need not be prepared by the IC manufacturer.
-
使用
Silicon monoxide (SiO) is a commonly used material for a wide variety of applications with the emphasis on IR multilayer coatings and adhesion promotion. SiO sublimes and should preferably be evaporated from resistance heated boats.
AREAS OF APPLICATION
Multilayer coatings especially for the IR, but also the VIS range
Adhesion promoter (VIS, NIR)
Electronics: dielectric, insulating and protective layers
Design: iridescent coatings, colored metallically reflecting coatings e.g. on sun glasses
Web coating: barrier layers on polymer films
-
使用用途
一酸化ケイ素はリチウムイオン二次電池の負極材料として注目されています。一酸化ケイ素を負極材料として用いると、従来のケイ素系負極材料であるケイ素などと比べて放電時の体積膨張率が低く、高容量の電池として繰り返し利用可能です。
一酸化ケイ素をリチウムイオン二次電池の負極材料として利用するため、一酸化ケイ素を炭素と均一に混ぜる、一酸化ケイ素を炭素でコーティングするなどの研究が進められています。