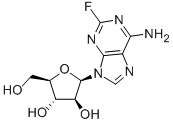
ChemicalBook CAS数据库列表 氟达拉滨
氟达拉滨
- CAS号:21679-14-1
- 英文名:Fludarabine
- 中文名:氟达拉滨
- CBNumber:CB8188247
- 分子式:C10H12FN5O4
- 分子量:285.23
- MOL File:21679-14-1.mol
氟达拉滨化学性质
- 熔点 :265-268°C
- 比旋光度 :D25 +17 ±2.5° (c = 0.1 in ethanol)
- 沸点 :747.3±70.0 °C(Predicted)
- 密度 :2.17±0.1 g/cm3(Predicted)
- 储存条件 :2-8°C
- 溶解度 :DMF: 20 mg/mL, clear, faintly yellow
- 形态 :Powder
- 酸度系数(pKa) :13.05±0.70(Predicted)
- 颜色 :White to Pale Yellow
- 水溶解性 :Soluble in DMF, DMSO, methanol or ethanol. Sparingly soluble in water
- Merck :13,4152
- BRN :1225932
- 稳定性 :Stable for 1 year from date of purchase as supplied. Solutions in DMSO may be stored at -20°C for up to 3 months.
- InChI :InChI=1/C10H12FN5O4/c11-10-14-7(12)4-8(15-10)16(2-13-4)9-6(19)5(18)3(1-17)20-9/h2-3,5-6,9,17-19H,1H2,(H2,12,14,15)/t3-,5-,6+,9-/s3
- InChIKey :HBUBKKRHXORPQB-VOSPVXAENA-N
- SMILES :C12N=C(N=C(N)C=1N=CN2[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1)F |&1:10,11,13,15,r|
- CAS 数据库 :21679-14-1(CAS DataBase Reference)
安全信息
- 危险品标志 :Xn
- 危险类别码 :23/24/25-36/37/38-39/23/24/25-39-22
- 安全说明 :26-36/37-45-36
- WGK Germany :3
- RTECS号 :AU6207000
- F :10
- 海关编码 :29349990
- 毒害物质数据 :21679-14-1(Hazardous Substances Data)
氟达拉滨 MSDS
9-bata-D-Arabinofuranosyl-2-fluoroadenine
氟达拉滨性质、用途与生产工艺
-
简介
氟达拉滨的化学名称为9‑β‑D‑阿拉伯呋喃糖‑2‑氟腺苷,其是一种抗肿瘤药物。氟达拉滨是一种抗代谢的氟化嘌呤核苷类似物,它对淋巴细胞有高度的选择性,它能够抑制处于静止期细胞DNA的修复及处于分裂期细胞DNA的合成,并且具有促进这些细胞凋亡的作用,已显示出良好疗效果,目前被广泛的运用于治疗各种血液系统疾病,尤其是慢性B淋巴细胞白血病。
-
药理作用
本药系阿糖腺苷的氟化核苷酸类似物,可相对地抵抗腺苷脱氨基酶的脱氨基作用。
磷酸氟达拉滨被快速地去磷酸化成为2F-ara-A,后者可以被细胞摄取,然后被细胞内的脱氧胞苷激酶磷酸化后成为有活性的三磷酸盐2F-ara-ATP。该代谢产物可以通过抑制核苷酸还原酶、DNA聚合酶(α、δ和ε)、DNA引物酶和DNA连接酶,从而抑制DNA的合成。此外,还可以部分抑制RNA聚合酶Ⅱ从而减少蛋白的合成。 - 药动学 静脉给药后,本品的磷酸盐迅速被脱磷酸,其基质被淋巴细胞摄取后再磷酸化成为具有活性的三磷酸氟达拉滨。在一次给药后4小时细胞内的三磷酸氟达拉滨可达峰值。本品从血象中清楚呈三相。终末半衰期约为10~30小时。大多数药物随尿排除。24小时内约可排出60%的给药量。口服40 mg/(m2•d)产生的整体浓度与静脉用药25 mg/(m2•d)是相同的。本品的药动学具有明显的个体差异。
- 适应症 主要用于治疗B细胞慢性淋巴细胞性白血病及非霍奇金淋巴瘤。
-
用法与用量
1.静脉给药:推荐的剂量是25mg/m2磷酸氟达拉滨,每28天静脉连续给药5天。
2.口服:一日40mg/m2,一日1 次服用,可以空腹或伴随食物服用,必须以水吞服,不应嚼服或把药片弄碎后服用,连用5天,然后停药23日(即28日为一个疗程)。
治疗持续时间取决于疗效及患者对药物的耐受性,应一直用到取得最佳治疗效果(完全或部分缓解,通常需6个周期)。
对肾功能不全患者的剂量应作相应的调整。肌酐清除率为30~70ml/min时剂量应减少50%,且要严密监测血液学改变以评价药物的毒性。 - 适宜溶剂 静注:先用2mL灭菌注射用水将粉针剂溶解50mg本品,再用氯化钠注射液10mL稀释。 静滴:先用2mL 灭菌注射用水将粉针剂溶解50mg 本品,再用氯化钠注射液100mL稀释。
- 给药速度 静滴:≥30min 静注:2~3min。
- 稳定性 密闭、避光、冷藏下贮存。配成溶液必须在8h 内用完。PVC 注射器具对本品没有吸附作用。
- 不良反应 最常见的不良反应有骨髓抑制(白细胞减少、血小板减少和贫血),以及包括肺炎、咳嗽、发热、疲倦、虚弱、恶心、呕吐和腹泻在内的感染。其他常见的报告事件包括寒战、水肿、不适、周围神经病变、视力障碍、食欲不振、黏膜炎、口腔炎和皮肤皮疹。口服组胃肠道反应比静脉用药组常见,但都属于轻、中度。磷酸氟达拉滨治疗的患者中可出现严重的机会性感染,已经有引起死亡的严重不良事件的报道。
-
禁忌症/慎用
1.对本品或其所含成分过敏的患者禁用。
2.肌酐清除率小于30ml/min的肾功能不全患者和失代偿性溶血性贫血的患者禁用。
3.妊娠及哺乳期禁用。
4、有免疫缺陷、机会性感染病史、肝肾功能不全、骨髓抑制者慎用。 -
药物相互作用
1.在一项临床研究中,磷酸氟达拉滨合用喷司他丁(脱氧柯福霉素)治疗CLL时,出现了致命性肺毒性,其高发生率不可以接受,因此,在使用磷酸氟达拉滨时不推荐合用喷司他丁。
2.双嘧达莫及其他腺苷吸收抑制剂可以减弱磷酸氟达拉滨的治疗效果。
3.临床研究和体外试验表明,磷酸氟达拉滨和阿糖胞苷联合使用可增加Ara-CTP(阿糖胞苷的活性代谢产物)在白血病细胞内的浓度和细胞外的量。对Ara-C的血液浓度和代谢率无影响。 -
配伍表
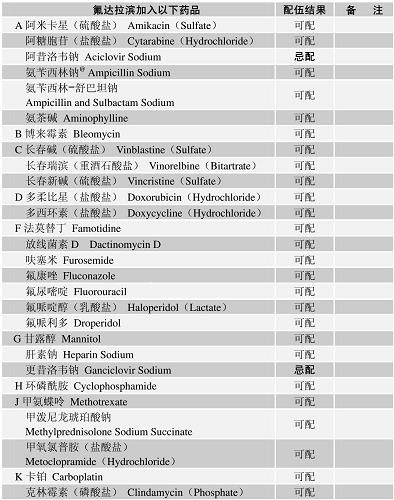
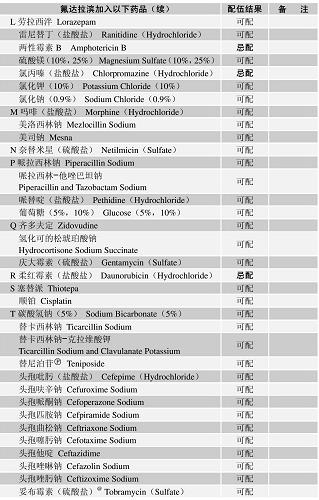
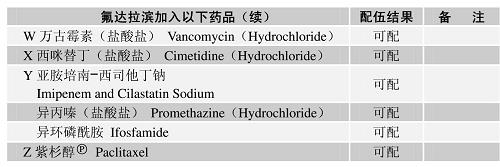
-
注意事项
1.在急性白血病患者的剂量范围研究中发现使用高剂量的磷酸氟达拉滨与重度的神经障碍相关,包括失 明、昏迷和死亡,症状出现于最后一次用药后21~60天。在静脉内应用约比推荐治疗剂量高4倍的磷酸氟 达拉滨(每天96mg/m2,5~7天)的患者中,36%出现了重度的中枢神经系统毒性,而在接受推荐剂量范围 治疗的患者中,重度的中枢神经系统毒性罕见(昏迷、癫痫和焦虑不安)或少见(意识模糊)。
2.对于健康状况差的患者,使用本药应谨慎,并且在给药前应认真权衡利弊,这一点尤其适用于那些严 重骨髓功能障碍(血小板减少、贫血、粒细胞减少)、免疫缺陷或有机会性感染病史的患者。对于发生机 会性感染风险最高的患者应考虑预防性治疗。
3.本品可造成严重的骨髓抑制,主要是贫血、血小板减少和中性粒细胞减少。在实体瘤患者的Ⅰ期临床 研究中发现,粒细胞数目降到最低计数的中位时间是13天(范围是第3~25天),血小板是16天(范围是第2 ~32天)。大多数患者的治疗前基础造血功能有损伤,可能是疾病本身所致或是以前用骨髓抑制药物治疗 的结果,可以看到骨髓抑制的累积效应。虽然化疗引起的骨髓抑制往往是可逆的,应用磷酸氟达拉滨时 仍需要严密的血液学监测。 本药是一种可能有明显毒副作用的有效的抗肿瘤药物,应严密监测用药患者的血液系统和非血液系统毒 性征象。推荐定期检测外周血细胞计数,以了解贫血、粒细胞减少和血小板减少的进展。在成年患者中 有多例三系骨髓再生不良或发育不全从而导致全血细胞减少症,有时可导致死亡的报告。在所报告的病 例中有临床意义的细胞减少持续的时间约为两个月至一年。
4.在CLL患者中常见报道疾病进展和转化(例如Richter's综合征)。
5.接受本药治疗的患者在输注未经照射处理的血液后,已经发现与输血相关的移植物抗宿主病(由输入的 具有免疫活性的淋巴细胞对宿主的反应)。有报告这种病的死亡率非常高,因此,正在接受或已经接受磷 酸氟达拉滨治疗的患者,在需要输血时应该只接受照射处理过的血液。
6.有报道,一些患者在接受磷酸氟达拉滨治疗期间或治疗后,既往的皮肤癌病变会加重或突然加重,或 者有新的皮肤癌出现。
7.不论有无自身免疫疾病既往史或Coombs试验的结果如何,在本药治疗期间或治疗后,会出现威胁生命 ,有时甚至致死的自身免疫现象(如自身免疫性溶血性贫血、自身免疫性血小板减少、血小板减少性紫癜 、天疱疮、Evan's综合征)。大多数经历过溶血性贫血的患者在再次接受磷酸氟达拉滨治疗后出现溶血性 病程的复发。
8.应该严密监测接受本药治疗的患者出现溶血的征象。一旦发生溶血,建议中断本药的治疗。输血和应 用肾上腺皮质激素制剂是治疗自身免疫性溶血性贫血最常用的方法。
9.血浆中主要代谢产物2F-ara-A的机体总清除率与肌酐清除率相关,提示肾脏排泄途径对此化合物清除 的重要性。肾功能减低的患者的总暴露量(2F-ara-A的AUC)升高。对于肾功能不全(肌酐清除率 <70ml/min)的患者只有有限的临床资料。 肾功能不全的患者须慎用本药。对于肾功能中度受损的患者(肌酐清除率在30~70ml/min之间),药物的 剂量应该减半并对患者进行严密监测。如果肌酐清除率小于30ml/min,应禁用本药治疗。
10.有生育能力的女性或男性在接受治疗期间和治疗停止后至少6个月必须采取避孕措施。
11.在接受本药治疗期间或治疗后,应该避免接种活疫苗。
12.由于磷酸氟达拉滨可造成疲倦、虚弱和视觉障碍等,因此可能降低驾驶车辆或机械操作能力。而睡眠 不足、个体敏感性和剂量尤其能削弱反应。
13.动物的胚胎毒性实验研究提示,治疗剂量的磷酸氟达拉滨可能对人体有胚胎毒性和(或)致畸的相对风 险。在接受磷酸氟达拉滨治疗期间应停止哺乳。 FDA对本药的妊娠安全性分级为D级。
14.尚未确定磷酸氟达拉滨用于儿童治疗的安全性和有效性。
15.磷酸氟达拉滨用于老年人(>75岁)的数据有限,因此这些患者使用磷酸氟达拉滨时应慎重。
16.怀孕的医务人员不应接触本品;操作时应严格操作程序(推荐戴乳胶手套和防护眼镜)和销毁规程, 对本品的任何溢出或废弃物都应焚化销毁;静滴时勿漏出血管外。 - 化学性质 从乙醇-水结晶,熔点260℃。[α]D23+17°±2.5°(C=0.1,乙醇)。UV最大吸收(Ph值1,Ph值7,Ph值13):262,261,262nm(ε 13200,14800, 15000)。难溶于水及有机溶剂。5’-单磷酸氟达拉滨(Fiudarabine 5'-Monophosphate):C10Hl3FN5O7P。[75607-67-9]。溶于水。
- 用途 其磷酸基在血液中被迅速裂开,余下的2-氟阿糖腺苷(Fara-A)则进入细胞内,并被磷酸化成为具有活性的代谢物Farar-ATP而发挥作用。用于慢性淋巴细胞白血症。
- 生产方法 2,4,5,6-四氨基嘧啶和甲酰胺一起加热环合,得2,6-二氨基嘌呤。用乙酸酐-吡啶络合物酰化,得2,6-二乙酰胺基嘌呤。接着和2,3,5-三-O-苄基-D阿拉伯呋喃糖基氯化物反应,得化合物(I)。(I)脱乙酰化得化合物(Ⅱ)。(II)在氟硼酸-四氢呋喃中,先亚硝化,再取代,得化合物(IlI)。在三氯化硼作用下,脱去苄基得氟达拉滨。以2,3,5-三-O-苄基-D-阿拉伯呋喃糖基氯化物计,收率17.5%。
氟达拉滨上下游产品信息
上游原料
下游产品
氟达拉滨 试剂级价格
- 更新日期:2024/11/11
- 产品编号:XW2167914101
- 产品名称:氟达拉滨
- CAS编号:21679-14-1
- 包装:250MG
- 价格:49元
- 更新日期:2024/11/08
- 产品编号:HY-B0069
- 产品名称:氟达拉滨 Fludarabine
- CAS编号:21679-14-1
- 包装:5mg
- 价格:496元
氟达拉滨生产厂家
- 公司名称:SYNCHEM-OHG
- 联系电话:+49 5662 408730
- 电子邮件:info@synchem.de
- 国家:德国
- 产品数:4705
- 优势度:70
- 公司名称:CHEMOS GmbH & Co. KG
- 联系电话:--
- 电子邮件:chemos@chemos.de
- 国家:德国
- 产品数:6727
- 优势度:58
- 公司名称:Service Chemical Inc.
- 联系电话:--
- 电子邮件:sales@chemos-group.com
- 国家:德国
- 产品数:6350
- 优势度:71
21679-14-1, 氟达拉滨相关搜索: