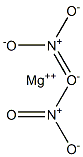
НИТРАТ МАГНИЯ
- английское имяMagnesium nitrate
- CAS №10377-60-3
- CBNumberCB1122970
- ФормулаMgN2O6
- мольный вес148.3148
- EINECS233-826-7
- номер MDLMFCD00011103
- файл Mol10377-60-3.mol
| Температура плавления | 648 °C(lit.) |
| Температура кипения | 1090 °C(lit.) |
| плотность | 0.889 g/mL at 25 °C |
| давление пара | 1 mm Hg ( 621 °C) |
| RTECS | OM3756000 |
| Fp | −26 °F |
| температура хранения | 2-30°C |
| растворимость | H2O: soluble |
| форма | turnings |
| цвет | white cubic crystals, crystalline |
| РН | <1 (20°C in H2O) |
| Растворимость в воде | Freely soluble in water. Moderately soluble in ethanol and ammonia. |
| Чувствительный | Hygroscopic |
| Мерк | 13,5697 |
| Пределы воздействия | ACGIH: TWA 2 ppm; STEL 4 ppm OSHA: TWA 2 ppm(5 mg/m3) NIOSH: IDLH 25 ppm; TWA 2 ppm(5 mg/m3); STEL 4 ppm(10 mg/m3) |
| Справочник по базе данных CAS | 10377-60-3(CAS DataBase Reference) |
| Непрямые добавки, используемые в веществах, контактирующих с пищевыми продуктами | MAGNESIUM NITRATE |
| Рейтинг продуктов питания EWG | 1 |
| FDA UNII | 77CBG3UN78 |
| Система регистрации веществ EPA | Magnesium nitrate (10377-60-3) |
| UNSPSC Code | 41116107 |
| NACRES | NA.24 |
| Коды опасности | C,Xi,O | |||||||||
| Заявления о рисках | 34-36/37/38-8-36/38-35 | |||||||||
| Заявления о безопасности | 43-7/8-26-17-36-45-36/37/39 | |||||||||
| РИДАДР | UN 2056 3/PG 2 | |||||||||
| WGK Германия | - | |||||||||
| TSCA | Yes | |||||||||
| Класс опасности | 5.1 | |||||||||
| Банк данных об опасных веществах | 10377-60-3(Hazardous Substances Data) | |||||||||
| NFPA 704: |
|
рисовальное письмо(GHS)
-
рисовальное письмо(GHS)


-
вредная бумага
H315:При попадании на кожу вызывает раздражение.
H319:При попадании в глаза вызывает выраженное раздражение.
H335:Может вызывать раздражение верхних дыхательных путей.
H272:Окислитель; может усилить возгорание.
-
оператор предупредительных мер
P220:Не допускать соприкосновения с одеждой и другими горючими материалами.
P305+P351+P338:ПРИ ПОПАДАНИИ В ГЛАЗА: Осторожно промыть глаза водой в течение нескольких минут. Снять контактные линзы, если Вы ими пользуетесь и если это легко сделать. Продолжить промывание глаз.
P405:Хранить в недоступном для посторонних месте.
НИТРАТ МАГНИЯ химические свойства, назначение, производство
Описание
Magnesium nitrate has the molecular formula of Mg(NO3)2 and the molecular weight of 148.3152 g/ mol.Magnesium nitrate is prepared by the action of nitric acid on magnesium carbonate, oxide or hydroxide:
MgCO3 + 2HNO3 ? Mg(NO3)2 + CO2 +H2O
Mg(OH)2 + 2HNO3 ? Mg(NO3)2 + 2H2O
The salt crystallizing at room temperature after evaporation is the hexahydrate, Mg(NO3)2·6H2O. Two stable hydrates are formed, the hexahydrate [CAS number =13446-18-9] and the dihydrate, Mg(NO3)2· 2H2O [CAS number = 15750-45-5].
Химические свойства
Magnesium nitrate is white crystalline solid.Использование
In pyrotechnics; in the concentration of nitric acid.Подготовка
The magnesium nitrate used in commerce has been synthesized in a variety of ways. The reaction between nitric acid and magnesium metal is one way and reaction with MgO is another. Magnesium hydroxide and ammonium nitrate also form the product but ammonia is released as a by-product:2HNO3 + Mg Mg(NO3)2 +H2
2HNO3 + MgO Mg(NO3)2 +H2O
Mg(OH)2 + 2NH4NO3 Mg(NO3)2 + 2NH3 + 2H2O
Since magnesium nitrate has a high affinity for water, heating the hexahydrate does not result in the dehydration of the salt. Instead, it decomposes into magnesium oxide, oxygen and nitrogen oxides:
4Mg(NO3)2·6H2O + heat 4MgO + 2NO2 + 2N2O + O2 + 6H2O
Heating the hexahydrate above its melting point first forms basic nitrates, such as Mg(NO3)2·4Mg(OH)2. It is this salt that decomposes at 400 C, forming magnesium oxide and oxides of nitrogen. The absorption of these nitrogen oxides in water is one possible way to synthesize HNO3. Although it is inefficient, it does not require the use of another strong acid and the mineral, nitromagnesite, can be used in this context.
Определение
ChEBI: The inorganic nitrate salt of magnesium.Общее описание
A white crystalline solid. Produces toxic oxides of nitrogen if heated to decomposition. Used in pyrotechnics.Реакции воздуха и воды
Deliquescent. Water soluble.Профиль реактивности
Mixtures of Magnesium nitrate with alkyl esters may explode owing to the formation of alkyl nitrates; mixtures with phosphorus, tin(II) chloride, or other reducing agents may react explosively [Bretherick 1979 p. 108-109]. Noncombustible but will accelerate the burning of combustible materials. If large quantities are involved in a fire or the combustible material is finely divided an explosion may result. Prolonged exposure to fire or heat may result in an explosion. Magnesium nitrate has been reported to undergo spontaneous decomposition in dimethylformamide [Bretherick 5th ed., 1995]. Magnesium nitrate tends to behave as a strong oxidizer.Опасность
Dangerous fire and explosion risk in contact with organic materials, strong oxidizing agent.Угроза здоровью
Exposure can cause mild irritation to the mucous membranes. Symptoms may include coughing and shortness of breath. Ingestion of large doses may cause dizziness, abdominal pain, vomiting, bloody diarrhea, weakness, convulsions, and collapse. Contact with skin may cause irritation, redness, and pain.Профиль безопасности
Probably a severe irritant to the eyes, skin, and mucous membranes. A powerful oxidizer. Violent decomposition on contact with dmethylformamide. When heated to decomposition it emits toxic fumes of NOx. See also NITRATES and MAGNESIUM COMPOUNDS.Возможный контакт
Magnesium nitrate is used in fireworks and in the production of concentrated nitric acid.Перевозки
UN1474 Magnesium nitrate, Hazard Class: 5.1; Labels: 5.1-OxidizerНесовместимости
A powerful oxidizer. Violent reaction with dimethylformamide, reducing agents; combustibles, fuels, organic and easily oxidizable matterНИТРАТ МАГНИЯ запасные части и сырье
сырьё
запасной предмет
- 4-(4-BROMOPHENYL)-3-PYRIDINECARBOXALDEHYDE
- 3-метилпиридин-2-карбоксальдегид
- Ацетат магния
- methanation catalysts
- 2-HYDROXYMETHYL-3-METHYLPYRIDINE
1of3