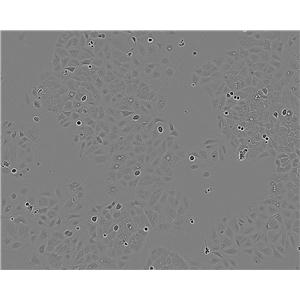
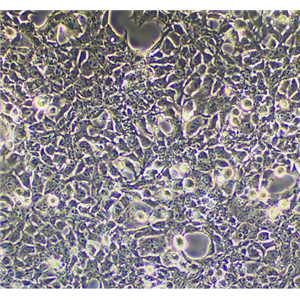
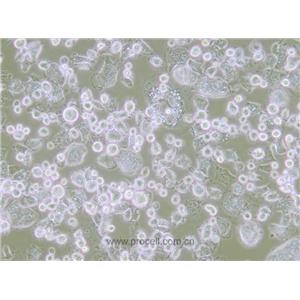
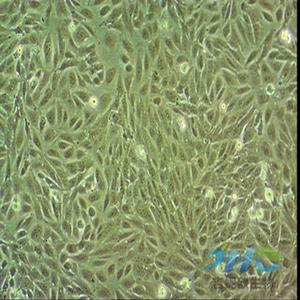
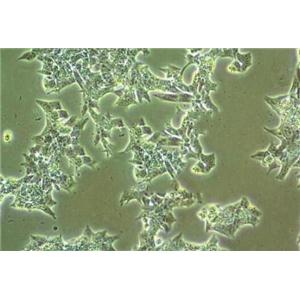
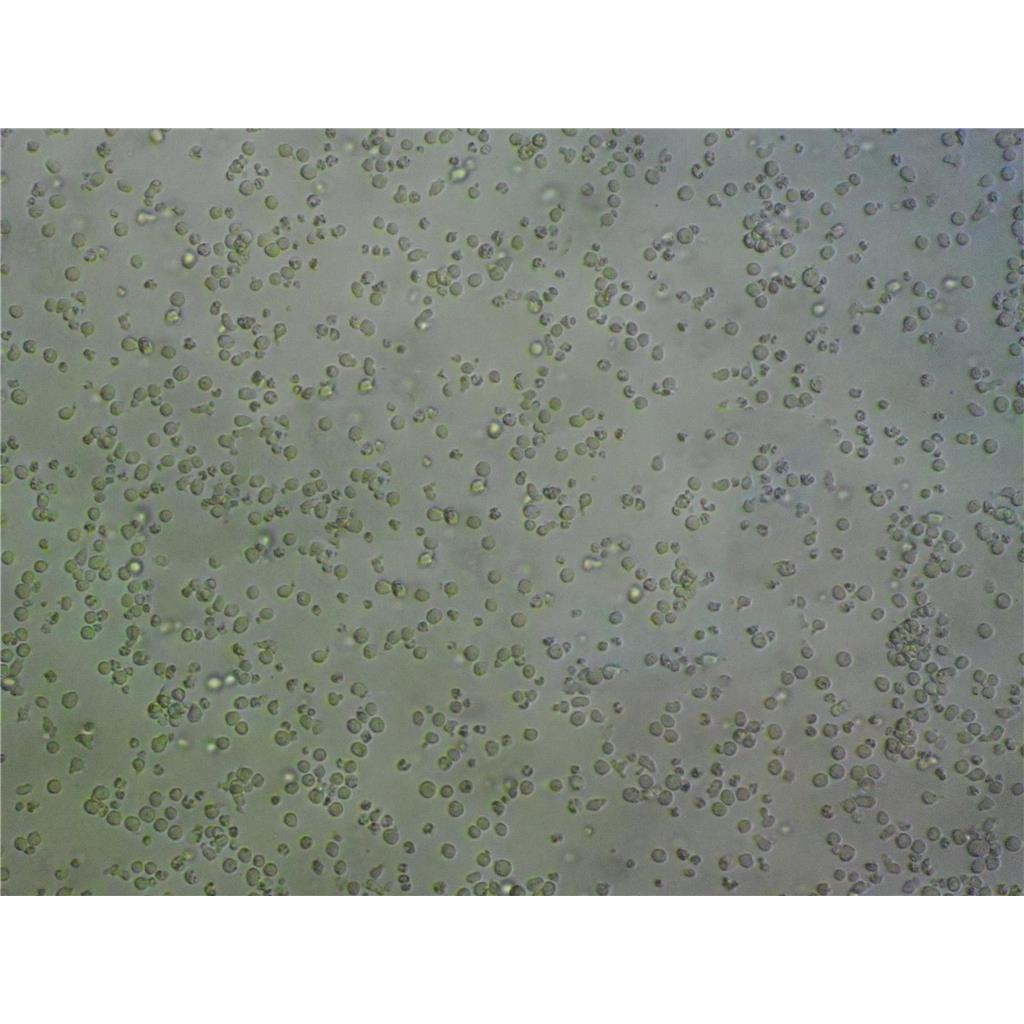
"Caov-3人乳突状卵巢腺癌复苏细胞保种中心|带STR证书
传代比例:1:2-1:4(首次传代建议1:2)
生长特性:贴壁生长
正确的细胞复苏需知事项:细胞冻存HAO了,接下来要注意什么问题呢?没错,就是记得到时间了,拿出来复苏。那么,细胞复苏的过程中又有哪些该注意的事项呢?细胞活力和形态检查的作用何在?活力检查——千万不要使用不健康的细胞,可能有污染(真菌、支原体等),如果发现有污染毫不犹豫的丢弃!形态检查——检查细胞的固有形态和生长行为。冻存细胞:补充新的培养——在您开始冻存细胞的前一天补充新的培养。在细胞长至70%单层时收获细胞,计数活细胞数,用冻存调整细胞密度~5 x106 s/ml (根据不同的细胞类型调整);冻存——用冻存洗细胞并用冻存重悬细胞,有不同类型的冻存,根据细胞类型选择Zui合适的冻存(常用的冻存成分有):5-10% DMSO——注意确保DMSO不含有其他的毒性物质;5-15%甘油;如果细胞在无血清培养基内生长,应在50%条件培养基内(细胞在无血清培养基内生长24小时)内冻存和复苏。在冻存管上标记HAO细胞类型,日期,冻存人等信息,并保证每冻存管不超过1.5ml。放入罐之前记录冻存管的数量和位置。以Zui快的速度转移冻存管知罐内,因此,此步骤ZuiHAO使用干冰,或者把冻存管浸入装有的小盒内。此外还要注意,在冻存管上没有足够的空间记录细胞的详细信息,做HAO记录是非常非常重要的!还有一个Zui重要的,一定要在异地的罐内保存同样的一份细胞,以免其中的一个罐出现问题!细胞正确的复苏方式和正确的冻存方式同样重要,熟记以下要点:当从罐内取出细胞时,有可能会出现冻存管破裂的情况,使用保护面罩和防护服十分必要;其实,细胞复苏只是一个简单的实验,不过这其中却不可避免有一些需要注意的细节,不然,也不一定会尽如人意。例如说,人身健康方面:一定要记得做HAO防冻工作,戴上护目镜;尽量降低DMSO对细胞的损伤等等。
换液周期:每周2-3次
KNS-42 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:多边形;相关产品有:P-388D1细胞、mRMEC细胞、T47-D细胞
266 Bl Cells;背景说明:详见相关文献介绍;传代方法:1:3传代,2-3天传一代;生长特性:悬浮生长 ;形态特性:淋巴母细胞样;相关产品有:GM03671C细胞、KM-H2细胞、SACC-83细胞
PC3M-IE8 Cells;背景说明:前列腺癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NWA细胞、SW-1417细胞、X63.Ag8.653细胞
Caov-3人乳突状卵巢腺癌复苏细胞保种中心|带STR证书
背景信息:该细胞1976年建系,源自一位54岁白人女性的卵巢腺癌组织。
细胞系的应用:1)免疫组化研究2)RNA干扰研究3)药物作用研究4)慢病毒转染研究等其它应用。细胞系通常用于实验研究,如增殖、迁移、侵袭等。细胞系在多个领域的研究中被广泛应用,包括基础医学、临床试验、药物筛选和分子生物学研究。这些研究不仅在中国,也在日本、美国和欧洲等多个国家和地区进行。
产品包装:复苏发货:T25培养瓶(一瓶)或冻存发货:1ml冻存管(两支)
来源说明:细胞主要来源ATCC、ECACC、DSMZ、RIKEN等细胞库
Hepa-RG Cells;背景说明:肝癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SF 763细胞、DHL4细胞、NCIH1373细胞
CAKI 1 Cells;背景说明:该细胞超微结构中包含许多微绒毛、少许微丝、许多小线粒体、发达的高尔基休和内质网、许多脂滴和多层体、次级溶酶体,没有发现病毒颗粒。;传代方法:1:2-1:4传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:OCI Ly10细胞、MILE SVEN1细胞、RC-4B/C细胞
JB6 Cl 30-7b Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:T-ALL-1细胞、Jurkat-77细胞、NCI-H2030细胞
KTA7 Cells;背景说明:肺腺癌;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NuTu-19细胞、M07e细胞、QGY7701细胞
Caov-3人乳突状卵巢腺癌复苏细胞保种中心|带STR证书
物种来源:人源、鼠源等其它物种来源
形态特性:上皮细胞样
实验室细胞培养基知识简介:干粉培养基:以前大部分实验室都是用干粉培养基,但配制过程就较为繁琐,要溶解、调pH值,过滤,过程中可能会产生一些浓度误差,而且有些实验室的水质并不理想,所以培养的效果会有差异。如果使用体培养基,这种人为的误差会减少,因为毕竟是大批量工业化生产的,批间差会很小。大家是不是感觉体培养基会贵很多,以前是这样,但现在大家都认同了;无血清培养基(Serum-Free Media),通常以SFM表示,顾名思义,就是在细胞培养中不需要添加血清,但是在某些应用中可能要添加生长因子或细胞因子。无血清培养基中添加了血清的主要成分:粘附因子、生长因子、必需的营养物质和激素等,能减少上述血清带来的不利因素,使细胞培养的条件更稳定。但它也不是完美的,从有血清培养过渡到无血清培养的条件并不像想象中那么直截了当。处于发育的不同分化阶段的细胞(例如干细胞与定向前体细胞相比)需要不同的配方,对生长因子和细胞因子的选择尤为重要。而且在去除血清的同时,也去除了一些血清蛋白具有的保护、解毒作用,因此对试剂、水的纯度和仪器清洁度的要求更GAO。另外,它的价格也比普通的培养基贵很多。
NCI-H2023 Cells;背景说明:详见相关文献介绍;传代方法:每周换液2次;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:G-292细胞、Stanford University-Diffuse Histiocytic Lymphoma-5细胞、HOS (TE85)细胞
TGW-nu-1 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:神经元细胞;相关产品有:Hep2细胞、SW 626细胞、SF-539 BT细胞
HS-940-T Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:Hs940-T细胞、WILL-2细胞、HSF2细胞
Y3-Ag 1.2.3 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:0V-1063细胞、DU_145细胞、ECC-10细胞
MiaPaCa2 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:HEC151细胞、CA 46细胞、KM12SM细胞
Hos TE-85 Cells;背景说明:骨肉瘤;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:MS1细胞、H650细胞、ACC3细胞
BT-483 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代,2—3天换液一次;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:C8161细胞、JROECL33细胞、U-87-MG细胞
KMY1022 Cells;背景说明:B淋巴细胞;EBV转化;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:OCILY-19细胞、CT26.CL25细胞、HCC0095细胞
HCC1500 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每3-5天换液;生长特性:贴壁生长;形态特性:上皮样;相关产品有:OEC33细胞、HTR-8/SV neo细胞、H1417细胞
HCC2185 Cells;背景说明:转移性小叶乳腺癌;胸腔积液转移;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:BEL-7402细胞、CCD-33Co细胞、B16/F0细胞
Douglas Foster-1 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:成纤维母细胞样;相关产品有:NCI-H2227细胞、APRE-19细胞、NIH:OVCAR-3细胞
THPI Cells;背景说明:该细胞从一名1岁的患有急性单核细胞性白血病的男孩的外周血中分离建立。该细胞可以吞噬乳胶颗粒和激活的红细胞,细胞膜和胞浆内均没有免疫球蛋白,表达C3R和FcR;可受佛波酯TPA诱导向单核系方向分化;可作为转染宿主。;传代方法:维持细胞浓度在2-4×105-8×105/ml,勿超过1×106/ml;2-3天换液1次。;生长特性:悬浮生长;形态特性:单核细胞;相关产品有:SK-N-BE(2C)细胞、NBL-12细胞、HS940细胞
NCI-H295 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:NCIH2141细胞、HUC-1细胞、Keio University-19-19细胞
GM00637H Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:A101D细胞、SUDHL16细胞、IM-95细胞
WRL-68 Cells;背景说明:胚胎;肝 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:LS411细胞、MeT-5A细胞、SUDHL-5细胞
Molm 13 Cells;背景说明:急性髓系白血病;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:NTERA2-cloneD1细胞、PNT1/A细胞、SK-NSH细胞
HCC-366 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:NCIH2591细胞、A 549细胞、LC-1细胞
Caov-3人乳突状卵巢腺癌复苏细胞保种中心|带STR证书
Abcam A-549 KDM5B KO Cells(提供STR鉴定图谱)
Abcam U-87MG LGI1 KO Cells(提供STR鉴定图谱)
BayGenomics ES cell line CSG113 Cells(提供STR鉴定图谱)
BayGenomics ES cell line RRT494 Cells(提供STR鉴定图谱)
BayGenomics ES cell line YTC488 Cells(提供STR鉴定图谱)
CHO IM4/V/IV-G4 Cells(提供STR鉴定图谱)
DA02352 Cells(提供STR鉴定图谱)
DA05938 Cells(提供STR鉴定图谱)
GM00314 Cells(提供STR鉴定图谱)
HEL 299 Cells;背景说明:红白细胞白血病;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:H2085细胞、MM.1S细胞、L-5178-Y细胞
MES-13 Cells;背景说明:肾小球系膜;SV40转化;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:OSK-1细胞、CTLL(2)细胞、Calu3细胞
H-7721 Cells;背景说明:用Northernblot方法,未能检测到细胞中1.3kbLFIRE-1/HFREP-1mRNA的表达。;传代方法:1:3传代,2-3天换液一次;生长特性:贴壁生长;形态特性:上皮样;相关产品有:TSU-Pr1细胞、TGBC-11-TKB细胞、HEp-2细胞
SHP77 Cells;背景说明:详见相关文献介绍;传代方法:3-4天换液1次。;生长特性:悬浮生长,少量贴壁;形态特性:上皮细胞;相关产品有:HS-683细胞、PFSK细胞、TE-10细胞
OVCAR-4 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:WML2细胞、MBT2细胞、H-2591细胞
IM-95 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:A-204细胞、AMJ2-C8细胞、JB6 Cl 30-7b细胞
291B2 Cells(提供STR鉴定图谱)
Pa16C Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:F9细胞、Panc02-H0细胞、HO-8910 PM细胞
NCI-H2171 Cells;背景说明:详见相关文献介绍;传代方法:3-4天换液1次。;生长特性:悬浮生长;形态特性:聚团悬浮;相关产品有:AN3细胞、Walker/LLC-WRC 256细胞、RCK8细胞
Line 522 Cells;背景说明:肺腺癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:H4IIEC3细胞、F442-A细胞、hMSC-BM细胞
CMT 167 Cells;背景说明:肺腺癌;雌性;C57BL/ICRF-a(t);传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:LLC-PK(1)细胞、VERO76细胞、RL95-2细胞
H35 Cells;背景说明:在糖皮质激素、胰岛素或cAMP衍生物的诱导下可以产生酪酸基转移酶;可被逆转录病毒感染;可产生白蛋白、转铁蛋白、凝血酶原;在AxC大鼠中可以成瘤。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:OV 2008细胞、6T-CEM细胞、OVCAR8细胞
RBE Cells;背景说明:人肝胆管癌细胞。据说产CEA和CA19-9。;传代方法:消化3-5分钟。1:2。3天内可长满。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:IGROV-1细胞、HEK 293 c18细胞、NS1-Ag4/1细胞
H2195 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:NCI-SNU-449细胞、COLO679细胞、NCI H716细胞
Panc 04.03 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:Mono-Mac-1细胞、T2(174 x CEM.T2)细胞、L428细胞
GM20982 Cells(提供STR鉴定图谱)
HAP1 KRAS (-) 3 Cells(提供STR鉴定图谱)
6-T CEM Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:1.1B4细胞、TR146细胞、Walker256细胞
Human Corneal Epithelial cells-Transformed Cells;背景说明:角膜上皮细胞;Ad-SV40转化;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NCIH1755细胞、NCI H69细胞、WEHI-3B细胞
COLO320HSR Cells;背景说明:该细胞1984年建系,源自一位33岁患有大肠腺癌男性经5-fu治疗后的腹水。;传代方法:1:2传代。3天内可长满。;生长特性:半贴壁生长;形态特性:详见产品说明书;相关产品有:H2110细胞、SuDHL 4细胞、H2073细胞
SKMEL28 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:8传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:星形的;相关产品有:Panc 05.04细胞、Pt K1细胞、PC3M-1E8细胞
GM02131A Cells;背景说明:B淋巴细胞;EBV转化;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:B16/F10细胞、PLC-8024细胞、MDA MB 453细胞
K7M2 Cells;背景说明:骨肉瘤;肺转移;雌性;BALB/c;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:GM03569D细胞、Pro-Lec1.3C细胞、NCI-H1092细胞
TR146 Cells;背景说明:食管鳞癌;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NK-92 transfected with MFG-hIL2细胞、T98 G细胞、TF-1细胞
293H Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:SMC-1细胞、HEK (AD293)细胞、MSB-1细胞
HPS3918 Cells(提供STR鉴定图谱)
K-KT Cells(提供STR鉴定图谱)
MDTC-RP34 Cells(提供STR鉴定图谱)
NGF-2 Cells(提供STR鉴定图谱)
PWS SD 2-3 iPSC Cells(提供STR鉴定图谱)
Ubigene HeLa EP300 KO Cells(提供STR鉴定图谱)
WY090 Cells(提供STR鉴定图谱)
HAP1 SP140 (-) 1 Cells(提供STR鉴定图谱)
G361 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:4传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:EBNA-293细胞、H-1755细胞、Ly10细胞
SLMT-1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:L5178Y TK+/- (clone 3.7.2C)细胞、SNU1细胞、BV173细胞
NCI-H676 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:SKN-SH细胞、OCILY-3细胞、BC-027细胞
Ly7 Cells;背景说明:弥漫大B淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:CBRH-7919细胞、H-748细胞、MD Anderson-Metastatic Breast-453细胞
Y3-Ag1,2,3 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:HO-8910细胞、CD18/HPAF细胞、LLC-MK2细胞
Y3-Ag1,2,3 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:HO-8910细胞、CD18/HPAF细胞、LLC-MK2细胞
NCI-H1373 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:4传代;2-3天换液1次。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:HLMVEC细胞、Colon 38细胞、RIN Cl-5F细胞
HM Cells;背景说明:小神经胶质 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:HCC1143细胞、P388D1细胞、SK-Mel 1细胞
L5178Y Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:Transformed Human Liver Epithelial-3细胞、J774.A1细胞、PL-5细胞
OCI-Ly 3 Cells;背景说明:弥漫大B淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:32Dc3细胞、LA 4细胞、SR-786细胞
Y3-Ag123 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:C4-1细胞、SK RC 20细胞、Hep-G2/C3A细胞
Y3-Ag1.2.3 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:HuH1细胞、NBL-1细胞、ETCC007细胞
MGHU3 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:MOLT.4细胞、WM-115细胞、NCIH1963细胞
KPNRTBM1 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:成神经细胞;相关产品有:32D clone3细胞、H 9细胞、CP-70细胞
BJAB-1 Cells;背景说明:Burkitt's淋巴瘤;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:SF767细胞、SkMel31细胞、Hs739T细胞
SP-R Cells(提供STR鉴定图谱)
HTR8svn Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:上皮细胞样;相关产品有:HCC-9204细胞、Panc3_27细胞、HT-144细胞
SK-OV-3 Cells;背景说明:SK-OV-3由G.Trempe和L.J.Old在1973年从卵巢肿瘤病人的腹水分离得到。 此细胞对肿瘤坏死因子和几种细胞毒性药物包括白喉毒素、顺铂和阿霉素均耐受。 在裸鼠中致瘤,且形成与卵巢原位癌一致的中度分化的腺癌。;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:上皮细胞样;相关产品有:WM-239-A细胞、TCMK1细胞、NCIH2405细胞
A-875 Cells;背景说明:NGF受体阳性。;传代方法:1:3传代;3-4天1次。;生长特性:贴壁生长;形态特性:多角形;相关产品有:OVCA-433细胞、Helacyton gartleri细胞、MIA Paca2细胞
PANC-10-05 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:SNU-878细胞、TGBC11TKB细胞、B16 BL6细胞
HR-8348 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:MV(4;11)细胞、NCI-H441细胞、PLC/PRF5细胞
SUM 159 Cells;背景说明:乳腺癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:C8-D1A细胞、IALM细胞、NCI-H2066细胞
H.Ep.-2 Cells;背景说明:最初认为这个细胞源自喉上皮癌,但随后通过同功酶分析、HeLa标记染色体和DNA指纹分析发现,起源细胞已被HeLa污染。 角蛋白免疫过氧化物酶染色阳性。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:SNU-886细胞、PLA802细胞、BT-B细胞
CHO cell clone K1 Cells;背景说明:1957年,PuckTT从成年中国仓鼠卵巢的活检组织建立了CHO细胞,CHO-K1是CHO的一个亚克隆。CHO-K1的生长需要脯酸。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:HCC-95细胞、SKNSH细胞、HCC9724细胞
HOPC Cells;背景说明:少突胶质前体 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:UACC-893细胞、Normal Rat Kidney细胞、H209细胞
KM-12 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:T8细胞、NCI-H1869细胞、SK-ES1细胞
32D.cl3 Cells;背景说明:骨髓淋巴瘤;C3H/HeJ;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:Mouse Podocyte Clone-5细胞、Panc203细胞、USMC细胞
Hs274T Cells;背景说明:详见相关文献介绍;传代方法:1:2传代,每周换液2-3次。;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:NCI-H1437细胞、HT 144细胞、LM(TK-)细胞
RPMI no. 8226 Cells;背景说明:来源于一位61岁的男性浆细胞瘤患者;可产生免疫球蛋白轻链,未检测到重链。;传代方法:按1:2传代,5-6小时可以看到细胞分裂;生长特性:悬浮生长;形态特性:淋巴母细胞样;相关产品有:AG 9细胞、SDBMSC细胞、A72细胞
NCIH838 Cells;背景说明:该细胞于1984年建系,源于一位59岁患有非小细胞肺癌的白人男性吸烟者,从患者淋巴结转移灶分离而来。;传代方法:1:3-1:6传代;2-3天换液1次。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:CCD841CoTr细胞、Murine Lung Epithelial-12细胞、U373MG细胞
Caov-3人乳突状卵巢腺癌复苏细胞保种中心|带STR证书
BayGenomics ES cell line CSH572 Cells(提供STR鉴定图谱)
BayGenomics ES cell line RRZ211 Cells(提供STR鉴定图谱)
BN17 Cells(提供STR鉴定图谱)
KTaV-3 Cells(提供STR鉴定图谱)
PGF2-2 Cells(提供STR鉴定图谱)
Per192 Cells(提供STR鉴定图谱)
" "PubMed=9698466; DOI=10.1006/gyno.1998.5039
Maxwell G.L., Risinger J.I., Tong B., Shaw H., Barrett J.C., Berchuck A., Futreal P.A.
Mutation of the PTEN tumor suppressor gene is not a feature of ovarian cancers.
Gynecol. Oncol. 70:13-16(1998)
PubMed=10318951; DOI=10.1073/pnas.96.10.5722; PMCID=PMC21927
Lau K.-M., Mok S.C., Ho S.-M.
Expression of human estrogen receptor-alpha and -beta, progesterone receptor, and androgen receptor mRNA in normal and malignant ovarian epithelial cells.
Proc. Natl. Acad. Sci. U.S.A. 96:5722-5727(1999)
PubMed=12080474; DOI=10.1038/sj.onc.1205542
Manzano R.G., Montuenga L.M., Dayton M.A., Dent P., Kinoshita I., Vicent S., Gardner G.J., Nguyen P., Choi Y.-H., Trepel J.B., Auersperg N., Birrer M.J.
CL100 expression is down-regulated in advanced epithelial ovarian cancer and its re-expression decreases its malignant potential.
Oncogene 21:4435-4447(2002)
PubMed=18560578; DOI=10.1371/journal.pone.0002425; PMCID=PMC2409963
Faca V.M., Ventura A.P., Fitzgibbon M.P., Pereira-Faca S.R., Pitteri S.J., Green A.E., Ireton R.C., Zhang Q., Wang H., O'Briant K.C., Drescher C.W., Schummer M., McIntosh M.W., Knudsen B.S., Hanash S.M.
Proteomic analysis of ovarian cancer cells reveals dynamic processes of protein secretion and shedding of extra-cellular domains.
PLoS ONE 3:E2425-E2425(2008)
PubMed=19926575; DOI=10.1309/AJCPTK87EMMIKPFS; PMCID=PMC3040237
DeRycke M.S., Andersen J.D., Harrington K.M., Pambuccian S.E., Kalloger S.E., Boylan K.L.M., Argenta P.A., Skubitz A.P.N.
S100A1 expression in ovarian and endometrial endometrioid carcinomas is a prognostic indicator of relapse-free survival.
Am. J. Clin. Pathol. 132:846-856(2009)
PubMed=20164919; DOI=10.1038/nature08768; PMCID=PMC3145113
Bignell G.R., Greenman C.D., Davies H.R., Butler A.P., Edkins S., Andrews J.M., Buck G., Chen L., Beare D., Latimer C., Widaa S., Hinton J., Fahey C., Fu B.-Y., Swamy S., Dalgliesh G.L., Teh B.T., Deloukas P., Yang F.-T., Campbell P.J., Futreal P.A., Stratton M.R.
Signatures of mutation and selection in the cancer genome.
Nature 463:893-898(2010)
PubMed=20204287; DOI=10.3892/or_00000728; PMCID=PMC2909445
Langland G.T., Yannone S.M., Langland R.A., Nakao A., Guan Y.-H., Long S.B.T., Vonguyen L., Chen D.J., Gray J.W., Chen F.-Q.
Radiosensitivity profiles from a panel of ovarian cancer cell lines exhibiting genetic alterations in p53 and disparate DNA-dependent protein kinase activities.
Oncol. Rep. 23:1021-1026(2010)
PubMed=20215515; DOI=10.1158/0008-5472.CAN-09-3458; PMCID=PMC2881662
Rothenberg S.M., Mohapatra G., Rivera M.N., Winokur D., Greninger P., Nitta M., Sadow P.M., Sooriyakumar G., Brannigan B.W., Ulman M.J., Perera R.M., Wang R., Tam A., Ma X.-J., Erlander M., Sgroi D.C., Rocco J.W., Lingen M.W., Cohen E.E.W., Louis D.N., Settleman J., Haber D.A.
A genome-wide screen for microdeletions reveals disruption of polarity complex genes in diverse human cancers.
Cancer Res. 70:2158-2164(2010)
PubMed=22328975; DOI=10.1158/2159-8290.CD-11-0170; PMCID=PMC3274821
Hanrahan A.J., Schultz N., Westfal M.L., Sakr R.A., Giri D.D., Scarperi S., Janakiraman M., Olvera N., Stevens E.V., She Q.-B., Aghajanian C., King T.A., de Stanchina E., Spriggs D.R., Heguy A., Taylor B.S., Sander C., Rosen N., Levine D.A., Solit D.B.
Genomic complexity and AKT dependence in serous ovarian cancer.
Cancer Discov. 2:56-67(2012)
PubMed=22460905; DOI=10.1038/nature11003; PMCID=PMC3320027
Barretina J.G., Caponigro G., Stransky N., Venkatesan K., Margolin A.A., Kim S., Wilson C.J., Lehar J., Kryukov G.V., Sonkin D., Reddy A., Liu M., Murray L., Berger M.F., Monahan J.E., Morais P., Meltzer J., Korejwa A., Jane-Valbuena J., Mapa F.A., Thibault J., Bric-Furlong E., Raman P., Shipway A., Engels I.H., Cheng J., Yu G.-Y.K., Yu J.-J., Aspesi P. Jr., de Silva M., Jagtap K., Jones M.D., Wang L., Hatton C., Palescandolo E., Gupta S., Mahan S., Sougnez C., Onofrio R.C., Liefeld T., MacConaill L.E., Winckler W., Reich M., Li N.-X., Mesirov J.P., Gabriel S.B., Getz G., Ardlie K., Chan V., Myer V.E., Weber B.L., Porter J., Warmuth M., Finan P., Harris J.L., Meyerson M.L., Golub T.R., Morrissey M.P., Sellers W.R., Schlegel R., Garraway L.A.
The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity.
Nature 483:603-607(2012)
PubMed=22710073; DOI=10.1016/j.ygyno.2012.06.017; PMCID=PMC3432677
Korch C.T., Spillman M.A., Jackson T.A., Jacobsen B.M., Murphy S.K., Lessey B.A., Jordan V.C., Bradford A.P.
DNA profiling analysis of endometrial and ovarian cell lines reveals misidentification, redundancy and contamination.
Gynecol. Oncol. 127:241-248(2012)
PubMed=23415752; DOI=10.1016/j.molonc.2012.12.007; PMCID=PMC4106023
Stordal B., Timms K., Farrelly A., Gallagher D., Busschots S., Renaud M., Thery J., Williams D., Potter J., Tran T., Korpanty G., Cremona M., Carey M.S., Li J., Li Y., Aslan O., O'Leary J.J., Mills G.B., Hennessy B.T.
BRCA1/2 mutation analysis in 41 ovarian cell lines reveals only one functionally deleterious BRCA1 mutation.
Mol. Oncol. 7:567-579(2013)
PubMed=23839242; DOI=10.1038/ncomms3126; PMCID=PMC3715866
Domcke S., Sinha R., Levine D.A., Sander C., Schultz N.
Evaluating cell lines as tumour models by comparison of genomic profiles.
Nat. Commun. 4:2126.1-2126.10(2013)
PubMed=24023729; DOI=10.1371/journal.pone.0072162; PMCID=PMC3762837
Anglesio M.S., Wiegand K.C., Melnyk N., Chow C., Salamanca C.M., Prentice L.M., Senz J., Yang W., Spillman M.A., Cochrane D.R., Shumansky K., Shah S.P., Kalloger S.E., Huntsman D.G.
Type-specific cell line models for type-specific ovarian cancer research.
PLoS ONE 8:E72162-E72162(2013)
PubMed=25230021; DOI=10.1371/journal.pone.0103988; PMCID=PMC4167545
Beaufort C.M., Helmijr J.C.A., Piskorz A.M., Hoogstraat M., Ruigrok-Ritstier K., Besselink N., Murtaza M., van IJcken W.F.J., Heine A.A.J., Smid M., Koudijs M.J., Brenton J.D., Berns E.M.J.J., Helleman J.
Ovarian cancer cell line panel (OCCP): clinical importance of in vitro morphological subtypes.
PLoS ONE 9:E103988-E103988(2014)
PubMed=25984343; DOI=10.1038/sdata.2014.35; PMCID=PMC4432652
Cowley G.S., Weir B.A., Vazquez F., Tamayo P., Scott J.A., Rusin S., East-Seletsky A., Ali L.D., Gerath W.F.J., Pantel S.E., Lizotte P.H., Jiang G.-Z., Hsiao J., Tsherniak A., Dwinell E., Aoyama S., Okamoto M., Harrington W., Gelfand E.T., Green T.M., Tomko M.J., Gopal S., Wong T.C., Li H.-B., Howell S., Stransky N., Liefeld T., Jang D., Bistline J., Meyers B.H., Armstrong S.A., Anderson K.C., Stegmaier K., Reich M., Pellman D., Boehm J.S., Mesirov J.P., Golub T.R., Root D.E., Hahn W.C.
Parallel genome-scale loss of function screens in 216 cancer cell lines for the identification of context-specific genetic dependencies.
Sci. Data 1:140035-140035(2014)
PubMed=25485619; DOI=10.1038/nbt.3080
Klijn C., Durinck S., Stawiski E.W., Haverty P.M., Jiang Z.-S., Liu H.-B., Degenhardt J., Mayba O., Gnad F., Liu J.-F., Pau G., Reeder J., Cao Y., Mukhyala K., Selvaraj S.K., Yu M.-M., Zynda G.J., Brauer M.J., Wu T.D., Gentleman R.C., Manning G., Yauch R.L., Bourgon R., Stokoe D., Modrusan Z., Neve R.M., de Sauvage F.J., Settleman J., Seshagiri S., Zhang Z.-M.
A comprehensive transcriptional portrait of human cancer cell lines.
Nat. Biotechnol. 33:306-312(2015)
PubMed=25877200; DOI=10.1038/nature14397
Yu M., Selvaraj S.K., Liang-Chu M.M.Y., Aghajani S., Busse M., Yuan J., Lee G., Peale F.V., Klijn C., Bourgon R., Kaminker J.S., Neve R.M.
A resource for cell line authentication, annotation and quality control.
Nature 520:307-311(2015)
PubMed=26589293; DOI=10.1186/s13073-015-0240-5; PMCID=PMC4653878
Scholtalbers J., Boegel S., Bukur T., Byl M., Goerges S., Sorn P., Loewer M., Sahin U., Castle J.C.
TCLP: an online cancer cell line catalogue integrating HLA type, predicted neo-epitopes, virus and gene expression.
Genome Med. 7:118.1-118.7(2015)
PubMed=27235858; DOI=10.1016/j.ygyno.2016.05.028; PMCID=PMC4961516
Hernandez L., Kim M.K., Lyle L.T., Bunch K.P., House C.D., Ning F., Noonan A.M., Annunziata C.M.
Characterization of ovarian cancer cell lines as in vivo models for preclinical studies.
Gynecol. Oncol. 142:332-340(2016)
PubMed=27397505; DOI=10.1016/j.cell.2016.06.017; PMCID=PMC4967469
Iorio F., Knijnenburg T.A., Vis D.J., Bignell G.R., Menden M.P., Schubert M., Aben N., Goncalves E., Barthorpe S., Lightfoot H., Cokelaer T., Greninger P., van Dyk E., Chang H., de Silva H., Heyn H., Deng X.-M., Egan R.K., Liu Q.-S., Miroo T., Mitropoulos X., Richardson L., Wang J.-H., Zhang T.-H., Moran S., Sayols S., Soleimani M., Tamborero D., Lopez-Bigas N., Ross-Macdonald P., Esteller M., Gray N.S., Haber D.A., Stratton M.R., Benes C.H., Wessels L.F.A., Saez-Rodriguez J., McDermott U., Garnett M.J.
A landscape of pharmacogenomic interactions in cancer.
Cell 166:740-754(2016)
PubMed=27561551; DOI=10.1038/ncomms12645; PMCID=PMC5007461
Coscia F., Watters K.M., Curtis M., Eckert M.A., Chiang C.-Y., Tyanova S., Montag A., Lastra R.R., Lengyel E., Mann M.
Integrative proteomic profiling of ovarian cancer cell lines reveals precursor cell associated proteins and functional status.
Nat. Commun. 7:12645.1-12645.14(2016)
PubMed=28196595; DOI=10.1016/j.ccell.2017.01.005; PMCID=PMC5501076
Li J., Zhao W., Akbani R., Liu W.-B., Ju Z.-L., Ling S.-Y., Vellano C.P., Roebuck P., Yu Q.-H., Eterovic A.K., Byers L.A., Davies M.A., Deng W.-L., Gopal Y.N.V., Chen G., von Euw E.M., Slamon D.J., Conklin D., Heymach J.V., Gazdar A.F., Minna J.D., Myers J.N., Lu Y.-L., Mills G.B., Liang H.
Characterization of human cancer cell lines by reverse-phase protein arrays.
Cancer Cell 31:225-239(2017)
PubMed=30485824; DOI=10.1016/j.celrep.2018.10.096; PMCID=PMC6481945
Papp E., Hallberg D., Konecny G.E., Bruhm D.C., Adleff V., Noe M., Kagiampakis I., Palsgrove D., Conklin D., Kinose Y., White J.R., Press M.F., Drapkin R.I., Easwaran H., Baylin S.B., Slamon D.J., Velculescu V.E., Scharpf R.B.
Integrated genomic, epigenomic, and expression analyses of ovarian cancer cell lines.
Cell Rep. 25:2617-2633(2018)
PubMed=30894373; DOI=10.1158/0008-5472.CAN-18-2747; PMCID=PMC6445675
Dutil J., Chen Z.-H., Monteiro A.N.A., Teer J.K., Eschrich S.A.
An interactive resource to probe genetic diversity and estimated ancestry in cancer cell lines.
Cancer Res. 79:1263-1273(2019)
PubMed=31068700; DOI=10.1038/s41586-019-1186-3; PMCID=PMC6697103
Ghandi M., Huang F.W., Jane-Valbuena J., Kryukov G.V., Lo C.C., McDonald E.R. 3rd, Barretina J.G., Gelfand E.T., Bielski C.M., Li H.-X., Hu K., Andreev-Drakhlin A.Y., Kim J., Hess J.M., Haas B.J., Aguet F., Weir B.A., Rothberg M.V., Paolella B.R., Lawrence M.S., Akbani R., Lu Y.-L., Tiv H.L., Gokhale P.C., de Weck A., Mansour A.A., Oh C., Shih J., Hadi K., Rosen Y., Bistline J., Venkatesan K., Reddy A., Sonkin D., Liu M., Lehar J., Korn J.M., Porter D.A., Jones M.D., Golji J., Caponigro G., Taylor J.E., Dunning C.M., Creech A.L., Warren A.C., McFarland J.M., Zamanighomi M., Kauffmann A., Stransky N., Imielinski M., Maruvka Y.E., Cherniack A.D., Tsherniak A., Vazquez F., Jaffe J.D., Lane A.A., Weinstock D.M., Johannessen C.M., Morrissey M.P., Stegmeier F., Schlegel R., Hahn W.C., Getz G., Mills G.B., Boehm J.S., Golub T.R., Garraway L.A., Sellers W.R.
Next-generation characterization of the Cancer Cell Line Encyclopedia.
Nature 569:503-508(2019)
PubMed=31978347; DOI=10.1016/j.cell.2019.12.023; PMCID=PMC7339254
Nusinow D.P., Szpyt J., Ghandi M., Rose C.M., McDonald E.R. 3rd, Kalocsay M., Jane-Valbuena J., Gelfand E.T., Schweppe D.K., Jedrychowski M.P., Golji J., Porter D.A., Rejtar T., Wang Y.K., Kryukov G.V., Stegmeier F., Erickson B.K., Garraway L.A., Sellers W.R., Gygi S.P.
Quantitative proteomics of the Cancer Cell Line Encyclopedia.
Cell 180:387-402.e16(2020)"