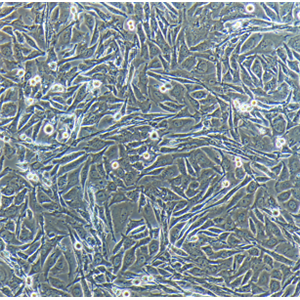
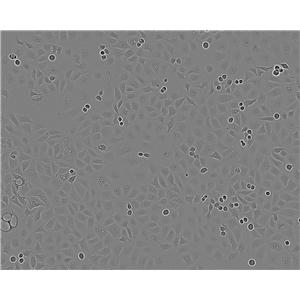
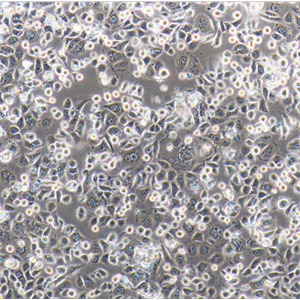
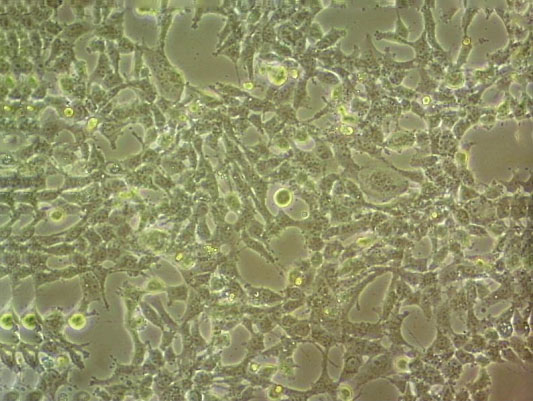
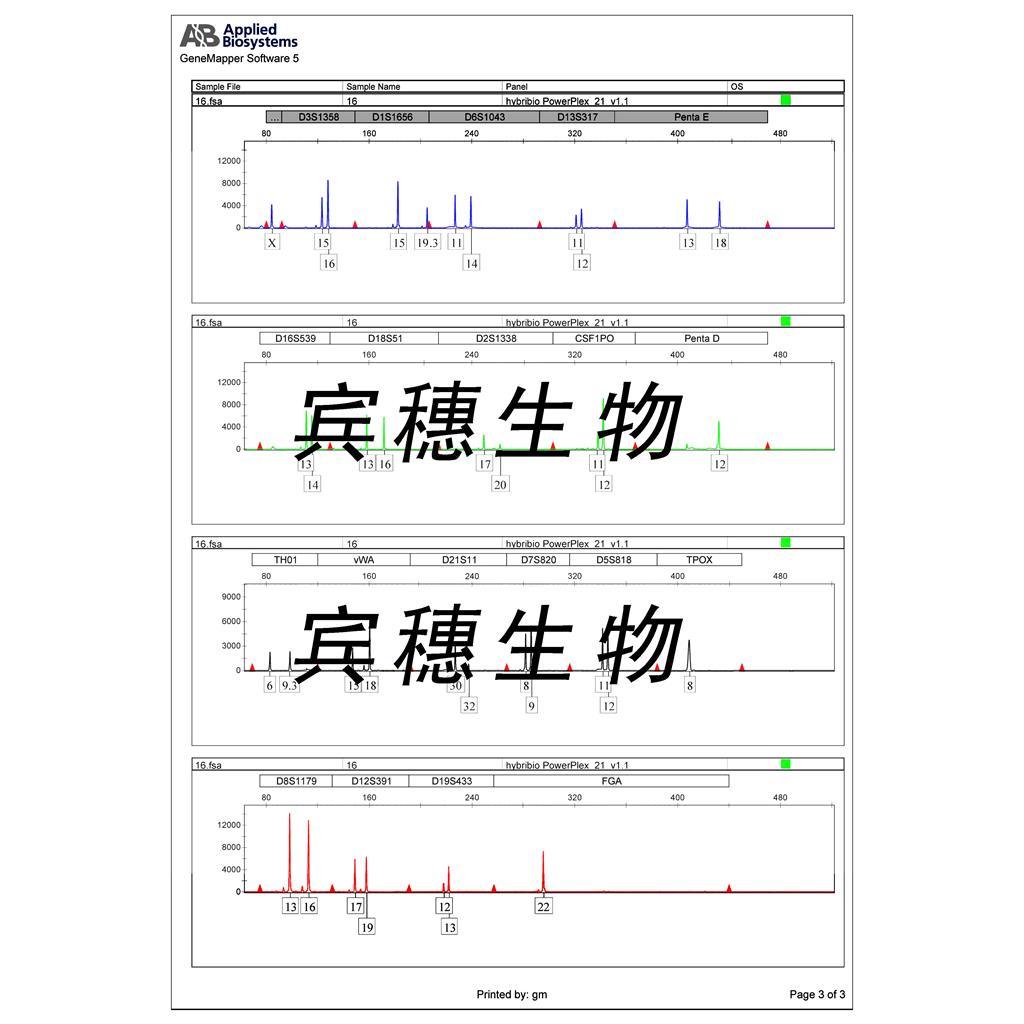
"HCC1954人乳腺导管癌细胞代次低|培养基|送STR图谱
传代比例:1:2-1:4(首次传代建议1:2)
生长特性:贴壁生长
公司细胞系培养稳定、耐活、复苏好,提供人源、鼠源、兔源、猪源等不同组织如肺、气管、支气管、甲状腺、胰腺、垂体、肾上腺、扁桃体、胸腺、肾、膀胱、输尿管、前列腺、心脏、血管等细胞系。全程提供细胞系组织来源、生长特性、细胞形态、背景资料、培养条件、冻存条件、参考文献、运输方式等产品信息及技术服务。
换液周期:每周2-3次
BALB/3T3 (clone A31) Cells;背景说明:胚胎;成纤维;自发永生;雄性;BALB/c;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:OVCAR5细胞、MUTZ3细胞、BNL CL2细胞
UO-31 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:6传代;2-3天换液1次。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:Human Kidney-2细胞、PC2细胞、MC-3T3细胞
TT Cells;背景说明:TT细胞由LeongSS等,自一位77岁白人女性甲状腺髓样癌患者的穿刺活检样本中建立。TT细胞持续产生高水平的降血素和CEA。更换培养基后24h和72h,在培养基中检测到的免疫活性的降血素浓度分别为3900pg/106个细胞和7700pg/106个细胞。72小时后CEA积累浓度超过27ng/106个细胞;该细胞最初是在RPMI1640培养液中培养,可产生神经肽,但还不知道在F12培养液中培养是否会产生。;传代方法:1:3-1:4传代,每周换液2次。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:IEC 6细胞、no.11细胞、GM04154B细胞
HCC1954人乳腺导管癌细胞代次低|培养基|送STR图谱
背景信息:详见相关文献介绍
┈订┈购(技术服务)┈热┈线:1┈3┈6┈4┈1┈9┈3┈0┈7┈9┈1【微信同号】┈Q┈Q:3┈1┈8┈0┈8┈0┈7┈3┈2┈4;
贴壁细胞的传代培养,详细步骤如下:首先倒掉培养基,在这一步骤可以收集一些细胞上清做支原体检测;加入胰蛋白酶,一般T25是加2mL,盖好瓶盖,摇晃T25培养瓶,使胰蛋白酶均匀覆盖在细胞表面,放入培养箱2-3min,期间可在显微镜下观察,看到大部分细胞变圆,即可放入超净台,加入2倍的完全培养基,这里就是加4mL培养基,终止消化;将含有胰蛋白酶,细胞和培养基一起转移到离心管中,1000rpm/3min离心,去掉上清;新鲜的完全培养基重悬,根据细胞的生长特性和后续的实验需求进行传代,比如我养的Hepa1-6就长的比较快,不是着急用的话,我就会按1E6个细胞/T75培养瓶进行传代;但如果后两天要用,就会适当多传一点;还可通过显微镜计数后,直接用于细胞铺板,继续后续的实验。
产品包装:复苏发货:T25培养瓶(一瓶)或冻存发货:1ml冻存管(两支)
来源说明:细胞主要来源ATCC、ECACC、DSMZ、RIKEN等细胞库
HCC1954人乳腺导管癌细胞代次低|培养基|送STR图谱
物种来源:人源、鼠源等其它物种来源
U251MG Cells;背景说明:U-251 MG分离至一位患者的胶质母细胞瘤组织。;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:成纤维细胞样;相关产品有:3AO细胞、Cattle chondrocytes细胞、MCF10A细胞
Bac1 2F5 Cells;背景说明:巨噬细胞;SV40转化;BALB/c x A.CA;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:X63Ag8.653细胞、PanC1细胞、Hu-P-T4细胞
OV 1063 Cells;背景说明:卵巢上皮细胞癌;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Pt K2 (NBL-5)细胞、B6Tert-1细胞、RL细胞
RSC96 Cells;背景说明:雪旺细胞;自发永生;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:PG [Human lung carcinoma]细胞、H-322细胞、Y 1细胞
┈订┈购(技术服务)┈热┈线:1┈3┈6┈4┈1┈9┈3┈0┈7┈9┈1【微信同号】┈Q┈Q:3┈1┈8┈0┈8┈0┈7┈3┈2┈4;
形态特性:上皮细胞样
细胞株(系)的使用,为医学研究和测试工作带来了大的方便。但细胞的传代是有限制的,长期连续传代的细胞,不仅消耗大量的人力和物力,而且细胞的生长与形态等会有一定退变或转化,因而细胞失去原有的遗传性,有时还会由于细胞污染而造成传代中断,种子丢失。因此,在实际工作中常需冻存一定数量的细胞,以备替换使用。细胞冷冻与复苏是细胞培养 室的常规工作和通用技术。目前,细胞冻存Zui常用的技术是冷冻保存法,主要采用加适量保护剂的缓慢冷冻法冻存细胞。细胞在不加任何保护剂的情况下直接冷冻,细胞内外的水分会很快形成冰晶,从而引起一系列不良反应。如细胞脱水使局部电解质浓度增GAO,pH值改变,部分蛋白质由于上述原因而变性,引起细胞内部空间结构紊乱,溶酶体膜由此遭到损伤而释放出溶酶体酶,使细胞内结构成分造成破坏,线粒体肿胀,功能丢失,并造成能量代谢障碍。胞膜上的类脂蛋白复合体也易破坏引起细胞膜通透性的改变,使细胞内容物丢失。如果细胞内冰晶形成较多,随冷冻温度的降低,冰晶体积膨胀造成细胞核DNA空间构型发生不可逆的损伤,而致细胞死亡。因此,细胞冷冻技术的关键是尽可能地减少细胞内水分,减少细胞内冰晶的形成。采用甘油或二甲基亚砜作保护剂,这两种物质分子量小,溶解度大,易穿透细胞,可以使冰点下降,提GAO细胞膜对水的通透性,且对细胞无明显毒性。慢速冷冻方法又可使细胞内的水分渗出细胞外,减少胞内形成冰结晶的机会,从而减少冰晶对细胞的损伤。
UCLA-SO-M20 Cells;背景说明:黑色素瘤;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:HCC-2935细胞、Henrietta Lacks cells细胞、BC-3H-1细胞
Kobe university Oral Squamous Cell culture-2 Cells;背景说明:详见相关文献介绍;传代方法:2.2 x 10^4 cells/ml ;生长特性:贴壁生长;形态特性:上皮样;相关产品有:SHEE细胞、NCI-H660细胞、NS-1-Ag4-1细胞
RCC 786-O Cells;背景说明:该细胞源自一位原发性肾透明细胞癌患者。该细胞有微绒毛和桥粒,能在软琼脂上生长。此细胞生成一种PTH(甲状旁腺素)样的多肽,与乳癌和肺癌中生成的肽相似,其N端序列与PTH相似,具有PTH样活性,分子量为6000D。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:IM95细胞、NCI-H1869细胞、T-84细胞
NCI H82 Cells;背景说明:详见相关文献介绍;传代方法:1:2—1:5传代,每周换液2-3次;生长特性:悬浮生长;形态特性:上皮细胞;相关产品有:SP2/0 Ag-14细胞、SNU668细胞、Clone Y-1细胞
RH-30 Cells;背景说明:肺泡横纹肌肉瘤;骨髓转移;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:IAR-20细胞、SK-N-BE2C细胞、CMT 93细胞
TCam 2 Cells;背景说明:睾丸精原细胞瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:COLO-320-HSR细胞、OCI-Ly 7细胞、LNT-229细胞
HEL-1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:SCC 4细胞、Adeno-293细胞、H2052细胞
NCI-H1836 Cells;背景说明:详见相关文献介绍;传代方法:每周换液2-3次。;生长特性:悬浮生长;形态特性:详见产品说明书;相关产品有:GRSL细胞、WM 266-4细胞、Jurkat 77细胞
NCI-SNU-C2B Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:X63-Ag8细胞、SUM 52细胞、GL261细胞
SKMES Cells;背景说明:源于一位65岁患有肺鳞状细胞癌的白人男性,自转移性胸腔积液分离而来。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:THLE2细胞、HcerEpic细胞、hFOB1.19细胞
T98 Cells;背景说明:胶质瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SUPB-15细胞、CF PAC-1细胞、MV-4-11细胞
H-1954 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:OV 1063细胞、ZR75_1细胞、C-Lu65细胞
C3H/10T1/2 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:JIMT-1细胞、SF763细胞、RTMC细胞
NCI-SNU-C1 Cells;背景说明:详见相关文献介绍;传代方法:每3-5天换液。;生长特性:悬浮生长;形态特性:上皮细胞;相关产品有:SH-SY5Y细胞、HeLa S3细胞、PC-9/GR细胞
NCIH2291 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:4传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:Mouse Colon 38细胞、WB F344细胞、KE37细胞
ZR75_1 Cells;背景说明:该细胞产生高水平的黏液素MUC-1 mRNA,低水平的MUC-2 mRNA,但不表达MUC-3基因;表达雌激素受体。;传代方法:1:4-1:6传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:AML193细胞、CCC-ESF-1细胞、RPMI 2650细胞
ME-1 [Human leukemia] Cells;背景说明:急性髓系白血病;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:Murine Thymic Epithelial Cell line 1细胞、U373MG细胞、NCIH2591细胞
49B2 Cells(提供STR鉴定图谱)
Abcam Jurkat TPD52 KO Cells(提供STR鉴定图谱)
AME-hTERT Cells(提供STR鉴定图谱)
BayGenomics ES cell line RRK198 Cells(提供STR鉴定图谱)
BayGenomics ES cell line XL785 Cells(提供STR鉴定图谱)
CaHo-50 Cells(提供STR鉴定图谱)
DA00554 Cells(提供STR鉴定图谱)
DA06543 Cells(提供STR鉴定图谱)
GM01166 Cells(提供STR鉴定图谱)
HMC Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:CEM-CCRF (CAMR)细胞、624 MEL细胞、GM2132细胞
HCC1954人乳腺导管癌细胞代次低|培养基|送STR图谱
A7r5 Cells;背景说明:培养到稳定期后细胞表现出长高的肌激酶和肌酸激酶活性(CPK)。 细胞分裂终止后合成骨肉型CPK。;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:SKCol1细胞、HuH6细胞、NCI-H64细胞
NTERA-2 cl.D1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:GM02219细胞、HMC3细胞、B16/F1细胞
BC-023 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:PL5细胞、COLO320HSR细胞、Gingival carcinoma Neck Metastasis细胞
U-251 Cells;背景说明:U-251 MG分离至一位患者的胶质母细胞瘤组织。;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:成纤维细胞样;相关产品有:Hs 606细胞、293E细胞、CT26-clone 25细胞
LS123 Cells;背景说明:详见相关文献介绍;传代方法:1:4—1:8传代,每周换液2—3次;生长特性:贴壁生长;形态特性:上皮样;相关产品有:HS-68细胞、A-172 MG细胞、HSMC细胞
338.11.5 Cells(提供STR鉴定图谱)
MLTC-1 Cells;背景说明:睾丸间质瘤;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:MV3细胞、HemECs细胞、SK N SH细胞
Hs 636 T Cells;背景说明:宫颈鳞癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SNG-M细胞、Hs.27细胞、A-101D细胞
H3255_DA Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:HCS2/8细胞、KPL-4细胞、OCI Ly3细胞
HCC-1937 Cells;背景说明:这株细胞1995年10月13日最初来源于原发性导管癌, 用了11.5个月建株。肿瘤分类为TNM IIB期, 3级。BRCA1分析表明这株细胞是BRCA1 5382C突变纯合的, 而来源于同一病人的类淋巴母细胞细胞株在这个突变位点上是杂合的。 另两个家庭成员也有这个突变; 一个同卵双生姐妹也患有乳腺癌。这株细胞有一个后天的TP53突变, 而其野生型等位基因丢失; 一个PTEN基因的后天的纯合缺失, 以及多个与乳腺癌发病机理相关的位点上发生的杂合突变。这株细胞Her2-neu和p53表达都呈阴性。;传代方法:1:2传代;4-5天传代一次。;生长特性:贴壁生长;形态特性:上皮样;多角形;相关产品有:RBMEC细胞、OE21细胞、MDAMB330细胞
H1819 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:HEL细胞、NCI-H446细胞、NCI-H1395细胞
Laboratory of Allergic Diseases 2 Cells;背景说明:肥大 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:SU-DHL-1细胞、Hep 3B2_1-7细胞、GM-215细胞
OCILY7 Cells;背景说明:弥漫大B淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:SNU-520细胞、PT-67细胞、Hs839T细胞
FDC-P1 Cells;背景说明:详见相关文献介绍;传代方法:2-3天换液1次;生长特性:悬浮生长;形态特性:淋巴母细胞;相关产品有:CMT-93细胞、NCTC clone 929细胞、COLO 829细胞
GM12569 Cells(提供STR鉴定图谱)
HAP1 EPOR (-) 1 Cells(提供STR鉴定图谱)
NCIH841 Cells;背景说明:详见相关文献介绍;传代方法:1:3—1:5传代,;生长特性:混合型生长;形态特性:详见产品说明书;相关产品有:C33-A细胞、HARAB细胞、NCI-SNU-761细胞
NCI-H2085 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:6传代 ;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:L-6细胞、H-7721细胞、HT55细胞
SF 763 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:GM2131细胞、RD细胞、HT-29细胞
OSRC2 Cells;背景说明:来源于日本人的肾脏肿瘤细胞。 可以移植到裸鼠。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:GL261细胞、Hep 3B2.1-7细胞、CA-OV-3细胞
R1610 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:H510细胞、Murine Thymic Epithelial Cell line 1细胞、HUT 28细胞
HBZY1 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:VeroE6细胞、Mac-1细胞、LS 174T细胞
MAntle cell VERona-1 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:5传代;2-3天换液1次。;生长特性:悬浮生长;形态特性:淋巴母细胞;相关产品有:CORL88细胞、PASMCS细胞、Tu686细胞
Hut292 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:8传代;2-3天换液1次。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:H650细胞、GM3569细胞、H-841细胞
HiPS-RIKEN-1B Cells(提供STR鉴定图谱)
iPS MS1 Cells(提供STR鉴定图谱)
MB-MK Cells(提供STR鉴定图谱)
ND10525 Cells(提供STR鉴定图谱)
PL-29018 Cells(提供STR鉴定图谱)
Ubigene HeLa RUVBL1 KO Cells(提供STR鉴定图谱)
XP3OS(SVT) Cells(提供STR鉴定图谱)
HE50 Cells(提供STR鉴定图谱)
SKBR-3 Cells;背景说明:这株细胞源自胸水。没有病毒颗粒。亚显微结构特征包括微丝和桥粒,肝糖原颗粒,大溶酶体,成束的细胞质纤丝。SK-BR-3细胞株过表达HER2/c-erb-2基因产物。;传代方法:消化3-5分钟,1:2,3天内可长满;生长特性:贴壁生长;形态特性:上皮样;相关产品有:RPMI 1846细胞、NCIH2085细胞、RT-BM-1细胞
Mv 1 Lu Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:Sf-21细胞、C4-1细胞、RL-65细胞
AZ 521 Cells;背景说明:详见相关文献介绍;传代方法:1:4传代;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:上皮样;相关产品有:A72细胞、H1651细胞、U-343-MG细胞
HN4 Cells;背景说明:喉鳞癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:LA4细胞、MDA361细胞、H-1618细胞
KYSE-50 Cells;背景说明:食管鳞癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Hs604T细胞、Calu 3细胞、SW 620细胞
NCIH1105 Cells;背景说明:详见相关文献介绍;传代方法:每周换液2-3次;生长特性:悬浮生长;形态特性:详见产品说明书;相关产品有:ST 486细胞、CT26.WT细胞、H-1299细胞
Leukemic 1210 Cells;背景说明:该细胞源于用0.2%甲基胆蒽(溶解)涂抹雌性小鼠的皮肤诱发的肿瘤,鼠痘病毒阴性。;传代方法:1:2传代;生长特性:悬浮生长;形态特性:淋巴母细胞样;相关产品有:NCI-H2108细胞、H-1693细胞、Co320细胞
870 Cells;背景说明:儿童急性髓系白血病;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:H1650细胞、BTI-Tn5B14细胞、EFO 27细胞
End1/E6E7 Cells;背景说明:子宫内膜;女性;HPV16转化;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Vero E6细胞、HECCL-1细胞、H1869细胞
SUDHL-4 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:淋巴母细胞;相关产品有:NCI H345细胞、NW-MEL-38细胞、H-676B细胞
NCIH1373 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:4传代;2-3天换液1次。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:H774细胞、BAR-T细胞、OVTOKO细胞
NCI-H146 Cells;背景说明:详见相关文献介绍;传代方法:1:2—1:6传代,每周换液2-3次;生长特性:悬浮生长;形态特性:上皮细胞;相关产品有:B16-F10细胞、HCC1143细胞、DLD-1细胞
Vero Cells;背景说明:Vero细胞株是日本千叶大学的YasumuraY和KawakitaY从正常成年非洲绿猴的肾脏组织中分离建立的。该细胞常作为转染宿主,用于支原体的检测。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:H3255细胞、A-375SM细胞、32D.3细胞
D407 RPE Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:NCI H508细胞、SuDHL 10细胞、GM05384细胞
Karpas299 Cells;背景说明:间变性大细胞淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:DAN-G细胞、PL-11细胞、MDAPCa2b细胞
Sg4 Cells(提供STR鉴定图谱)
COLO824 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:U87MG细胞、G422细胞、H146细胞
IGROV-1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:G361细胞、PC-9/GR细胞、RPE-1细胞
H1792 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:8传代。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:IM9细胞、Caco-2BBe细胞、MRC-V细胞
NCIH748 Cells;背景说明:详见相关文献介绍;传代方法:3-4天换液1次。;生长特性:悬浮生长 ;形态特性:详见产品说明书;相关产品有:A375S2细胞、Central Adrenergic TH-expressing a细胞、SUDHL-10细胞
H2.35 Cells;背景说明:肝;SV40转化;雌性;BALB/c;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:LNT-229细胞、CCD1112Sk细胞、Karpas 299细胞
T47-D Cells;背景说明:浸润性导管癌;胸腔积液转移;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:L 1210细胞、EFM-19细胞、CAL 33细胞
HCC1954人乳腺导管癌细胞代次低|培养基|送STR图谱
SK-NSH Cells;背景说明:SK-N-SH细胞系由J.L.Bieder建系,它与SK-N-MC所不同的是倍增时间较长且多巴胺-β-羟基酶水平较高。 SK-N-SH在细胞介导的细胞毒性试验中用作靶细胞系。;传代方法:1:2传代;生长特性:悬浮生长;形态特性:上皮细胞样;相关产品有:COV-362细胞、HCC 38细胞、C4-1细胞
Neuro2a Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:4传代;2-3天换液1次;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:DKMG细胞、IPAM-WT细胞、H-1651细胞
H64 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:EC109细胞、NCI H82细胞、PLC PRF 5细胞
KP2 Cells;背景说明:胰腺癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Hs832.Tc细胞、9L细胞、Tu 212细胞
HBZY1 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:VeroE6细胞、NCI-H838细胞、293GP细胞
NPA87 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:DU 145细胞、HEK-293-EBNA细胞、SK-NMC细胞
MOLT 4 Cells;背景说明:MOLT-4与MOLT-3来源于一名19岁的男性急性淋巴细胞性白血病的复发患者,该患者前期接受过多种药物联合化疗。MOLT-4细胞系为T淋巴细胞起源,p53基因的第248位密码子有一个G→A突变,不表达p53,不表达免疫球蛋白或EB病毒;可产生高水平的末端脱氧核糖转移酶;表达CD1(49%),CD2(35%),CD3A(26%)B(33%)C(34%),CD4(55%),CD5(72%),CD6(22%),CD7(77%)。;传代方法:1:2传代;生长特性:悬浮生长;形态特性:淋巴母细胞样;圆形;相关产品有:HS 1.Tes细胞、HEI-193细胞、CAL62细胞
HRCEC Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:MIA Paca2细胞、PE/CA-PJ34细胞、NUGC-2细胞
BayGenomics ES cell line RRK006 Cells(提供STR鉴定图谱)
BayGenomics ES cell line XL004 Cells(提供STR鉴定图谱)
G5B1 Cells(提供STR鉴定图谱)
NS20Y-BU-7 Cells(提供STR鉴定图谱)
Y1-Forsk-10r-6 Cells(提供STR鉴定图谱)
McNRAS2 Cells(提供STR鉴定图谱)
" "PubMed=17157791; DOI=10.1016/j.ccr.2006.10.008; PMCID=PMC2730521
Neve R.M., Chin K., Fridlyand J., Yeh J., Baehner F.L., Fevr T., Clark L., Bayani N., Coppe J.-P., Tong F., Speed T., Spellman P.T., DeVries S., Lapuk A., Wang N.J., Kuo W.-L., Stilwell J.L., Pinkel D., Albertson D.G., Waldman F.M., McCormick F., Dickson R.B., Johnson M.D., Lippman M.E., Ethier S.P., Gazdar A.F., Gray J.W.
A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes.
Cancer Cell 10:515-527(2006)
PubMed=17932254; DOI=10.1126/science.1145720
Wood L.D., Parsons D.W., Jones S., Lin J., Sjoblom T., Leary R.J., Shen D., Boca S.M., Barber T.D., Ptak J., Silliman N., Szabo S., Dezso Z., Ustyanksky V., Nikolskaya T., Nikolsky Y., Karchin R., Wilson P.A., Kaminker J.S., Zhang Z.-M., Croshaw R., Willis J.E., Dawson D., Shipitsin M., Willson J.K.V., Sukumar S., Polyak K., Park B.H., Pethiyagoda C.L., Pant P.V.K., Ballinger D.G., Sparks A.B., Hartigan J., Smith D.R., Suh E., Papadopoulos N., Buckhaults P., Markowitz S.D., Parmigiani G., Kinzler K.W., Velculescu V.E., Vogelstein B.
The genomic landscapes of human breast and colorectal cancers.
Science 318:1108-1113(2007)
PubMed=19582160; DOI=10.1371/journal.pone.0006146; PMCID=PMC2702084
Kao J., Salari K., Bocanegra M., Choi Y.-L., Girard L., Gandhi J., Kwei K.A., Hernandez-Boussard T., Wang P., Gazdar A.F., Minna J.D., Pollack J.R.
Molecular profiling of breast cancer cell lines defines relevant tumor models and provides a resource for cancer gene discovery.
PLoS ONE 4:E6146-E6146(2009)
PubMed=20070913; DOI=10.1186/1471-2407-10-15; PMCID=PMC2836299
Tsuji K., Kawauchi S., Saito S., Furuya T., Ikemoto K., Nakao M., Yamamoto S., Oka M., Hirano T., Sasaki K.
Breast cancer cell lines carry cell line-specific genomic alterations that are distinct from aberrations in breast cancer tissues: comparison of the CGH profiles between cancer cell lines and primary cancer tissues.
BMC Cancer 10:15.1-15.10(2010)
PubMed=20164919; DOI=10.1038/nature08768; PMCID=PMC3145113
Bignell G.R., Greenman C.D., Davies H.R., Butler A.P., Edkins S., Andrews J.M., Buck G., Chen L., Beare D., Latimer C., Widaa S., Hinton J., Fahey C., Fu B.-Y., Swamy S., Dalgliesh G.L., Teh B.T., Deloukas P., Yang F.-T., Campbell P.J., Futreal P.A., Stratton M.R.
Signatures of mutation and selection in the cancer genome.
Nature 463:893-898(2010)
PubMed=20215515; DOI=10.1158/0008-5472.CAN-09-3458; PMCID=PMC2881662
Rothenberg S.M., Mohapatra G., Rivera M.N., Winokur D., Greninger P., Nitta M., Sadow P.M., Sooriyakumar G., Brannigan B.W., Ulman M.J., Perera R.M., Wang R., Tam A., Ma X.-J., Erlander M., Sgroi D.C., Rocco J.W., Lingen M.W., Cohen E.E.W., Louis D.N., Settleman J., Haber D.A.
A genome-wide screen for microdeletions reveals disruption of polarity complex genes in diverse human cancers.
Cancer Res. 70:2158-2164(2010)
PubMed=21378333
Ford C.H.J., Al-Bader M., Al-Ayadhi B., Francis I.
Reassessment of estrogen receptor expression in human breast cancer cell lines.
Anticancer Res. 31:521-527(2011)
PubMed=22460905; DOI=10.1038/nature11003; PMCID=PMC3320027
Barretina J.G., Caponigro G., Stransky N., Venkatesan K., Margolin A.A., Kim S., Wilson C.J., Lehar J., Kryukov G.V., Sonkin D., Reddy A., Liu M., Murray L., Berger M.F., Monahan J.E., Morais P., Meltzer J., Korejwa A., Jane-Valbuena J., Mapa F.A., Thibault J., Bric-Furlong E., Raman P., Shipway A., Engels I.H., Cheng J., Yu G.-Y.K., Yu J.-J., Aspesi P. Jr., de Silva M., Jagtap K., Jones M.D., Wang L., Hatton C., Palescandolo E., Gupta S., Mahan S., Sougnez C., Onofrio R.C., Liefeld T., MacConaill L.E., Winckler W., Reich M., Li N.-X., Mesirov J.P., Gabriel S.B., Getz G., Ardlie K., Chan V., Myer V.E., Weber B.L., Porter J., Warmuth M., Finan P., Harris J.L., Meyerson M.L., Golub T.R., Morrissey M.P., Sellers W.R., Schlegel R., Garraway L.A.
The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity.
Nature 483:603-607(2012)
PubMed=22585861; DOI=10.1158/2159-8290.CD-11-0224; PMCID=PMC5057396
Marcotte R., Brown K.R., Suarez Saiz F.J., Sayad A., Karamboulas K., Krzyzanowski P.M., Sircoulomb F., Medrano M., Fedyshyn Y., Koh J.L.-Y., van Dyk D., Fedyshyn B., Luhova M., Brito G.C., Vizeacoumar F.J., Vizeacoumar F.S., Datti A., Kasimer D., Buzina A., Mero P., Misquitta C., Normand J., Haider M., Ketela T., Wrana J.L., Rottapel R., Neel B.G., Moffat J.
Essential gene profiles in breast, pancreatic, and ovarian cancer cells.
Cancer Discov. 2:172-189(2012)
PubMed=23151021; DOI=10.1186/1471-2164-13-619; PMCID=PMC3546428
Grigoriadis A., Mackay A., Noel E., Wu P.-J., Natrajan R., Frankum J., Reis-Filho J.S., Tutt A.
Molecular characterisation of cell line models for triple-negative breast cancers.
BMC Genomics 13:619.1-619.14(2012)
PubMed=23601657; DOI=10.1186/bcr3415; PMCID=PMC3672661
Riaz M., van Jaarsveld M.T.M., Hollestelle A., Prager-van der Smissen W.J.C., Heine A.A.J., Boersma A.W.M., Liu J.-J., Helmijr J.C.A., Ozturk B., Smid M., Wiemer E.A.C., Foekens J.A., Martens J.W.M.
miRNA expression profiling of 51 human breast cancer cell lines reveals subtype and driver mutation-specific miRNAs.
Breast Cancer Res. 15:R33.1-R33.17(2013)
PubMed=23637631; DOI=10.1371/journal.pgen.1003464; PMCID=PMC3636093
Giacomini C.P., Sun S., Varma S., Shain A.H., Giacomini M.M., Balagtas J.M.S., Sweeney R.T., Lai E., Del Vecchio C.A., Forster A.D., Clarke N., Montgomery K.D., Zhu S., Wong A.J., van de Rijn M., West R.B., Pollack J.R.
Breakpoint analysis of transcriptional and genomic profiles uncovers novel gene fusions spanning multiple human cancer types.
PLoS Genet. 9:E1003464-E1003464(2013)
PubMed=24094812; DOI=10.1016/j.ccr.2013.08.020; PMCID=PMC3931310
Timmerman L.A., Holton T., Yuneva M., Louie R.J., Padro M., Daemen A., Hu M., Chan D.A., Ethier S.P., van 't Veer L.J., Polyak K., McCormick F., Gray J.W.
Glutamine sensitivity analysis identifies the xCT antiporter as a common triple-negative breast tumor therapeutic target.
Cancer Cell 24:450-465(2013)
PubMed=24162158; DOI=10.1007/s10549-013-2743-3; PMCID=PMC3832776
Prat A., Karginova O., Parker J.S., Fan C., He X.-P., Bixby L.M., Harrell J.C., Roman E., Adamo B., Troester M.A., Perou C.M.
Characterization of cell lines derived from breast cancers and normal mammary tissues for the study of the intrinsic molecular subtypes.
Breast Cancer Res. Treat. 142:237-255(2013)
PubMed=24176112; DOI=10.1186/gb-2013-14-10-r110; PMCID=PMC3937590
Daemen A., Griffith O.L., Heiser L.M., Wang N.J., Enache O.M., Sanborn Z., Pepin F., Durinck S., Korkola J.E., Griffith M., Hur J.S., Huh N., Chung J., Cope L., Fackler M.J., Umbricht C.B., Sukumar S., Seth P., Sume V.P., Jakkula L.R., Lu Y.-L., Mills G.B., Cho R.J., Collisson E.A., van 't Veer L.J., Spellman P.T., Gray J.W.
Modeling precision treatment of breast cancer.
Genome Biol. 14:R110.1-R110.14(2013)
PubMed=25960936; DOI=10.4161/21624011.2014.954893; PMCID=PMC4355981
Boegel S., Lower M., Bukur T., Sahin U., Castle J.C.
A catalog of HLA type, HLA expression, and neo-epitope candidates in human cancer cell lines.
OncoImmunology 3:e954893.1-e954893.12(2014)
PubMed=25984343; DOI=10.1038/sdata.2014.35; PMCID=PMC4432652
Cowley G.S., Weir B.A., Vazquez F., Tamayo P., Scott J.A., Rusin S., East-Seletsky A., Ali L.D., Gerath W.F.J., Pantel S.E., Lizotte P.H., Jiang G.-Z., Hsiao J., Tsherniak A., Dwinell E., Aoyama S., Okamoto M., Harrington W., Gelfand E.T., Green T.M., Tomko M.J., Gopal S., Wong T.C., Li H.-B., Howell S., Stransky N., Liefeld T., Jang D., Bistline J., Meyers B.H., Armstrong S.A., Anderson K.C., Stegmaier K., Reich M., Pellman D., Boehm J.S., Mesirov J.P., Golub T.R., Root D.E., Hahn W.C.
Parallel genome-scale loss of function screens in 216 cancer cell lines for the identification of context-specific genetic dependencies.
Sci. Data 1:140035-140035(2014)
PubMed=25485619; DOI=10.1038/nbt.3080
Klijn C., Durinck S., Stawiski E.W., Haverty P.M., Jiang Z.-S., Liu H.-B., Degenhardt J., Mayba O., Gnad F., Liu J.-F., Pau G., Reeder J., Cao Y., Mukhyala K., Selvaraj S.K., Yu M.-M., Zynda G.J., Brauer M.J., Wu T.D., Gentleman R.C., Manning G., Yauch R.L., Bourgon R., Stokoe D., Modrusan Z., Neve R.M., de Sauvage F.J., Settleman J., Seshagiri S., Zhang Z.-M.
A comprehensive transcriptional portrait of human cancer cell lines.
Nat. Biotechnol. 33:306-312(2015)
PubMed=25877200; DOI=10.1038/nature14397
Yu M., Selvaraj S.K., Liang-Chu M.M.Y., Aghajani S., Busse M., Yuan J., Lee G., Peale F.V., Klijn C., Bourgon R., Kaminker J.S., Neve R.M.
A resource for cell line authentication, annotation and quality control.
Nature 520:307-311(2015)
PubMed=26589293; DOI=10.1186/s13073-015-0240-5; PMCID=PMC4653878
Scholtalbers J., Boegel S., Bukur T., Byl M., Goerges S., Sorn P., Loewer M., Sahin U., Castle J.C.
TCLP: an online cancer cell line catalogue integrating HLA type, predicted neo-epitopes, virus and gene expression.
Genome Med. 7:118.1-118.7(2015)
PubMed=27397505; DOI=10.1016/j.cell.2016.06.017; PMCID=PMC4967469
Iorio F., Knijnenburg T.A., Vis D.J., Bignell G.R., Menden M.P., Schubert M., Aben N., Goncalves E., Barthorpe S., Lightfoot H., Cokelaer T., Greninger P., van Dyk E., Chang H., de Silva H., Heyn H., Deng X.-M., Egan R.K., Liu Q.-S., Miroo T., Mitropoulos X., Richardson L., Wang J.-H., Zhang T.-H., Moran S., Sayols S., Soleimani M., Tamborero D., Lopez-Bigas N., Ross-Macdonald P., Esteller M., Gray N.S., Haber D.A., Stratton M.R., Benes C.H., Wessels L.F.A., Saez-Rodriguez J., McDermott U., Garnett M.J.
A landscape of pharmacogenomic interactions in cancer.
Cell 166:740-754(2016)
PubMed=28196595; DOI=10.1016/j.ccell.2017.01.005; PMCID=PMC5501076
Li J., Zhao W., Akbani R., Liu W.-B., Ju Z.-L., Ling S.-Y., Vellano C.P., Roebuck P., Yu Q.-H., Eterovic A.K., Byers L.A., Davies M.A., Deng W.-L., Gopal Y.N.V., Chen G., von Euw E.M., Slamon D.J., Conklin D., Heymach J.V., Gazdar A.F., Minna J.D., Myers J.N., Lu Y.-L., Mills G.B., Liang H.
Characterization of human cancer cell lines by reverse-phase protein arrays.
Cancer Cell 31:225-239(2017)
PubMed=28287265; DOI=10.1021/acs.jproteome.6b00470; PMCID=PMC5557415
Yen T.-Y., Bowen S., Yen R., Piryatinska A., Macher B.A., Timpe L.C.
Glycoproteins in claudin-low breast cancer cell lines have a unique expression profile.
J. Proteome Res. 16:1391-1400(2017)
PubMed=28889351; DOI=10.1007/s10549-017-4496-x
Saunus J.M., Smart C.E., Kutasovic J.R., Johnston R.L., Kalita-de Croft P., Miranda M., Rozali E.N., Vargas A.C., Reid L.E., Lorsy E., Cocciardi S., Seidens T., McCart Reed A.E., Dalley A.J., Wockner L.F., Johnson J., Sarkar D., Askarian-Amiri M.E., Simpson P.T., Khanna K.K., Chenevix-Trench G., Al-Ejeh F., Lakhani S.R.
Multidimensional phenotyping of breast cancer cell lines to guide preclinical research.
Breast Cancer Res. Treat. 167:289-301(2018)
PubMed=29273624; DOI=10.1101/gr.226019.117; PMCID=PMC5793780
Franco H.L., Nagari A., Malladi V.S., Li W.-Q., Xi Y.-X., Richardson D., Allton K.L., Tanaka K., Li J., Murakami S., Keyomarsi K., Bedford M.T., Shi X.-B., Li W., Barton M.C., Dent S.Y.R., Kraus W.L.
Enhancer transcription reveals subtype-specific gene expression programs controlling breast cancer pathogenesis.
Genome Res. 28:159-170(2018)
PubMed=30894373; DOI=10.1158/0008-5472.CAN-18-2747; PMCID=PMC6445675
Dutil J., Chen Z.-H., Monteiro A.N.A., Teer J.K., Eschrich S.A.
An interactive resource to probe genetic diversity and estimated ancestry in cancer cell lines.
Cancer Res. 79:1263-1273(2019)
PubMed=30971826; DOI=10.1038/s41586-019-1103-9
Behan F.M., Iorio F., Picco G., Goncalves E., Beaver C.M., Migliardi G., Santos R., Rao Y., Sassi F., Pinnelli M., Ansari R., Harper S., Jackson D.A., McRae R., Pooley R., Wilkinson P., van der Meer D.J., Dow D., Buser-Doepner C.A., Bertotti A., Trusolino L., Stronach E.A., Saez-Rodriguez J., Yusa K., Garnett M.J.
Prioritization of cancer therapeutic targets using CRISPR-Cas9 screens.
Nature 568:511-516(2019)"