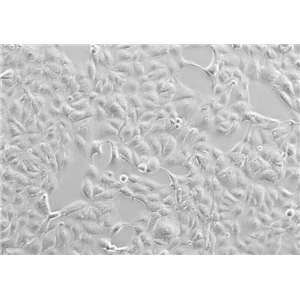
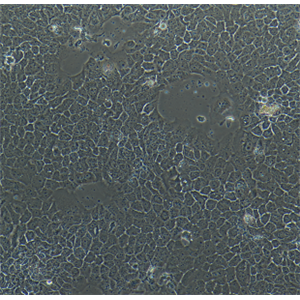
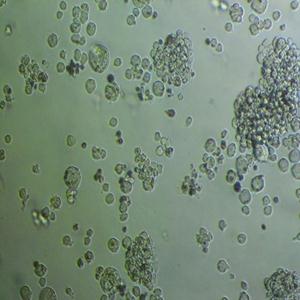
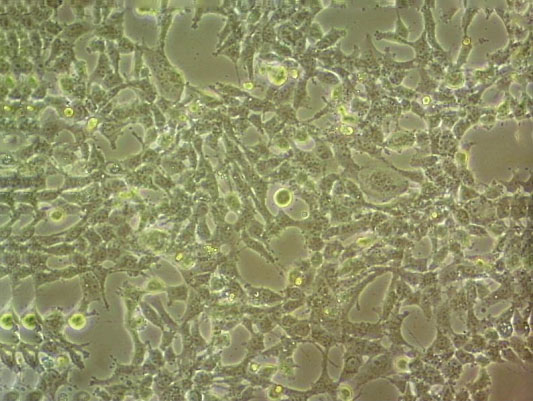
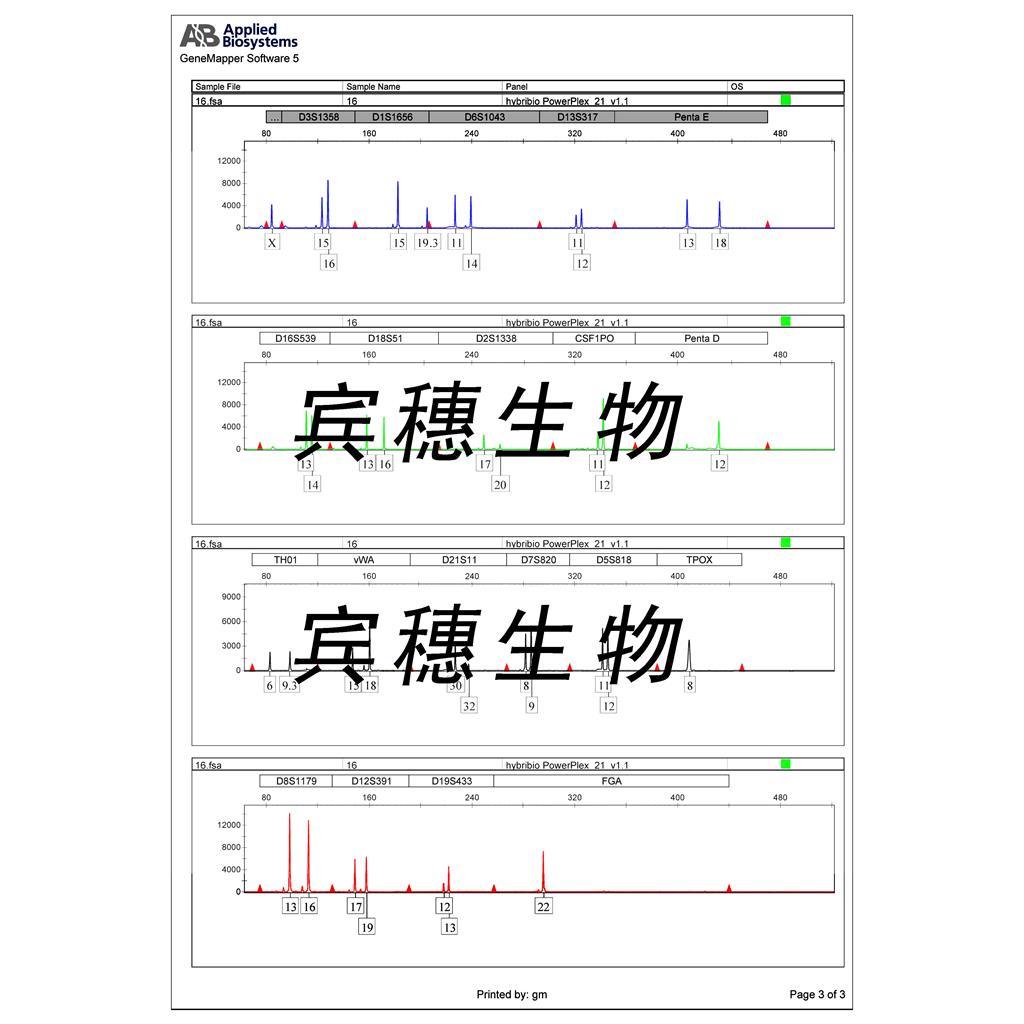
"NALM-6人B淋巴白血病细胞代次低|培养基|送STR图谱
传代比例:1:2-1:4(首次传代建议1:2)
生长特性:悬浮生长
公司细胞系形态漂亮、增殖倍数高、纯度高、功能性强,细胞培养就跟养孩子一个样。养孩子要喂奶,养细胞要加补液,都需要在前期补充足够的营养,初始状态的细胞或刚刚复苏的细胞还要适量加入血清或细胞因子来帮助它们的存活增殖,如果营养物质缺乏,细胞就会不生长甚至死亡。养孩子要从小培养学习,养细胞也得培养宝宝顺利生下来,你会经常抚摸他,给他看各种颜色,刺激他的五感。细胞也是一样,分离后的细胞需要使用特定的细胞因子进行活化、增殖。另外加入因子的种类、因子的浓度、加入时间、加入顺序都会影响细胞最终的结果。养孩子最怕孩子生病,养细胞最怕被污染,平时你会仔细观察宝宝是否呕吐、是否突然哭闹,猜测宝宝是否生病了。对于细胞,我们也需要时刻进行观察的,假如培养液浑浊(污染了),则需要换液后加抗生素;假如细胞增殖不明显,形态变差,则可能是因为营养不足了,对贴壁细胞可以消化后重新用新的培养基接种并加倍加入细胞因子含量;对悬浮细胞增殖能力不强的,则不着急补液,只是先补加血清、细胞因子看是否可以好转。培养时还得全程在无菌的环境,一个小小的偏差,细胞就会死亡。
换液周期:每周2-3次
CCD 841 CoN Cells;背景说明:结肠上皮细胞;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SUD4细胞、DF-1细胞、GM05887A细胞
RAMOS2G64C10 Cells;背景说明:详见相关文献介绍;传代方法: 维持细胞浓度在2×105/ml-1×106/ml;根据细胞浓度每2-3天补液1次。;生长特性:悬浮生长 ;形态特性:淋巴母细胞样;相关产品有:McCoy细胞、MADB106细胞、U-87MG细胞
SNU16 Cells;背景说明:详见相关文献介绍;传代方法:3-4天换液1次。;生长特性:悬浮聚集;形态特性:上皮细胞;相关产品有:CAL39细胞、FL 62891细胞、RIN14B细胞
NALM-6人B淋巴白血病细胞代次低|培养基|送STR图谱
背景信息:急性B淋巴细胞白血病;男性
┈订┈购(技术服务)┈热┈线:1┈3┈6┈4┈1┈9┈3┈0┈7┈9┈1【微信同号】┈Q┈Q:3┈1┈8┈0┈8┈0┈7┈3┈2┈4;
ATCC细胞库(American Type Culture Colection),该中心一直致力于细胞分类、鉴定和保藏工作。ATCC是全球最大的生物资源保藏中心,ATCC通过行业标准产品、服务和创新解决方案支持全球学术、政府、生物技术、制药、食品、农业和工业领域的科学进步。ATCC提供的服务和定制解决方案包括细胞和微生物培养、鉴定、生物衍生物的开发和生产、性能测试和生物资源保藏服务。美国国家标准协会(ANSI)认可了ATCC标准开发组织,并制定了标准协议,以确保生物材料的可靠性和可重复性。ATCC的使命是为了获取、鉴定、保存、开发、标准化和分发生物资源和生物信息,以提高和应用生物科学知识。
产品包装:复苏发货:T25培养瓶(一瓶)或冻存发货:1ml冻存管(两支)
来源说明:细胞主要来源ATCC、ECACC、DSMZ、RIKEN等细胞库
NALM-6人B淋巴白血病细胞代次低|培养基|送STR图谱
物种来源:人源、鼠源等其它物种来源
OLN-93 Cells;背景说明:胶质细胞;自发永生;Wistar;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SRA 01/04细胞、C3H/10T1/2细胞、NS1/1-Ag4.1细胞
Hs695 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:4传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:NB4细胞、C-33-A细胞、M109细胞
HS0578T Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:L cells (TK-)细胞、TK 10细胞、MGc80-3细胞
CEM-C7 Cells;背景说明:急性T淋巴细胞白血病;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:CAL120细胞、NOMO-1细胞、Farage OL细胞
┈订┈购(技术服务)┈热┈线:1┈3┈6┈4┈1┈9┈3┈0┈7┈9┈1【微信同号】┈Q┈Q:3┈1┈8┈0┈8┈0┈7┈3┈2┈4;
形态特性:淋巴母细胞样
细胞冻存复苏材料与方法步骤:常用的细胞冷冻贮存器为贮存器,规格有35L和50L两种。使用时要注意以下几点:(1)一般两周需充一次,至少一个月充一次。温度达-196℃,使用时注意勿让溅到皮肤上,以免引起冻伤。(2)容器为双层结构,中间为真空层,瓶口有双层焊接处,应防止焊接部裂开。(3)在装入时,要注意缓慢小心,并用厚纸卷筒或制漏斗作引导,使直达瓶底,如有专用灌注装置则更HAO。若为初次使用,加时更要缓慢,以免温度骤降而使容器损坏。细胞冻存时常备的材料有:0.25%胰蛋白酶,含10%~20%的血清培养,DMSO(分析纯)或无色新鲜甘油(121°C蒸气GAO压消毒),2mL安瓿(或专用细胞冻存管)、吸管、离心管、喷灯、纱布袋(或冻存管架)等。主要操作步骤为:(1)选择处于对数生长期的细胞,在冻存前一天ZuiHAO换。将多个培养瓶中的细胞培养 去掉,用0.25%胰蛋白酶消化。适时去掉胰蛋白酶,加入少量新培养。用吸管吸取培养反复吹打瓶壁上的细胞,使其成为均匀分散的细胞悬。悬浮生产细胞则不要消化处理。然后将细胞收集于离心管中离心(1000r/min,10分钟)。(2)去上清,加入含20%小牛血清的完全培养基,于4℃预冷15分钟后,逐滴加入已无菌的DMSO或甘油,用吸管轻轻吹打使细胞均匀,细胞浓度为3×106~1×107/mL之间。(3)将上述细胞分装于安瓿或专用冷冻塑料管中,安瓿装1~1.5mL在火焰喷灯上封口,封口处要完全封闭,圆滑无勾。冷冻管要将盖子盖紧,并标记HAO细胞名称和冻存日期,同时作HAO登记(日期、细胞种类及代次、冻存支数)。(4)将装HAO细胞的安瓿或冻存管装入沙布袋内;置于容器颈口处存放过夜,次日转入中。采用控制降温速度的方法也可采用下列步骤:先将安瓿置入4℃冰箱中2~3小时,再移至冰箱冷冻室内3~4小时,再吊入容器颈气态部分存放2小时,Zui后沉入中。细胞冻存在中可以长期保存,但为妥善起见,冻存半年后,ZuiHAO取出一只安瓿细胞复苏培养,观察生长情况,然后再继续冻存。
A431/P Cells;背景说明:该细胞源自一位患有皮肤鳞状细胞癌的85岁女性,是GiardDJ等人建立的一系列细胞株中的一株。该细胞在免疫抑制小鼠体内可成瘤,在琼脂上培养可形成克隆;是一个超三倍体人细胞株。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:NCIH2135细胞、MCF12F细胞、LMTK-细胞
H82sclc Cells;背景说明:详见相关文献介绍;传代方法:1:2—1:5传代,每周换液2-3次;生长特性:悬浮生长;形态特性:上皮细胞;相关产品有:Y 1细胞、SCC-4细胞、Pro-5WgaRI3C细胞
CEM-C1 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:Reuber H35细胞、AG06814-J细胞、Hs 729细胞
NCIH740 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:95C细胞、NCI-H3255细胞、CCC-HHM-2细胞
LSECs Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:NCI-H295细胞、QGY7701细胞、DHL10细胞
HPDLF Cells;背景说明:牙周膜;成纤维 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:HCC2935细胞、MLO-Y4细胞、J774 A.1细胞
VMRCLCD Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:L-5178-Y-R细胞、PaTu-8988s细胞、Astrocyte type I clone细胞
HUSMC Cells;背景说明:子宫;平滑肌细胞;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:H-847细胞、Hep G2细胞、COLO 320F细胞
COLO.205 Cells;背景说明:该细胞系是1957年由T.U.Sample等从患有结肠癌的70岁男性白人的腹水中分离的。该病人在取腹水样品前已用5-尿嘧啶治疗4~6周。角蛋白免疫过氧化物酶染色阳性;产生CEA、IL10。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:PC3细胞、RCM1细胞、NCI-1155细胞
NCI-H2023 Cells;背景说明:详见相关文献介绍;传代方法:每周换液2次;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:G-292细胞、Stanford University-Diffuse Histiocytic Lymphoma-5细胞、HOS (TE85)细胞
HEp-2 Cells;背景说明:最初认为这个细胞源自喉上皮癌,但随后通过同功酶分析、HeLa标记染色体和DNA指纹分析发现,起源细胞已被HeLa污染。 角蛋白免疫过氧化物酶染色阳性。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:Jurkat-E6细胞、HCC38细胞、beta TC6细胞
H508 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:ADR-RES细胞、U 138 MG细胞、H-1819细胞
H1770 Cells;背景说明:详见相关文献介绍;传代方法:随细胞的生长而换液;生长特性:悬浮生长;形态特性:详见产品说明书;相关产品有:H-209细胞、HuH1细胞、Ku812细胞
T98-G Cells;背景说明:详见相关文献介绍;传代方法:按1:3传代;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:H-28细胞、D341 Med细胞、OV1/P细胞
TOV-112 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代,3-4天换液1次。;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:SW-626细胞、RWPE2细胞、RCSMC细胞
OKT 3 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:SNU-638细胞、ROS17/2.8细胞、SK-N-BE(2)-M17细胞
NG-108-15 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:TC-1 [Mouse lung]细胞、CL11细胞、BNL CL.2细胞
Abcam A-549 OAS3 KO Cells(提供STR鉴定图谱)
AC1-1 Cells(提供STR鉴定图谱)
BayGenomics ES cell line CSH053 Cells(提供STR鉴定图谱)
BayGenomics ES cell line RRU422 Cells(提供STR鉴定图谱)
BBdF-1 Cells(提供STR鉴定图谱)
CHO-hGluN1-hGluN2D Cells(提供STR鉴定图谱)
DA02529 Cells(提供STR鉴定图谱)
DA05485 Cells(提供STR鉴定图谱)
Genomeditech HCT116 H_CDH17 Cells(提供STR鉴定图谱)
OCILY7 Cells;背景说明:弥漫大B淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:SNU-520细胞、PT-67细胞、Hs839T细胞
NALM-6人B淋巴白血病细胞代次低|培养基|送STR图谱
RAT2 Cells;背景说明:成纤维细胞;自发永生;Fischer 344;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Rat 2细胞、Walker256细胞、P31 FUJ细胞
LTEPa2 Cells;背景说明:肺腺癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SNU-484细胞、PTK-1细胞、MADB106细胞
Tb 1 Lu Cells;背景说明:肺;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:MCF.10A细胞、BEL 7402细胞、NHRF细胞
COLO 206 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:H-1650细胞、MC-3T3-E1细胞、HEC-1-A细胞
GM02219D Cells;背景说明:MOLT-4与MOLT-3来源于一名19岁的男性急性淋巴细胞性白血病的复发患者,该患者前期接受过多种药物联合化疗。MOLT-4细胞系为T淋巴细胞起源,p53基因的第248位密码子有一个G→A突变,不表达p53,不表达免疫球蛋白或EB病毒;可产生高水平的末端脱氧核糖转移酶;表达CD1(49%),CD2(35%),CD3A(26%)B(33%)C(34%),CD4(55%),CD5(72%),CD6(22%),CD7(77%)。;传代方法:1:2传代;生长特性:悬浮生长;形态特性:淋巴母细胞样;圆形;相关产品有:RMa-bm细胞、WSU-DLCL2细胞、HFT8810细胞
1E9A4A4 Cells(提供STR鉴定图谱)
MES-SA Cells;背景说明:详见相关文献介绍;传代方法:1:6-1:8传代;每周2-3次。;生长特性:贴壁生长;形态特性:成纤维细胞样 ;相关产品有:MCF-12A细胞、SUNE 1细胞、6-10B细胞
MonoMac6 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:悬浮生长;形态特性:淋巴母细胞;相关产品有:DMS53细胞、SUM190细胞、NCI-H810细胞
BEND Cells;背景说明:子宫内膜;上皮细胞;雌性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SJ-Rh 30细胞、HBMEC细胞、MOLP-2细胞
KM.12 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:HFLS细胞、GM02131细胞、SK HEP 01细胞
IHC-ST1 Cells;背景说明:肝内胆管癌;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Be-Wo细胞、H-3255细胞、HPC-Y5细胞
SKRC-42 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:H-1618细胞、Ra No. 1细胞、NK-92MI细胞
NCIH82 Cells;背景说明:详见相关文献介绍;传代方法:1:2—1:5传代,每周换液2-3次;生长特性:悬浮生长;形态特性:上皮细胞;相关产品有:HT55细胞、NTera 2细胞、Stanford University-Diffuse Histiocytic Lymphoma-1细胞
IM9 Cells;背景说明:B淋巴细胞;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:Chang Cells细胞、W256细胞、FTC133细胞
h-pES10 Cells(提供STR鉴定图谱)
HAP1 PSMB8 (-) 3 Cells(提供STR鉴定图谱)
SU-86-86 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:HCA 7细胞、NCIH820细胞、OVCA8细胞
PLA802 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:CaES-17细胞、HS-5细胞、CCD-19Lu细胞
C-33 A Cells;背景说明:C-33A细胞株是N. Auersperg从宫颈癌切片中建立的一系列细胞株(参见ATCC CRL-1594和ATCC CRL-1595)中的一株。 细胞一开始就表现出亚二倍体核型及上皮细胞形态。 连续传代可以观察到核型不稳定。 存在成视网膜细胞瘤蛋白(pRB),但大小不正常。 P53表达上调,且有一个273位密码子的点突变导致Arg -> Cys的替换。 人乳头瘤病毒DNA及RNA阴性。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:ST2细胞、KRC-Y细胞、VP 229细胞
GLC82 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:NCTC 929细胞、Panc5.04细胞、TE-8细胞
TU 686 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:NF639细胞、KOPN8细胞、N-Tera-2细胞
Immortalized Human Hepatocytes Cells;背景说明:肝;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:H-7721细胞、H-774细胞、CaES-17细胞
UACC 812 Cells;背景说明:该细胞是由Liebovitz A等于1986年从一名43岁的白人女性乳腺导管癌患者的乳腺切除肿瘤组织中分离建立的;手术前该病人曾接受过广泛的化疗。该细胞HER-2/neu癌基因序列有15倍的扩增;雌激素受体ER、孕激素受体PR和糖蛋白P阴性。;传代方法:1:3传代;5-7天1次。 ;生长特性:贴壁生长;形态特性:上皮样;相关产品有:RL-952细胞、VMM5细胞、Tu212细胞
H1869 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:4传代;每周换液2次。;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:PA12细胞、SW900细胞、H283细胞
Huh-7.5 Cells(提供STR鉴定图谱)
L.P3 Q-2 Cells(提供STR鉴定图谱)
MSHRIe002-A-SOX17 control 1 Cells(提供STR鉴定图谱)
OH94 Cells(提供STR鉴定图谱)
ROS-17 Cells(提供STR鉴定图谱)
Ubigene A-549 PKN2 KO Cells(提供STR鉴定图谱)
UTA.01006.WT Cells(提供STR鉴定图谱)
HAP1 VIMP (-) 1 Cells(提供STR鉴定图谱)
PA317 Cells;背景说明:胚胎;成纤维细胞;NIH Swiss;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:R 2 C细胞、Panc04.03细胞、H3396细胞
SNK6 Cells;背景说明:NK/T细胞淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:BJA-B1细胞、H69C细胞、CCC-HPF-1细胞
PL-45 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:KPNRTBM1细胞、SAOS 2细胞、DHL-4细胞
MC57G Cells;背景说明:纤维肉瘤;C57BL/6J;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:HTR8svn细胞、MIA Paca2细胞、HT144细胞
NCI-HUT-520 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:6传代;2-3天换液1次;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:P3J HR-1细胞、RS(4;11)细胞、MF2059细胞
NCI-HUT-520 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:6传代;2-3天换液1次;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:P3J HR-1细胞、RS(4;11)细胞、MF2059细胞
CLONE M3 Cells;背景说明:黑色素瘤;雄性;DBA;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:P3-X63-Ag 8.653细胞、A3细胞、HPAF-II细胞
Blotchy fibroblast-11 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:Mevo细胞、OCI-AML-3细胞、UMC11细胞
HEK/293 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:VMM5A细胞、Human Corneal Epithelial cells-Transformed细胞、L-M[TK-]细胞
HuT-78 Cells;背景说明:皮肤;T淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:LLC-PK1细胞、University of Arizona Cell Culture-812细胞、LS-513细胞
NCI-SNU-216 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:KPL4细胞、ANA-1细胞、H4-II-EC3细胞
NCI-SNU-C2B Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:X63-Ag8细胞、SUM 52细胞、GL261细胞
S3 HeLa Cells;背景说明:该细胞是1955年由PuckTT,MarcusPI和CieciuraSJ建系的,含HPV-18序列;角蛋白阳性;可用于与染色体突变、细胞营养、集落形成相关的哺乳动物细胞的克隆分析。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:MDA-MB 231细胞、MPVECs细胞、Melan-a细胞
C-Li-7 Cells;背景说明:人肝癌细胞株。这株细胞从裸鼠体外移植瘤中建立。;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:SW-780细胞、SJSA1细胞、KU 812F细胞
C4-2B Cells;背景说明:前列腺癌;左锁骨上淋巴结转移;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:H-II-E-C3细胞、FRO81-2细胞、LCD细胞
SZ-NF6 Cells(提供STR鉴定图谱)
AML193 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代。3天内可长满。;生长特性:悬浮生长;形态特性:淋巴母细胞;相关产品有:NCIH146细胞、MOLP2细胞、GM01232E细胞
H-250 Cells;背景说明:小细胞肺癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:半贴壁;形态特性:详见产品说明书;相关产品有:H520细胞、Functional Liver Cell-7细胞、OUMS-27细胞
SNU-C1 Cells;背景说明:详见相关文献介绍;传代方法:每3-5天换液。;生长特性:悬浮生长;形态特性:上皮细胞;相关产品有:NGP细胞、GLAG-66细胞、Ly7细胞
A875 Cells;背景说明:NGF受体阳性。;传代方法:1:3传代;3-4天1次。;生长特性:贴壁生长;形态特性:多角形;相关产品有:SNU182细胞、U2932细胞、H820细胞
BE(2)M-17 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:P3X63 AG8-653细胞、GM00637B细胞、50.B1细胞
BE(2)C Cells;背景说明:神经母细胞瘤;骨髓转移;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SUM 149PT细胞、NT2/D1细胞、BALB/c 3T3 clone A31细胞
NALM-6人B淋巴白血病细胞代次低|培养基|送STR图谱
UMUC-14 Cells;背景说明:肾癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:HCAEC细胞、NS-20Y细胞、CTLL2细胞
NRK clone 52E Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:PBL细胞、ARO81细胞、NIH:OVCAR-5细胞
SW-403 Cells;背景说明:详见相关文献介绍;传代方法:1:2—1:6传代,每周换液2-3次;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:TF-1a细胞、HSC5细胞、Lewis-Lung细胞
J-111 Cells;背景说明:单核细胞白血病;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:Vero 76 clone E6细胞、Hs940.T细胞、HME1细胞
DSL6A/C1 Cells;背景说明:胰腺癌;雄性;Lewis;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:HSC-4细胞、293T/17细胞、OVCAR433细胞
MEL-526 Cells;背景说明:黑色素瘤;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Tj-905细胞、D283-MED细胞、Panc 03.27细胞
P3JHR-1 Cells;背景说明:详见相关文献介绍;传代方法:每2-3天换液;生长特性:悬浮生长 ;形态特性:淋巴母细胞样;相关产品有:L02细胞、HTh-74细胞、COLO320-DM细胞
Ca 9-22 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:SCH细胞、C4-2B细胞、Anip 973细胞
BayGenomics ES cell line RRR323 Cells(提供STR鉴定图谱)
BayGenomics ES cell line YHD299 Cells(提供STR鉴定图谱)
HTK Cells(提供STR鉴定图谱)
PCRP-HOXB9-1E6 Cells(提供STR鉴定图谱)
F2408-No.7 Cells(提供STR鉴定图谱)
HPS3191 Cells(提供STR鉴定图谱)
" "PubMed=2985879; DOI=10.1016/0145-2126(85)90084-0
Drexler H.G., Gaedicke G., Minowada J.
Isoenzyme studies in human leukemia-lymphoma cell lines -- 1 carboxylic esterase.
Leuk. Res. 9:209-229(1985)
PubMed=3159941; DOI=10.1016/0145-2126(85)90134-1
Drexler H.G., Gaedicke G., Minowada J.
Isoenzyme studies in human leukemia-lymphoma cell lines -- III Beta-hexosaminidase (E.C. 3.2.1.30).
Leuk. Res. 9:549-559(1985)
PubMed=3874327; DOI=10.1016/0145-2126(85)90133-x
Drexler H.G., Gaedicke G., Minowada J.
Isoenzyme studies in human leukemia-lymphoma cells lines -- II. Acid phosphatase.
Leuk. Res. 9:537-548(1985)
PubMed=2415623; DOI=10.4049/jimmunol.136.1.320
Goldmacher V.S., Lambert J.M., Young A.Y., Anderson J., Tinnel N.L., Kornacki M., Ritz J., Blattler W.A.
Expression of the common acute lymphoblastic leukemia antigen (CALLA) on the surface of individual cells of human lymphoblastoid lines.
J. Immunol. 136:320-325(1986)
PubMed=2939141; DOI=10.4049/jimmunol.136.11.4311
Pesando J.M., Graf L.
Differential expression of HLA-DR, -DQ, and -DP antigens on malignant B cells.
J. Immunol. 136:4311-4318(1986)
PubMed=2783384
Luo Y., Hara H., Haruta Y., Seon B.K.
Establishment of ascitic tumor of human pre-B acute lymphoblastic leukemia in nonconditioned nude mice.
Cancer Res. 49:706-710(1989)
PubMed=2140233; DOI=10.1111/j.1440-1827.1990.tb01549.x
Nakano A., Harada T., Morikawa S., Kato Y.
Expression of leukocyte common antigen (CD45) on various human leukemia/lymphoma cell lines.
Acta Pathol. Jpn. 40:107-115(1990)
PubMed=8847894
Tani A., Tatsumi E., Nakamura F., Kumagai S., Kosaka Y., Sano K., Nakamura H., Amakawa R., Ohno H.
Sensitivity to dexamethasone and absence of bcl-2 protein in Burkitt's lymphoma cell line (Black93) derived from a patient with acute tumor lysis syndrome: comparative study with other BL and non-BL lines.
Leukemia 10:1592-1603(1996)
PubMed=9067587; DOI=10.1038/sj.leu.2400571
Uphoff C.C., MacLeod R.A.F., Denkmann S.A., Golub T.R., Borkhardt A., Janssen J.W.G., Drexler H.G.
Occurrence of TEL-AML1 fusion resulting from (12;21) translocation in human early B-lineage leukemia cell lines.
Leukemia 11:441-447(1997)
PubMed=9510473; DOI=10.1111/j.1349-7006.1998.tb00476.x; PMCID=PMC5921588
Hosoya N., Hangaishi A., Ogawa S., Miyagawa K., Mitani K., Yazaki Y., Hirai H.
Frameshift mutations of the hMSH6 gene in human leukemia cell lines.
Jpn. J. Cancer Res. 89:33-39(1998)
PubMed=9680106; DOI=10.1016/S0145-2126(98)00050-2
Matsuo Y., Drexler H.G.
Establishment and characterization of human B cell precursor-leukemia cell lines.
Leuk. Res. 22:567-579(1998)
PubMed=9738977; DOI=10.1111/j.1349-7006.1998.tb03275.x; PMCID=PMC5921886
Takizawa J., Suzuki R., Kuroda H., Utsunomiya A., Kagami Y., Joh T., Aizawa Y., Ueda R., Seto M.
Expression of the TCL1 gene at 14q32 in B-cell malignancies but not in adult T-cell leukemia.
Jpn. J. Cancer Res. 89:712-718(1998)
PubMed=10490826; DOI=10.1038/sj.onc.1202874
Fu X.-Y., McGrath S., Pasillas M., Nakazawa S., Kamps M.P.
EB-1, a tyrosine kinase signal transduction gene, is transcriptionally activated in the t(1;19) subset of pre-B ALL, which express oncoprotein E2a-Pbx1.
Oncogene 18:4920-4929(1999)
PubMed=10695022
Matsuo Y., Nishizaki C., Drexler H.G.
Efficient DNA fingerprinting method for the identification of cross-culture contamination of cell lines.
Hum. Cell 12:149-154(1999)
PubMed=10739008; DOI=10.1016/S0145-2126(99)00182-4
Inoue K., Kohno T., Takakura S., Hayashi Y., Mizoguchi H., Yokota J.
Frequent microsatellite instability and BAX mutations in T cell acute lymphoblastic leukemia cell lines.
Leuk. Res. 24:255-262(2000)
PubMed=11021758; DOI=10.1038/sj.leu.2401891
Majka M., Rozmyslowicz T., Honczarenko M.J., Ratajczak J., Wasik M.A., Gaulton G.N., Ratajczak M.Z.
Biological significance of the expression of HIV-related chemokine coreceptors (CCR5 and CXCR4) and their ligands by human hematopoietic cell lines.
Leukemia 14:1821-1832(2000)
DOI=10.1016/B978-0-12-221970-2.50457-5
Drexler H.G.
The leukemia-lymphoma cell line factsbook.
(In book) ISBN 9780122219702; pp.1-733; Academic Press; London; United Kingdom (2001)
PubMed=11226526; DOI=10.1016/S0145-2126(00)00121-1
Inoue K., Kohno T., Takakura S., Hayashi Y., Mizoguchi H., Yokota J.
Corrigendum to: Frequent microsatellite instability and BAX mutations in T cell acute lymphoblastic leukemia cell lines Leukemia Research 24 (2000), 255-262.
Leuk. Res. 25:275-278(2001)
PubMed=11416159; DOI=10.1073/pnas.121616198; PMCID=PMC35459
Masters J.R.W., Thomson J.A., Daly-Burns B., Reid Y.A., Dirks W.G., Packer P., Toji L.H., Ohno T., Tanabe H., Arlett C.F., Kelland L.R., Harrison M., Virmani A.K., Ward T.H., Ayres K.L., Debenham P.G.
Short tandem repeat profiling provides an international reference standard for human cell lines.
Proc. Natl. Acad. Sci. U.S.A. 98:8012-8017(2001)
PubMed=11986953; DOI=10.1038/sj.leu.2402485
O'Donnell P.H., Guo W.-X., Reynolds C.P., Maurer B.J.
N-(4-hydroxyphenyl)retinamide increases ceramide and is cytotoxic to acute lymphoblastic leukemia cell lines, but not to non-malignant lymphocytes.
Leukemia 16:902-910(2002)
PubMed=15843827; DOI=10.1038/sj.leu.2403749
Andersson A., Eden P., Lindgren D., Nilsson J., Lassen C., Heldrup J., Fontes M., Borg A., Mitelman F., Johansson B., Hoglund M., Fioretos T.
Gene expression profiling of leukemic cell lines reveals conserved molecular signatures among subtypes with specific genetic aberrations.
Leukemia 19:1042-1050(2005)
PubMed=16405397; DOI=10.1089/dna.2006.25.19
Adachi N., So S., Iiizumi S., Nomura Y., Murai K., Yamakawa C., Miyagawa K., Koyama H.
The human pre-B cell line Nalm-6 is highly proficient in gene targeting by homologous recombination.
DNA Cell Biol. 25:19-24(2006)
PubMed=16408098; DOI=10.1038/sj.leu.2404081
Quentmeier H., MacLeod R.A.F., Zaborski M., Drexler H.G.
JAK2 V617F tyrosine kinase mutation in cell lines derived from myeloproliferative disorders.
Leukemia 20:471-476(2006)
PubMed=16969076; DOI=10.4161/cbt.5.8.3251; PMCID=PMC2714972
Edkins S., O'Meara S., Parker A., Stevens C., Reis M., Jones S., Greenman C.D., Davies H.R., Dalgliesh G.L., Forbes S., Hunter C., Smith R., Stephens P.J., Goldstraw P., Nicholson A., Chan T.-L., Velculescu V.E., Yuen S.T., Leung S.Y., Stratton M.R., Futreal P.A.
Recurrent KRAS codon 146 mutations in human colorectal cancer.
Cancer Biol. Ther. 5:928-932(2006)
PubMed=20103924
Adachi N., Nishijima H., Shibahara K.-i.
Gene targeting using the human Nalm-6 pre-B cell line.
Biosci. Trends 2:169-180(2008)
PubMed=20164919; DOI=10.1038/nature08768; PMCID=PMC3145113
Bignell G.R., Greenman C.D., Davies H.R., Butler A.P., Edkins S., Andrews J.M., Buck G., Chen L., Beare D., Latimer C., Widaa S., Hinton J., Fahey C., Fu B.-Y., Swamy S., Dalgliesh G.L., Teh B.T., Deloukas P., Yang F.-T., Campbell P.J., Futreal P.A., Stratton M.R.
Signatures of mutation and selection in the cancer genome.
Nature 463:893-898(2010)
PubMed=20215515; DOI=10.1158/0008-5472.CAN-09-3458; PMCID=PMC2881662
Rothenberg S.M., Mohapatra G., Rivera M.N., Winokur D., Greninger P., Nitta M., Sadow P.M., Sooriyakumar G., Brannigan B.W., Ulman M.J., Perera R.M., Wang R., Tam A., Ma X.-J., Erlander M., Sgroi D.C., Rocco J.W., Lingen M.W., Cohen E.E.W., Louis D.N., Settleman J., Haber D.A.
A genome-wide screen for microdeletions reveals disruption of polarity complex genes in diverse human cancers.
Cancer Res. 70:2158-2164(2010)
PubMed=20575032; DOI=10.1002/ajh.21738; PMCID=PMC7159455
Inukai T., Zhang X.-R., Kameyama T., Suzuki Y., Yoshikawa K., Kuroda I., Nemoto A., Akahane K., Sato H., Goi K., Nakamoto K., Hamada J.-i., Tada M., Moriuchi T., Sugita K.
A specific linkage between the incidence of TP53 mutations and type of chromosomal translocations in B-precursor acute lymphoblastic leukemia cell lines.
Am. J. Hematol. 85:535-537(2010)
PubMed=20922763; DOI=10.1002/pbc.22801; PMCID=PMC3005554
Kang M.H., Smith M.A., Morton C.L., Keshelava N., Houghton P.J., Reynolds C.P.
National Cancer Institute pediatric preclinical testing program: model description for in vitro cytotoxicity testing.
Pediatr. Blood Cancer 56:239-249(2011)
PubMed=22460905; DOI=10.1038/nature11003; PMCID=PMC3320027
Barretina J.G., Caponigro G., Stransky N., Venkatesan K., Margolin A.A., Kim S., Wilson C.J., Lehar J., Kryukov G.V., Sonkin D., Reddy A., Liu M., Murray L., Berger M.F., Monahan J.E., Morais P., Meltzer J., Korejwa A., Jane-Valbuena J., Mapa F.A., Thibault J., Bric-Furlong E., Raman P., Shipway A., Engels I.H., Cheng J., Yu G.-Y.K., Yu J.-J., Aspesi P. Jr., de Silva M., Jagtap K., Jones M.D., Wang L., Hatton C., Palescandolo E., Gupta S., Mahan S., Sougnez C., Onofrio R.C., Liefeld T., MacConaill L.E., Winckler W., Reich M., Li N.-X., Mesirov J.P., Gabriel S.B., Getz G., Ardlie K., Chan V., Myer V.E., Weber B.L., Porter J., Warmuth M., Finan P., Harris J.L., Meyerson M.L., Golub T.R., Morrissey M.P., Sellers W.R., Schlegel R., Garraway L.A.
The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity.
Nature 483:603-607(2012)
PubMed=23596518; DOI=10.1371/journal.pone.0061189; PMCID=PMC3626652
Suzuki T., Ukai A., Honma M., Adachi N., Nohmi T.
Restoration of mismatch repair functions in human cell line Nalm-6, which has high efficiency for gene targeting.
PLoS ONE 8:E61189-E61189(2013)
PubMed=25984343; DOI=10.1038/sdata.2014.35; PMCID=PMC4432652
Cowley G.S., Weir B.A., Vazquez F., Tamayo P., Scott J.A., Rusin S., East-Seletsky A., Ali L.D., Gerath W.F.J., Pantel S.E., Lizotte P.H., Jiang G.-Z., Hsiao J., Tsherniak A., Dwinell E., Aoyama S., Okamoto M., Harrington W., Gelfand E.T., Green T.M., Tomko M.J., Gopal S., Wong T.C., Li H.-B., Howell S., Stransky N., Liefeld T., Jang D., Bistline J., Meyers B.H., Armstrong S.A., Anderson K.C., Stegmaier K., Reich M., Pellman D., Boehm J.S., Mesirov J.P., Golub T.R., Root D.E., Hahn W.C.
Parallel genome-scale loss of function screens in 216 cancer cell lines for the identification of context-specific genetic dependencies.
Sci. Data 1:140035-140035(2014)
PubMed=25485619; DOI=10.1038/nbt.3080
Klijn C., Durinck S., Stawiski E.W., Haverty P.M., Jiang Z.-S., Liu H.-B., Degenhardt J., Mayba O., Gnad F., Liu J.-F., Pau G., Reeder J., Cao Y., Mukhyala K., Selvaraj S.K., Yu M.-M., Zynda G.J., Brauer M.J., Wu T.D., Gentleman R.C., Manning G., Yauch R.L., Bourgon R., Stokoe D., Modrusan Z., Neve R.M., de Sauvage F.J., Settleman J., Seshagiri S., Zhang Z.-M.
A comprehensive transcriptional portrait of human cancer cell lines.
Nat. Biotechnol. 33:306-312(2015)
PubMed=25877200; DOI=10.1038/nature14397
Yu M., Selvaraj S.K., Liang-Chu M.M.Y., Aghajani S., Busse M., Yuan J., Lee G., Peale F.V., Klijn C., Bourgon R., Kaminker J.S., Neve R.M.
A resource for cell line authentication, annotation and quality control.
Nature 520:307-311(2015)
PubMed=26589293; DOI=10.1186/s13073-015-0240-5; PMCID=PMC4653878
Scholtalbers J., Boegel S., Bukur T., Byl M., Goerges S., Sorn P., Loewer M., Sahin U., Castle J.C.
TCLP: an online cancer cell line catalogue integrating HLA type, predicted neo-epitopes, virus and gene expression.
Genome Med. 7:118.1-118.7(2015)
PubMed=27397505; DOI=10.1016/j.cell.2016.06.017; PMCID=PMC4967469
Iorio F., Knijnenburg T.A., Vis D.J., Bignell G.R., Menden M.P., Schubert M., Aben N., Goncalves E., Barthorpe S., Lightfoot H., Cokelaer T., Greninger P., van Dyk E., Chang H., de Silva H., Heyn H., Deng X.-M., Egan R.K., Liu Q.-S., Miroo T., Mitropoulos X., Richardson L., Wang J.-H., Zhang T.-H., Moran S., Sayols S., Soleimani M., Tamborero D., Lopez-Bigas N., Ross-Macdonald P., Esteller M., Gray N.S., Haber D.A., Stratton M.R., Benes C.H., Wessels L.F.A., Saez-Rodriguez J., McDermott U., Garnett M.J.
A landscape of pharmacogenomic interactions in cancer.
Cell 166:740-754(2016)
PubMed=28196595; DOI=10.1016/j.ccell.2017.01.005; PMCID=PMC5501076
Li J., Zhao W., Akbani R., Liu W.-B., Ju Z.-L., Ling S.-Y., Vellano C.P., Roebuck P., Yu Q.-H., Eterovic A.K., Byers L.A., Davies M.A., Deng W.-L., Gopal Y.N.V., Chen G., von Euw E.M., Slamon D.J., Conklin D., Heymach J.V., Gazdar A.F., Minna J.D., Myers J.N., Lu Y.-L., Mills G.B., Liang H.
Characterization of human cancer cell lines by reverse-phase protein arrays.
Cancer Cell 31:225-239(2017)
PubMed=29786757; DOI=10.1007/s12185-018-2474-7
Tomoyasu C., Imamura T., Tomii T., Yano M., Asai D., Goto H., Shimada A., Sanada M., Iwamoto S., Takita J., Minegishi M., Inukai T., Sugita K., Hosoi H.
Copy number abnormality of acute lymphoblastic leukemia cell lines based on their genetic subtypes.
Int. J. Hematol. 108:312-318(2018)
PubMed=30285677; DOI=10.1186/s12885-018-4840-5; PMCID=PMC6167786
Tan K.-T., Ding L.-W., Sun Q.-Y., Lao Z.-T., Chien W., Ren X., Xiao J.-F., Loh X.-Y., Xu L., Lill M., Mayakonda A., Lin D.-C., Yang H.H., Koeffler H.P.
Profiling the B/T cell receptor repertoire of lymphocyte derived cell lines.
BMC Cancer 18:940.1-940.13(2018)
PubMed=30629668; DOI=10.1371/journal.pone.0210404; PMCID=PMC6328144
Uphoff C.C., Pommerenke C., Denkmann S.A., Drexler H.G.
Screening human cell lines for viral infections applying RNA-Seq data analysis.
PLoS ONE 14:E0210404-E0210404(2019)
PubMed=30894373; DOI=10.1158/0008-5472.CAN-18-2747; PMCID=PMC6445675
Dutil J., Chen Z.-H., Monteiro A.N.A., Teer J.K., Eschrich S.A.
An interactive resource to probe genetic diversity and estimated ancestry in cancer cell lines.
Cancer Res. 79:1263-1273(2019)
PubMed=31068700; DOI=10.1038/s41586-019-1186-3; PMCID=PMC6697103
Ghandi M., Huang F.W., Jane-Valbuena J., Kryukov G.V., Lo C.C., McDonald E.R. 3rd, Barretina J.G., Gelfand E.T., Bielski C.M., Li H.-X., Hu K., Andreev-Drakhlin A.Y., Kim J., Hess J.M., Haas B.J., Aguet F., Weir B.A., Rothberg M.V., Paolella B.R., Lawrence M.S., Akbani R., Lu Y.-L., Tiv H.L., Gokhale P.C., de Weck A., Mansour A.A., Oh C., Shih J., Hadi K., Rosen Y., Bistline J., Venkatesan K., Reddy A., Sonkin D., Liu M., Lehar J., Korn J.M., Porter D.A., Jones M.D., Golji J., Caponigro G., Taylor J.E., Dunning C.M., Creech A.L., Warren A.C., McFarland J.M., Zamanighomi M., Kauffmann A., Stransky N., Imielinski M., Maruvka Y.E., Cherniack A.D., Tsherniak A., Vazquez F., Jaffe J.D., Lane A.A., Weinstock D.M., Johannessen C.M., Morrissey M.P., Stegmeier F., Schlegel R., Hahn W.C., Getz G., Mills G.B., Boehm J.S., Golub T.R., Garraway L.A., Sellers W.R.
Next-generation characterization of the Cancer Cell Line Encyclopedia.
Nature 569:503-508(2019)
PubMed=31160637; DOI=10.1038/s41598-019-44491-x; PMCID=PMC6547646
Quentmeier H., Pommerenke C., Dirks W.G., Eberth S., Koeppel M., MacLeod R.A.F., Nagel S., Steube K.G., Uphoff C.C., Drexler H.G.
The LL-100 panel: 100 cell lines for blood cancer studies.
Sci. Rep. 9:8218-8218(2019)
PubMed=31243274; DOI=10.1038/s41467-019-10637-8; PMCID=PMC6594946
Tian L.-Q., Shao Y., Nance S., Dang J.-J., Xu B.-S., Ma X.-T., Li Y.-J., Ju B.-S., Dong L., Newman S., Zhou X., Schreiner P., Tseng E., Hon T., Ashby M., Li C.-L., Easton J., Gruber T.A., Zhang J.-H.
Long-read sequencing unveils IGH-DUX4 translocation into the silenced IGH allele in B-cell acute lymphoblastic leukemia.
Nat. Commun. 10:2789.1-2789.10(2019)
PubMed=31978347; DOI=10.1016/j.cell.2019.12.023; PMCID=PMC7339254
Nusinow D.P., Szpyt J., Ghandi M., Rose C.M., McDonald E.R. 3rd, Kalocsay M., Jane-Valbuena J., Gelfand E.T., Schweppe D.K., Jedrychowski M.P., Golji J., Porter D.A., Rejtar T., Wang Y.K., Kryukov G.V., Stegmeier F., Erickson B.K., Garraway L.A., Sellers W.R., Gygi S.P.
Quantitative proteomics of the Cancer Cell Line Encyclopedia.
Cell 180:387-402.e16(2020)
PubMed=34823530; DOI=10.1186/s12935-021-02335-7; PMCID=PMC8614043
Li Y.-Y., Zuo C., Gu L.
Characterization of a novel glucocorticoid-resistant human B-cell acute lymphoblastic leukemia cell line, with AMPK, mTOR and fatty acid synthesis pathway inhibition.
Cancer Cell Int. 21:623.1-623.14(2021)"