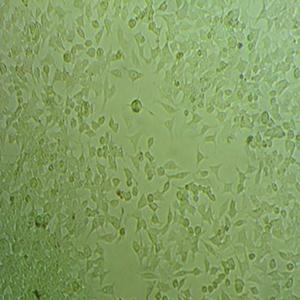
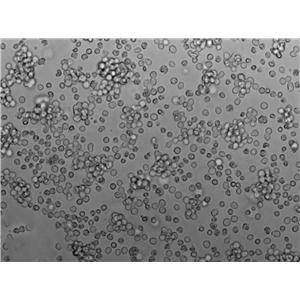
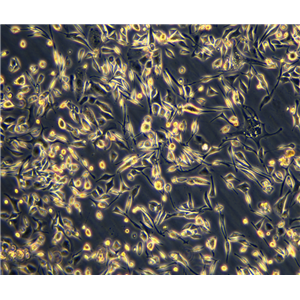
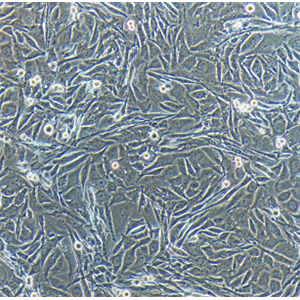
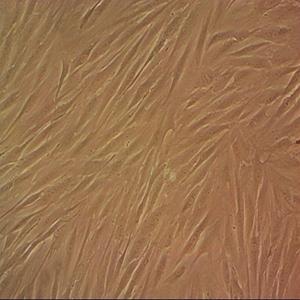
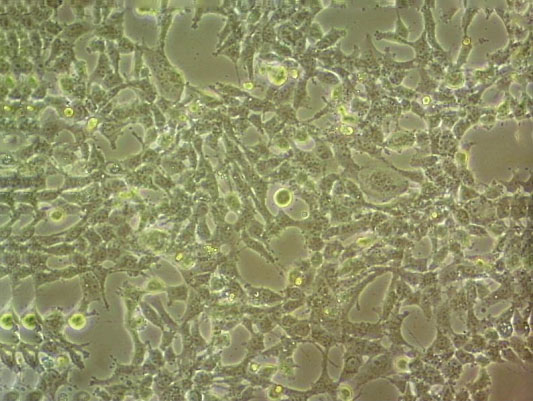
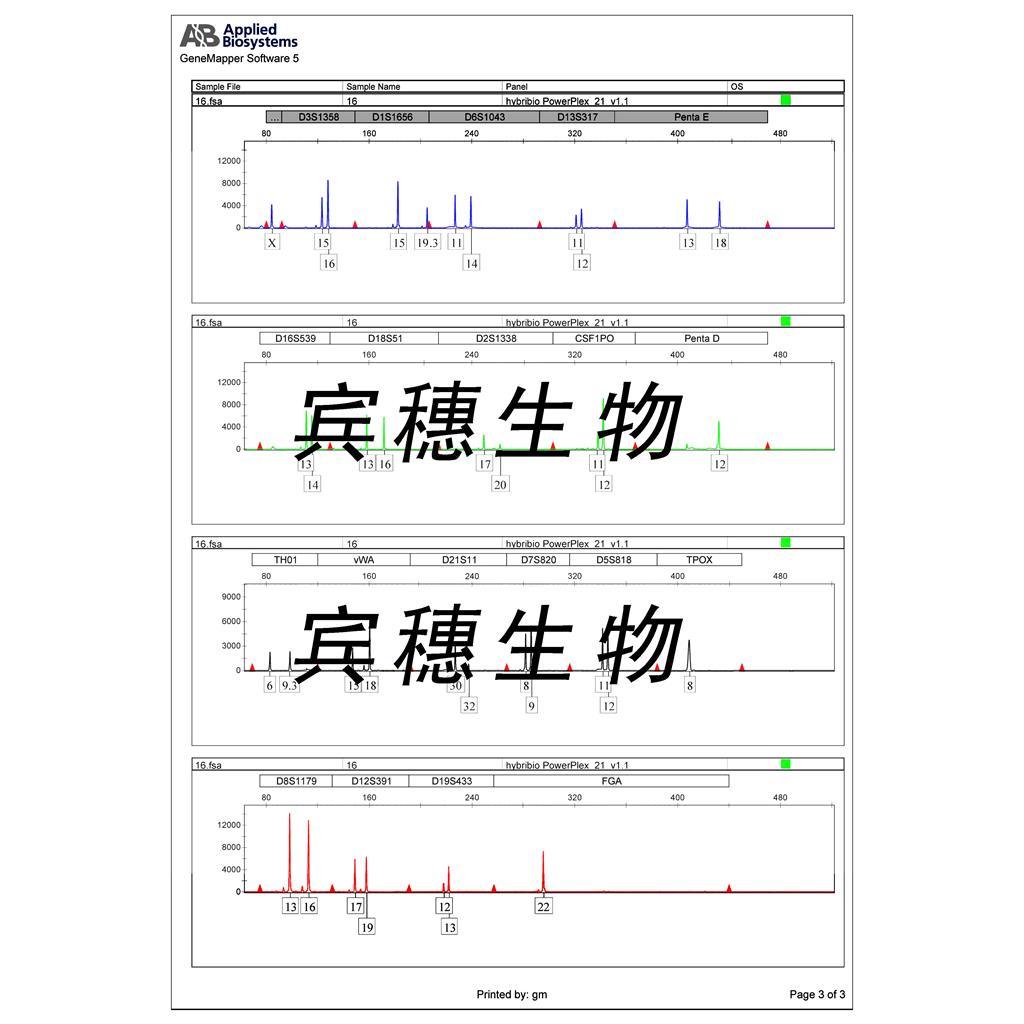
"SU-DHL-4人B淋巴瘤细胞代次低|培养基|送STR图谱
传代比例:1:2-1:4(首次传代建议1:2)
生长特性:悬浮生长
细胞系的选择需要考虑到细胞系的功能特点、生长速率、铺板效率、生长条件和生长特征、克隆效率、培养方式等因素,如果您想高产量表达重组蛋白,您可以选择可以悬浮生长的快速生长细胞系。细胞培养的操作步骤主要包括传代、换液、冻存和复苏。这些步骤确保了细胞能够在实验室环境中长期存活并继续增殖。传代是将细胞从一个容器转移到另一个容器的过程,以扩大细胞数量;换液是为了清除代谢废物并补充新鲜培养基;冻存则是为了长期保存细胞,而复苏则是重新激活冷冻保存的细胞使其恢复正常生长。
换液周期:每周2-3次
ECC-10 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:LICR-LON-HN6-R细胞、Z138细胞、MDA-MB436细胞
H1436 Cells;背景说明:详见相关文献介绍;传代方法:随细胞的密度而增加;生长特性:悬浮生长;形态特性:详见产品说明书;相关产品有:Hep 2细胞、NRK clone 49F细胞、D6P2T细胞
GM05372 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:J 774A.1细胞、HF-91细胞、FaDu细胞
SU-DHL-4人B淋巴瘤细胞代次低|培养基|送STR图谱
背景信息:详见相关文献介绍
┈订┈购(技术服务)┈热┈线:1┈3┈6┈4┈1┈9┈3┈0┈7┈9┈1【微信同号】┈Q┈Q:3┈1┈8┈0┈8┈0┈7┈3┈2┈4;
DSMZ菌株保藏中心成立于1969年,是德国的国家菌种保藏中心。该中心一直致力于细菌、真菌、质粒、抗菌素、人体和动物细胞、植物病毒等的分类、鉴定和保藏工作。DSMZ菌种保藏中心是欧洲规模最大的生物资源中心,保藏有动物细胞500多株。Riken BRC成立于1920年,是英国的国家菌种保藏中心。该中心一直致力于细菌、真菌、植物病毒等的分类、鉴定和保藏工作。日本Riken BRC(Riken生物资源保藏中心)是全球三大典型培养物收集中心之一。Riken保藏中心提供了很多细胞系。在世界范围内,这些细胞系,都在医学、科学和兽医中具有重要意义。Riken生物资源中心支持了各种学术、健康、食品和兽医机构的研究工作,并在世界各地不同组织的微生物实验室和研究机构中使用。
产品包装:复苏发货:T25培养瓶(一瓶)或冻存发货:1ml冻存管(两支)
来源说明:细胞主要来源ATCC、ECACC、DSMZ、RIKEN等细胞库
SU-DHL-4人B淋巴瘤细胞代次低|培养基|送STR图谱
物种来源:人源、鼠源等其它物种来源
H-2110 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:6传代,每周换液2-3次;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:上皮细胞;相关产品有:RCC 786-O细胞、Hs-729-T细胞、WC00079细胞
HT3 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:FDC-P1细胞、HEK293EBNA细胞、OK细胞
Tb 1-Lu Cells;背景说明:肺;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:BNL-HCC细胞、NCIH1688细胞、GM07404D细胞
MM1 Cells;背景说明:急性单核细胞白血病;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:MV 4;11细胞、Tregs细胞、NIH-3T3细胞
┈订┈购(技术服务)┈热┈线:1┈3┈6┈4┈1┈9┈3┈0┈7┈9┈1【微信同号】┈Q┈Q:3┈1┈8┈0┈8┈0┈7┈3┈2┈4;
形态特性:淋巴母细胞样
正确的细胞复苏需知事项:细胞冻存HAO了,接下来要注意什么问题呢?没错,就是记得到时间了,拿出来复苏。那么,细胞复苏的过程中又有哪些该注意的事项呢?细胞活力和形态检查的作用何在?活力检查——千万不要使用不健康的细胞,可能有污染(真菌、支原体等),如果发现有污染毫不犹豫的丢弃!形态检查——检查细胞的固有形态和生长行为。冻存细胞:补充新的培养——在您开始冻存细胞的前一天补充新的培养。在细胞长至70%单层时收获细胞,计数活细胞数,用冻存调整细胞密度~5 x106 s/ml (根据不同的细胞类型调整);冻存——用冻存洗细胞并用冻存重悬细胞,有不同类型的冻存,根据细胞类型选择Zui合适的冻存(常用的冻存成分有):5-10% DMSO——注意确保DMSO不含有其他的毒性物质;5-15%甘油;如果细胞在无血清培养基内生长,应在50%条件培养基内(细胞在无血清培养基内生长24小时)内冻存和复苏。在冻存管上标记HAO细胞类型,日期,冻存人等信息,并保证每冻存管不超过1.5ml。放入罐之前记录冻存管的数量和位置。以Zui快的速度转移冻存管知罐内,因此,此步骤ZuiHAO使用干冰,或者把冻存管浸入装有的小盒内。此外还要注意,在冻存管上没有足够的空间记录细胞的详细信息,做HAO记录是非常非常重要的!还有一个Zui重要的,一定要在异地的罐内保存同样的一份细胞,以免其中的一个罐出现问题!细胞正确的复苏方式和正确的冻存方式同样重要,熟记以下要点:当从罐内取出细胞时,有可能会出现冻存管破裂的情况,使用保护面罩和防护服十分必要;其实,细胞复苏只是一个简单的实验,不过这其中却不可避免有一些需要注意的细节,不然,也不一定会尽如人意。例如说,人身健康方面:一定要记得做HAO防冻工作,戴上护目镜;尽量降低DMSO对细胞的损伤等等。
SKMES1 Cells;背景说明:源于一位65岁患有肺鳞状细胞癌的白人男性,自转移性胸腔积液分离而来。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:MG63细胞、NU-GC-4细胞、SW-982细胞
RMS 13 Cells;背景说明:肺泡横纹肌肉瘤;骨髓转移;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NCI-H1793细胞、EBC1细胞、LC-1Sq细胞
GTL16 Cells;背景说明:胃癌;肝转移;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NCI-H1184细胞、H-1341细胞、MBVP细胞
YES 2 Cells;背景说明:食管鳞癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SNU520细胞、Factor Dependent Continuous-Paterson 1细胞、SUM-159细胞
MDA-MB-415 Cells;背景说明:这株细胞表达WNT7B癌基因。8168088].带瘤患者来自巴拉圭,虽然填报的是白人,但细胞表型存在G6PDA型,显示其属于混血。细胞株形成平展延伸的上皮细胞样,在电镜下呈现结节,伴随着延伸的微管和微板。不容易用胰酶消化。;传代方法:消化5-10分钟。1:2。4-5天长满。;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:NCI.H23细胞、QSG7701细胞、H-1930细胞
NCI-SNU-C2A Cells;背景说明:详见相关文献介绍;传代方法:每周两次换液;生长特性:松散附着、多单元的聚合;形态特性:上皮细胞样;相关产品有:SU 86.86细胞、TE4细胞、TE4细胞
THEECs Cells;背景说明:食管;上皮细胞;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SK-N-BE2细胞、NTC200细胞、L-5178-Y-R细胞
KOSC2 Cells;背景说明:详见相关文献介绍;传代方法:2.2 x 10^4 cells/ml ;生长特性:贴壁生长;形态特性:上皮样;相关产品有:TALL-104细胞、SU-DHL2细胞、HGF-1细胞
SJRH-30 Cells;背景说明:肺泡横纹肌肉瘤;骨髓转移;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:MC3T3-E1 Subclone 14细胞、746T细胞、SuDHL 4细胞
LS-174 Cells;背景说明:LS 174T是LS 180 (ATCC CL 187)结肠腺癌细胞株的胰蛋白酶化变种。 它比亲本更易传代,象LS 180一样生成大量的癌胚抗原(CEA)。 电镜研究表明有丰富的微丝和细胞质粘液素液泡。 直肠抗原3阳性。 p53抗原表达阴性,但mRNA表达阳性。 与ATCC CL-187来源于同一个肿瘤。LS 174T细胞角蛋白染色阳性。 癌基因c-myc, N-myc, H-ras, N-ras, Myb, 和 fos的表达呈阳性。 癌基因k-ras和sis的表达未做检测。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:OLN-93细胞、NCI-H1703细胞、HCC-2279细胞
CNE2Z Cells;背景说明:鼻咽癌;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:LOU-NH-91细胞、COS-1细胞、CNE细胞
Hs 683 Cells;背景说明:该细胞源自76岁白人男性的左颞叶侧胶质瘤组织,有微绒毛,无桥粒。 ;传代方法:1:4传代,每周换液2次;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:RDES细胞、Hs606细胞、HuH-6细胞
PAMC82 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:mousepodocyte细胞、RIN14B细胞、Homo sapiens No. 578, tumor cells细胞
HT-115 Cells;背景说明:结肠癌;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:32D.3细胞、HSMC细胞、A-172 MG细胞
NBL-S Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:CZ-1细胞、H-1395细胞、U-373MG ATCC细胞
H-1755 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:NCIH2342细胞、COLO-680N细胞、OCI-AML-3细胞
HCC1008 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:HCC1588细胞、REC细胞、SNU-16细胞
Abcam A-549 MAPK3 KO Cells(提供STR鉴定图谱)
Abcam U2OS MAGEA1 KO Cells(提供STR鉴定图谱)
BayGenomics ES cell line CSG235 Cells(提供STR鉴定图谱)
BayGenomics ES cell line RRU035 Cells(提供STR鉴定图谱)
BayGenomics ES cell line YTC615 Cells(提供STR鉴定图谱)
CHO TSHR-0 Cells(提供STR鉴定图谱)
DA02425 Cells(提供STR鉴定图谱)
ESi051-A Cells(提供STR鉴定图谱)
GM07200 Cells(提供STR鉴定图谱)
RPMI #1846 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:KE37细胞、HSC4细胞、HS578T细胞
SU-DHL-4人B淋巴瘤细胞代次低|培养基|送STR图谱
Cloudman M3 Cells;背景说明:黑色素瘤;雄性;DBA;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Dami细胞、Hs600T细胞、H1650细胞
HFF-1 Cells;背景说明:详见相关文献介绍;传代方法:1:5-1:7传代;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:MHCC 97-L细胞、McARH7777细胞、HCC827细胞
B10BR Cells;背景说明:永生化黑素 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NCI-H838细胞、OVCA5细胞、IPEC-1细胞
XuanWei Lung Cancer-05 Cells;背景说明:肺癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:GM 2132细胞、MFE 280细胞、R D细胞
WPMY-1 Cells;背景说明:肌成纤维基质细胞株,WPMY-1,与RWPE-1cells(ATCCCRL-11609)一样,来源于同一张成人前列腺组织切片的周围区域的基质细胞。通过一个pRSTV质料结构,用SV40大T抗原对基质细胞进行永生化。WPMY-1细胞,与RWPE-1细胞及其它上皮细胞衍生株一样,属于来源于同一个前列腺的一系列细胞株。由于它们来源于同一个前列腺的周围区域,WPMY-1细胞株对于研究分泌和基质与上皮细胞相互作用尤其有用。;传代方法:消化3-5分钟。1:2。3天内可长满。;生长特性:贴壁生长;形态特性:成肌细胞;相关产品有:8226细胞、K7M2-WT细胞、VM Cub 1细胞
anti-gamma1-crystallin Cells(提供STR鉴定图谱)
SuDHL 1 Cells;背景说明:间变性大细胞淋巴瘤;胸腔积液转移;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:HSKMC细胞、BE2M17细胞、NCIH3255细胞
U87 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:PANC1005细胞、ECC10细胞、RCM1细胞
BLO-11 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:3T3-Swiss细胞、MCF 7B细胞、16HBE细胞
SCC15 Cells;背景说明:详见相关文献介绍;传代方法:1:4-1:8传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:H1092细胞、NCI-H1694细胞、Colo699细胞
MT4 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:悬浮生长;形态特性:淋巴母细胞样;圆形;相关产品有:B6Tert-1细胞、XWLC-05细胞、MRC-5细胞
MA-782 Cells;背景说明:乳腺癌;Balb/c;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NKT细胞、AR41P细胞、UCLA SO M14细胞
M20 [Human melanoma] Cells;背景说明:黑色素瘤;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:WM115细胞、MeT5A细胞、SUM 159细胞
mIMCD-3 Cells;背景说明:肾;内髓集合管;上皮 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NIH:OVCAR4细胞、BJA-B细胞、H1882细胞
GM09789 Cells(提供STR鉴定图谱)
HAP1 BCOR (-) 1 Cells(提供STR鉴定图谱)
SKLU01 Cells;背景说明:该细胞系源于一位60岁的白人女性患者的肺腺癌组织。;传代方法:1:2传代;每周换液2次。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:WM 239细胞、MM-1S细胞、ATDC-5细胞
NBL-2 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:NPC-039细胞、Farage Original Line细胞、EFM192B细胞
TE6 Cells;背景说明:详见相关文献介绍;传代方法:消化3-5分钟。1:2。3天内可长满。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:MEF细胞、Hs 274.T细胞、DLM8细胞
EFM-19 Cells;背景说明:乳腺管癌;胸腔积液转移;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SKMES细胞、RD-ES细胞、HT-115细胞
293 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:NPA87细胞、HT-144细胞、A875细胞
PANC0504 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:ATN1细胞、HIT细胞、SK-MEL-24细胞
ECV Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:S91细胞、NCIH522细胞、H1954细胞
SK BR 03 Cells;背景说明:这株细胞源自胸水。没有病毒颗粒。亚显微结构特征包括微丝和桥粒,肝糖原颗粒,大溶酶体,成束的细胞质纤丝。SK-BR-3细胞株过表达HER2/c-erb-2基因产物。;传代方法:消化3-5分钟,1:2,3天内可长满;生长特性:贴壁生长;形态特性:上皮样;相关产品有:3T3NIH细胞、KTC1细胞、Hs 739.T细胞
HG03265 Cells(提供STR鉴定图谱)
ICGi032-A Cells(提供STR鉴定图谱)
LN1 Cells(提供STR鉴定图谱)
NCI-H2145 Cells(提供STR鉴定图谱)
PathHunter CHO-K1 PPYR1 beta-arrestin Cells(提供STR鉴定图谱)
Ubigene HCT 116 LPAR5 KO Cells(提供STR鉴定图谱)
WAB0221 Cells(提供STR鉴定图谱)
HG01600 Cells(提供STR鉴定图谱)
Y3-Ag 1.2.3 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:0V-1063细胞、DU_145细胞、ECC-10细胞
PaTu 8988s Cells;背景说明:胰腺癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:22Rv1细胞、HK2细胞、NCTC 929细胞
32D.cl3 Cells;背景说明:骨髓淋巴瘤;C3H/HeJ;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:Mouse Podocyte Clone-5细胞、LS-411N细胞、QBC939细胞
Metastatic Variant-522 Cells;背景说明:肺腺癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NCI-H2291细胞、GH 3细胞、Granta 519细胞
KYSE-270 Cells;背景说明:详见相关文献介绍;传代方法:1:5传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:MCA 38细胞、NCI-H2108细胞、GM02132C细胞
YD38 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:AG06814-J细胞、OVCAR-8/ADR细胞、143B细胞
BNL CL.2 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:TF1细胞、JURKAT E-6.1细胞、Colo-206F细胞
H-295 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:RDES-1细胞、LOU-NH91细胞、T-cell Acute Lymphoblastic Leukemia-1细胞
PA12 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:R-1059-D细胞、Tadarida brasiliensis 1 lung细胞、EMT-6细胞
CCD-841CoN Cells;背景说明:结肠上皮细胞;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:HPF细胞、Tsup-1细胞、hTERT-RPE细胞
YES2 Cells;背景说明:食管鳞癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:MDAMB175细胞、WM2664细胞、H-295R细胞
YES-2 Cells;背景说明:食管鳞癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NCI-H889细胞、OCI-LY-18细胞、BNL 1MEA.7R.1细胞
HECCL-1 Cells;背景说明:子宫内膜癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:K422细胞、OK细胞、H-1694细胞
Hs934T Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代,;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:成纤维细胞;相关产品有:Kit-225-K6细胞、hRPTC细胞、HEK293F细胞
H-526 Cells;背景说明:详见相关文献介绍;传代方法:每周换液2-3次。;生长特性:悬浮生长 ;形态特性:上皮细胞;相关产品有:HMEC-1细胞、GM05384细胞、Mono-Mac-1细胞
SACC-LM-KRT19-KD Cells(提供STR鉴定图谱)
Hs852 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:FDCP1细胞、OCI-AML4细胞、PC-3M细胞
Oka-C1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:H-719细胞、NCI-H322细胞、HHFK细胞
P3/NS1/1-Ag4-1 Cells;背景说明:这是P3X63Ag8(ATCCTIB-9)的一个不分泌克隆。Kappa链合成了但不分泌。能抗0.1mM8-氮杂鸟嘌呤但不能在HAT培养基中生长。据报道它是由于缺失了3-酮类固醇还原酶活性的胆固醇营养缺陷型。检测表明肢骨发育畸形病毒(鼠痘)阴性。;传代方法:1:2传代,3天内可长满。;生长特性:悬浮生长;形态特性:淋巴母细胞;相关产品有:EU-3细胞、GM 2132细胞、SHP-77细胞
IMR32 Cells;背景说明:该细胞是1967年4月由NicholsWW,LeeJ和DwightS建立,来源于一名13月龄白人男婴腹部肿块,临床诊断为神经母细胞瘤,伴有极少部位的类器官样分化。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:存在两种细胞类型,小的神经母细胞样细胞和大的透明成纤维样细胞;相关产品有:Tu686细胞、TE8细胞、266 Bl细胞
HEK 293 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:WM266细胞、PaTu8988s细胞、LN382细胞
High Five Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:KLN-205细胞、SW-48细胞、D-341细胞
SU-DHL-4人B淋巴瘤细胞代次低|培养基|送STR图谱
HCC0070 Cells;背景说明:详见相关文献介绍;传代方法:1:4-1:6传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:NCIH1395细胞、TO 175.T细胞、DHL-16细胞
GP2-293 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:AM38细胞、COLO320-DM细胞、NCI-H1944细胞
HEK293S Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:Michigan Cancer Foundation-12A细胞、SUM149PT细胞、LNCaP.FGC细胞
NCIH929 Cells;背景说明:详见相关文献介绍;传代方法:保持细胞密度在5×105—1×106 cells/ml之间,每周换液2—3次;生长特性:悬浮生长 ;形态特性:淋巴母细胞样;相关产品有:U-251MG细胞、BC-022细胞、HCC 38细胞
TOV112 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代,3-4天换液1次。;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:SKHEP-1细胞、MES-SA/Dx-5细胞、Normal Rat, August 3, 1983细胞
TE 85 ClF-5 Cells;背景说明:骨肉瘤;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:IGROV细胞、UMNSAH-DF 1细胞、DMS 79细胞
BEAS-2B Cells;背景说明:从一位非癌个体的正常人支气管上皮病理切片分离出上皮细胞。这些细胞用腺病毒12-SV40病毒杂交病毒感染并克隆。DEAS-2B细胞保留了对血清反应进行鳞关分化的能力,并有用于筛选诱导或影响分化及致癌的化学或生物制剂。细胞角蛋白及SV40抗原染色阳性。;传代方法:消化3-5分钟。1:2。3天内可长满;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:HCC0202细胞、BL2141细胞、NCI-H1688细胞
DMS273 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:D-283 Med细胞、H2030细胞、DHL-4细胞
BayGenomics ES cell line DTM024 Cells(提供STR鉴定图谱)
BayGenomics ES cell line TEA204 Cells(提供STR鉴定图谱)
CCRC-M77 Cells(提供STR鉴定图谱)
MA-89 Cells(提供STR鉴定图谱)
Royan B16 Cells(提供STR鉴定图谱)
T3 [Rat mesothelioma] Cells(提供STR鉴定图谱)
" "PubMed=371794
Epstein A.L., Kaplan H.S.
Feeder layer and nutritional requirements for the establishment and cloning of human malignant lymphoma cell lines.
Cancer Res. 39:1748-1759(1979)
PubMed=2985879; DOI=10.1016/0145-2126(85)90084-0
Drexler H.G., Gaedicke G., Minowada J.
Isoenzyme studies in human leukemia-lymphoma cell lines -- 1 carboxylic esterase.
Leuk. Res. 9:209-229(1985)
PubMed=3159941; DOI=10.1016/0145-2126(85)90134-1
Drexler H.G., Gaedicke G., Minowada J.
Isoenzyme studies in human leukemia-lymphoma cell lines -- III Beta-hexosaminidase (E.C. 3.2.1.30).
Leuk. Res. 9:549-559(1985)
PubMed=3874327; DOI=10.1016/0145-2126(85)90133-x
Drexler H.G., Gaedicke G., Minowada J.
Isoenzyme studies in human leukemia-lymphoma cells lines -- II. Acid phosphatase.
Leuk. Res. 9:537-548(1985)
PubMed=3881165; DOI=10.1016/0165-4608(85)90186-4
Kaiser-McCaw Hecht B., Epstein A.L., Berger C.S., Kaplan H.S., Hecht F.
Histiocytic lymphoma cell lines: immunologic and cytogenetic studies.
Cancer Genet. Cytogenet. 14:205-218(1985)
PubMed=2875799; DOI=10.1016/0092-8674(86)90362-4
Cleary M.L., Smith S.D., Sklar J.
Cloning and structural analysis of cDNAs for bcl-2 and a hybrid bcl-2/immunoglobulin transcript resulting from the t(14;18) translocation.
Cell 47:19-28(1986)
PubMed=8547074; DOI=10.1111/j.1365-2141.1995.tb05302.x
Siebert R., Willers C.P., Schramm A., Fossa A., Dresen I.M.G., Uppenkamp M.J., Nowrousian M.R., Seeber S., Opalka B.
Homozygous loss of the MTS1/p16 and MTS2/p15 genes in lymphoma and lymphoblastic leukaemia cell lines.
Br. J. Haematol. 91:350-354(1995)
DOI=10.11418/jtca1981.15.4_211
Matsuo Y., Okochi A., Ariyasu T., Iimura E., Ohno T.
Identification of cell lines with variable numbers of tandem repeat (VNTR) amplified by polymerase chain reaction.
Tissue Cult. Res. Commun. 15:211-219(1996)
PubMed=8957066; DOI=10.1111/j.1349-7006.1996.tb03112.x; PMCID=PMC5920998
Kawasaki N., Matsuo Y., Yoshino T., Yanai H., Oka T., Teramoto N., Liu C., Kondo E., Minowada J., Akagi T.
Metastatic potential of lymphoma/leukemia cell lines in SCID mice is closely related to expression of CD44.
Jpn. J. Cancer Res. 87:1070-1077(1996)
PubMed=9738977; DOI=10.1111/j.1349-7006.1998.tb03275.x; PMCID=PMC5921886
Takizawa J., Suzuki R., Kuroda H., Utsunomiya A., Kagami Y., Joh T., Aizawa Y., Ueda R., Seto M.
Expression of the TCL1 gene at 14q32 in B-cell malignancies but not in adult T-cell leukemia.
Jpn. J. Cancer Res. 89:712-718(1998)
PubMed=9787181; DOI=10.1182/blood.V92.9.3410
Sakai A., Thieblemont C., Wellmann A., Jaffe E.S., Raffeld M.
PTEN gene alterations in lymphoid neoplasms.
Blood 92:3410-3415(1998)
PubMed=10739008; DOI=10.1016/S0145-2126(99)00182-4
Inoue K., Kohno T., Takakura S., Hayashi Y., Mizoguchi H., Yokota J.
Frequent microsatellite instability and BAX mutations in T cell acute lymphoblastic leukemia cell lines.
Leuk. Res. 24:255-262(2000)
DOI=10.1016/B978-0-12-221970-2.50457-5
Drexler H.G.
The leukemia-lymphoma cell line factsbook.
(In book) ISBN 9780122219702; pp.1-733; Academic Press; London; United Kingdom (2001)
PubMed=11226526; DOI=10.1016/S0145-2126(00)00121-1
Inoue K., Kohno T., Takakura S., Hayashi Y., Mizoguchi H., Yokota J.
Corrigendum to: Frequent microsatellite instability and BAX mutations in T cell acute lymphoblastic leukemia cell lines Leukemia Research 24 (2000), 255-262.
Leuk. Res. 25:275-278(2001)
PubMed=12169673; DOI=10.1016/S1525-1578(10)60693-9; PMCID=PMC1906980
Robetorye R.S., Bohling S.D., Morgan J.W., Fillmore G.C., Lim M.S., Elenitoba-Johnson K.S.J.
Microarray analysis of B-cell lymphoma cell lines with the t(14;18).
J. Mol. Diagn. 4:123-136(2002)
PubMed=17363600; DOI=10.1158/0008-5472.CAN-06-3254
Strauss S.J., Higginbottom K., Juliger S., Maharaj L., Allen P., Schenkein D., Lister T.A., Joel S.P.
The proteasome inhibitor bortezomib acts independently of p53 and induces cell death via apoptosis and mitotic catastrophe in B-cell lymphoma cell lines.
Cancer Res. 67:2783-2790(2007)
PubMed=18357372; DOI=10.3892/or.19.4.889
Pop I., Pop L., Vitetta E.S., Ghetie M.-A.
Generation of multidrug resistant lymphoma cell lines stably expressing P-glycoprotein.
Oncol. Rep. 19:889-895(2008)
PubMed=19278952; DOI=10.1182/blood-2009-01-202028; PMCID=PMC3401058
Li C., Kim S.-W., Rai D., Bolla A.R., Adhvaryu S., Kinney M.C., Robetorye R.S., Aguiar R.C.T.
Copy number abnormalities, MYC activity, and the genetic fingerprint of normal B cells mechanistically define the microRNA profile of diffuse large B-cell lymphoma.
Blood 113:6681-6690(2009)
PubMed=20054396; DOI=10.1038/nature08638; PMCID=PMC2845535
Davis R.E., Ngo V.N., Lenz G., Tolar P., Young R.M., Romesser P.B., Kohlhammer H., Lamy L., Zhao H., Yang Y.-D., Xu W.-H., Shaffer A.L. 3rd, Wright G., Xiao W.-M., Powell J.I., Jiang J.-K., Thomas C.J., Rosenwald A., Ott G., Muller-Hermelink H.-K., Gascoyne R.D., Connors J.M., Johnson N.A., Rimsza L.M., Campo E., Jaffe E.S., Wilson W.H., Delabie J., Smeland E.B., Fisher R.I., Braziel R.M., Tubbs R.R., Cook J.R., Weisenburger D.D., Chan W.-C., Pierce S.K., Staudt L.M.
Chronic active B-cell-receptor signalling in diffuse large B-cell lymphoma.
Nature 463:88-92(2010)
PubMed=20628145; DOI=10.1182/blood-2010-05-282780; PMCID=PMC2995356
Green M.R., Monti S., Rodig S.J., Juszczynski P., Currie T., O'Donnell E., Chapuy B., Takeyama K., Neuberg D., Golub T.R., Kutok J.L., Shipp M.A.
Integrative analysis reveals selective 9p24.1 amplification, increased PD-1 ligand expression, and further induction via JAK2 in nodular sclerosing Hodgkin lymphoma and primary mediastinal large B-cell lymphoma.
Blood 116:3268-3277(2010)
PubMed=20889926; DOI=10.1182/blood-2010-06-290437; PMCID=PMC3037744
Pham L.V., Fu L.-C., Tamayo A.T., Bueso-Ramos C.E., Drakos E., Vega-Vazquez F., Medeiros L.J., Ford R.J. Jr.
Constitutive BR3 receptor signaling in diffuse, large B-cell lymphomas stabilizes nuclear factor-kappaB-inducing kinase while activating both canonical and alternative nuclear factor-kappaB pathways.
Blood 117:200-210(2011)
PubMed=22460905; DOI=10.1038/nature11003; PMCID=PMC3320027
Barretina J.G., Caponigro G., Stransky N., Venkatesan K., Margolin A.A., Kim S., Wilson C.J., Lehar J., Kryukov G.V., Sonkin D., Reddy A., Liu M., Murray L., Berger M.F., Monahan J.E., Morais P., Meltzer J., Korejwa A., Jane-Valbuena J., Mapa F.A., Thibault J., Bric-Furlong E., Raman P., Shipway A., Engels I.H., Cheng J., Yu G.-Y.K., Yu J.-J., Aspesi P. Jr., de Silva M., Jagtap K., Jones M.D., Wang L., Hatton C., Palescandolo E., Gupta S., Mahan S., Sougnez C., Onofrio R.C., Liefeld T., MacConaill L.E., Winckler W., Reich M., Li N.-X., Mesirov J.P., Gabriel S.B., Getz G., Ardlie K., Chan V., Myer V.E., Weber B.L., Porter J., Warmuth M., Finan P., Harris J.L., Meyerson M.L., Golub T.R., Morrissey M.P., Sellers W.R., Schlegel R., Garraway L.A.
The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity.
Nature 483:603-607(2012)
PubMed=23292937; DOI=10.1073/pnas.1205299110; PMCID=PMC3557051
Zhang J., Grubor V., Love C.L., Banerjee A., Richards K.L., Mieczkowski P.A., Dunphy C., Choi W.W.-L., Au W.Y., Srivastava G., Lugar P.L., Rizzieri D.A., Lagoo A.S., Bernal-Mizrachi L., Mann K.P., Flowers C.R., Naresh K.N., Evens A.M., Gordon L.I., Czader M.B., Gill J.I., Hsi E.D., Liu Q.-Q., Fan A., Walsh K., Jima D., Smith L.L., Johnson A.J., Byrd J.C., Luftig M.A., Ni T., Zhu J., Chadburn A., Levy S., Dunson D.B., Dave S.S.
Genetic heterogeneity of diffuse large B-cell lymphoma.
Proc. Natl. Acad. Sci. U.S.A. 110:1398-1403(2013)
PubMed=25355872; DOI=10.1128/JVI.02570-14; PMCID=PMC4301145
Cao S.-B., Strong M.J., Wang X., Moss W.N., Concha M., Lin Z., O'Grady T., Baddoo M., Fewell C., Renne R., Flemington E.K.
High-throughput RNA sequencing-based virome analysis of 50 lymphoma cell lines from the Cancer Cell Line Encyclopedia project.
J. Virol. 89:713-729(2015)
PubMed=25485619; DOI=10.1038/nbt.3080
Klijn C., Durinck S., Stawiski E.W., Haverty P.M., Jiang Z.-S., Liu H.-B., Degenhardt J., Mayba O., Gnad F., Liu J.-F., Pau G., Reeder J., Cao Y., Mukhyala K., Selvaraj S.K., Yu M.-M., Zynda G.J., Brauer M.J., Wu T.D., Gentleman R.C., Manning G., Yauch R.L., Bourgon R., Stokoe D., Modrusan Z., Neve R.M., de Sauvage F.J., Settleman J., Seshagiri S., Zhang Z.-M.
A comprehensive transcriptional portrait of human cancer cell lines.
Nat. Biotechnol. 33:306-312(2015)
PubMed=25877200; DOI=10.1038/nature14397
Yu M., Selvaraj S.K., Liang-Chu M.M.Y., Aghajani S., Busse M., Yuan J., Lee G., Peale F.V., Klijn C., Bourgon R., Kaminker J.S., Neve R.M.
A resource for cell line authentication, annotation and quality control.
Nature 520:307-311(2015)
PubMed=25894527; DOI=10.1371/journal.pone.0121314; PMCID=PMC4404347
Bausch-Fluck D., Hofmann A., Bock T., Frei A.P., Cerciello F., Jacobs A., Moest H., Omasits U., Gundry R.L., Yoon C., Schiess R., Schmidt A., Mirkowska P., Hartlova A.S., Van Eyk J.E., Bourquin J.-P., Aebersold R., Boheler K.R., Zandstra P.W., Wollscheid B.
A mass spectrometric-derived cell surface protein atlas.
PLoS ONE 10:E0121314-E0121314(2015)
PubMed=26589293; DOI=10.1186/s13073-015-0240-5; PMCID=PMC4653878
Scholtalbers J., Boegel S., Bukur T., Byl M., Goerges S., Sorn P., Loewer M., Sahin U., Castle J.C.
TCLP: an online cancer cell line catalogue integrating HLA type, predicted neo-epitopes, virus and gene expression.
Genome Med. 7:118.1-118.7(2015)
PubMed=26727417; DOI=10.3109/10428194.2015.1108414
Drexler H.G., Eberth S., Nagel S., MacLeod R.A.F.
Malignant hematopoietic cell lines: in vitro models for double-hit B-cell lymphomas.
Leuk. Lymphoma 57:1015-1020(2016)
PubMed=27397505; DOI=10.1016/j.cell.2016.06.017; PMCID=PMC4967469
Iorio F., Knijnenburg T.A., Vis D.J., Bignell G.R., Menden M.P., Schubert M., Aben N., Goncalves E., Barthorpe S., Lightfoot H., Cokelaer T., Greninger P., van Dyk E., Chang H., de Silva H., Heyn H., Deng X.-M., Egan R.K., Liu Q.-S., Miroo T., Mitropoulos X., Richardson L., Wang J.-H., Zhang T.-H., Moran S., Sayols S., Soleimani M., Tamborero D., Lopez-Bigas N., Ross-Macdonald P., Esteller M., Gray N.S., Haber D.A., Stratton M.R., Benes C.H., Wessels L.F.A., Saez-Rodriguez J., McDermott U., Garnett M.J.
A landscape of pharmacogenomic interactions in cancer.
Cell 166:740-754(2016)
PubMed=28196595; DOI=10.1016/j.ccell.2017.01.005; PMCID=PMC5501076
Li J., Zhao W., Akbani R., Liu W.-B., Ju Z.-L., Ling S.-Y., Vellano C.P., Roebuck P., Yu Q.-H., Eterovic A.K., Byers L.A., Davies M.A., Deng W.-L., Gopal Y.N.V., Chen G., von Euw E.M., Slamon D.J., Conklin D., Heymach J.V., Gazdar A.F., Minna J.D., Myers J.N., Lu Y.-L., Mills G.B., Liang H.
Characterization of human cancer cell lines by reverse-phase protein arrays.
Cancer Cell 31:225-239(2017)
PubMed=28356514; DOI=10.1073/pnas.1700682114; PMCID=PMC5393253
Chen J., Zhang Y., Petrus M.N., Xiao W.-M., Nicolae A., Raffeld M., Pittaluga S., Bamford R.N., Nakagawa M., Ouyang S.T.-Y., Epstein A.L., Kadin M.E., Del Mistro A., Woessner R.D., Jaffe E.S., Waldmann T.A.
Cytokine receptor signaling is required for the survival of ALK- anaplastic large cell lymphoma, even in the presence of JAK1/STAT3 mutations.
Proc. Natl. Acad. Sci. U.S.A. 114:3975-3980(2017)
PubMed=29416618; DOI=10.18632/oncotarget.20378; PMCID=PMC5787470
Liu W., Chen J., Tamayo A.T., Ruan C.-G., Li L., Zhou S.-H., Shen C., Young K.H., Westin J., Davis R.E., Hu S.-M., Medeiros L.J., Ford R.J. Jr., Pham L.V.
Preclinical efficacy and biological effects of the oral proteasome inhibitor ixazomib in diffuse large B-cell lymphoma.
Oncotarget 9:346-360(2018)
PubMed=29666304; DOI=10.1158/1078-0432.CCR-17-3004
Pham L.V., Huang S.-J., Zhang H., Zhang J., Bell T., Zhou S.-H., Pogue E., Ding Z.-Y., Lam L., Westin J., Davis R.E., Young K.H., Medeiros L.J., Ford R.J. Jr., Nomie K., Zhang L., Wang M.
Strategic therapeutic targeting to overcome venetoclax resistance in aggressive B-cell lymphomas.
Clin. Cancer Res. 24:3967-3980(2018)
PubMed=30165192; DOI=10.1016/j.canlet.2018.08.020
Qu C.-J., Kunkalla K., Vaghefi A., Frederiksen J.K., Liu Y.-D., Chapman J.R., Blonska M., Bernal-Mizrachi L., Alderuccio J.P., Lossos I.S., Landgraf R., Vega-Vazquez F.
Smoothened stabilizes and protects TRAF6 from degradation: a novel non-canonical role of smoothened with implications in lymphoma biology.
Cancer Lett. 436:149-158(2018)
PubMed=30285677; DOI=10.1186/s12885-018-4840-5; PMCID=PMC6167786
Tan K.-T., Ding L.-W., Sun Q.-Y., Lao Z.-T., Chien W., Ren X., Xiao J.-F., Loh X.-Y., Xu L., Lill M., Mayakonda A., Lin D.-C., Yang H.H., Koeffler H.P.
Profiling the B/T cell receptor repertoire of lymphocyte derived cell lines.
BMC Cancer 18:940.1-940.13(2018)
PubMed=30629668; DOI=10.1371/journal.pone.0210404; PMCID=PMC6328144
Uphoff C.C., Pommerenke C., Denkmann S.A., Drexler H.G.
Screening human cell lines for viral infections applying RNA-Seq data analysis.
PLoS ONE 14:E0210404-E0210404(2019)
PubMed=30894373; DOI=10.1158/0008-5472.CAN-18-2747; PMCID=PMC6445675
Dutil J., Chen Z.-H., Monteiro A.N.A., Teer J.K., Eschrich S.A.
An interactive resource to probe genetic diversity and estimated ancestry in cancer cell lines.
Cancer Res. 79:1263-1273(2019)
PubMed=31068700; DOI=10.1038/s41586-019-1186-3; PMCID=PMC6697103
Ghandi M., Huang F.W., Jane-Valbuena J., Kryukov G.V., Lo C.C., McDonald E.R. 3rd, Barretina J.G., Gelfand E.T., Bielski C.M., Li H.-X., Hu K., Andreev-Drakhlin A.Y., Kim J., Hess J.M., Haas B.J., Aguet F., Weir B.A., Rothberg M.V., Paolella B.R., Lawrence M.S., Akbani R., Lu Y.-L., Tiv H.L., Gokhale P.C., de Weck A., Mansour A.A., Oh C., Shih J., Hadi K., Rosen Y., Bistline J., Venkatesan K., Reddy A., Sonkin D., Liu M., Lehar J., Korn J.M., Porter D.A., Jones M.D., Golji J., Caponigro G., Taylor J.E., Dunning C.M., Creech A.L., Warren A.C., McFarland J.M., Zamanighomi M., Kauffmann A., Stransky N., Imielinski M., Maruvka Y.E., Cherniack A.D., Tsherniak A., Vazquez F., Jaffe J.D., Lane A.A., Weinstock D.M., Johannessen C.M., Morrissey M.P., Stegmeier F., Schlegel R., Hahn W.C., Getz G., Mills G.B., Boehm J.S., Golub T.R., Garraway L.A., Sellers W.R.
Next-generation characterization of the Cancer Cell Line Encyclopedia.
Nature 569:503-508(2019)"