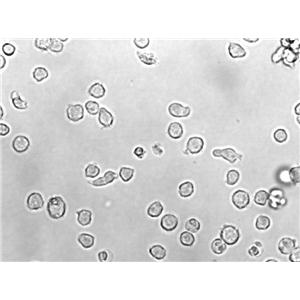
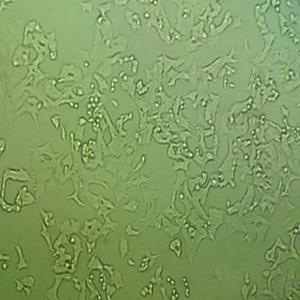
"U-937人组织细胞淋巴瘤细胞代次低|培养基|送STR图谱
传代比例:1:2-1:4(首次传代建议1:2)
生长特性:悬浮生长
公司细胞系形态漂亮、增殖倍数高、纯度高、功能性强,细胞培养就跟养孩子一个样。养孩子要喂奶,养细胞要加补液,都需要在前期补充足够的营养,初始状态的细胞或刚刚复苏的细胞还要适量加入血清或细胞因子来帮助它们的存活增殖,如果营养物质缺乏,细胞就会不生长甚至死亡。养孩子要从小培养学习,养细胞也得培养宝宝顺利生下来,你会经常抚摸他,给他看各种颜色,刺激他的五感。细胞也是一样,分离后的细胞需要使用特定的细胞因子进行活化、增殖。另外加入因子的种类、因子的浓度、加入时间、加入顺序都会影响细胞最终的结果。养孩子最怕孩子生病,养细胞最怕被污染,平时你会仔细观察宝宝是否呕吐、是否突然哭闹,猜测宝宝是否生病了。对于细胞,我们也需要时刻进行观察的,假如培养液浑浊(污染了),则需要换液后加抗生素;假如细胞增殖不明显,形态变差,则可能是因为营养不足了,对贴壁细胞可以消化后重新用新的培养基接种并加倍加入细胞因子含量;对悬浮细胞增殖能力不强的,则不着急补液,只是先补加血清、细胞因子看是否可以好转。培养时还得全程在无菌的环境,一个小小的偏差,细胞就会死亡。
换液周期:每周2-3次
CV-1 in Origin Simian-7 Cells;背景说明:此细胞株源自CV-1细胞株,经转染起始点缺失的SV40病毒突变体得到;编码表达野生型T抗原,所以该细胞适合作为需要SV40T抗原表达的载体的转染宿主。该细胞表达T抗原,允许SV40病毒的溶解性生长,支持40℃时温度敏感性A209病毒的复制,支持起始区域缺陷的SV40突变体的复制。因含有SV40病毒的DNA序列,该细胞需要在2级生物安全柜中操作。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:成纤维细胞样;相关产品有:MCF-7/ADR细胞、U937细胞、Vero C1008细胞
NCIH1184 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:AU-565细胞、H498细胞、H-847细胞
RA.1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:TT细胞、H-1092细胞、COLO 680N细胞
U-937人组织细胞淋巴瘤细胞代次低|培养基|送STR图谱
背景信息:该细胞是由NilssonK实验室于1974年从一名37岁的患有恶性组织细胞性淋巴瘤的白人男性的胸水中分离建立的。1979年来的研究显示该细胞在人混合淋巴细胞培养物上清、佛波酯、VitD3、γ-IFN、TNF和维A的诱导下可以向终末单核细胞分化。该细胞不合成免疫球蛋白,EBV阴性;可产生溶菌酶、β-2-微球蛋白,受刺激后可产生TNF-α;表达C3R;可作转染宿主;表达Fas,对TNF和抗Fas的抗体敏感。
┈订┈购(技术服务)┈热┈线:1┈3┈6┈4┈1┈9┈3┈0┈7┈9┈1【微信同号】┈Q┈Q:3┈1┈8┈0┈8┈0┈7┈3┈2┈4;
DSMZ菌株保藏中心成立于1969年,是德国的国家菌种保藏中心。该中心一直致力于细菌、真菌、质粒、抗菌素、人体和动物细胞、植物病毒等的分类、鉴定和保藏工作。DSMZ菌种保藏中心是欧洲规模最大的生物资源中心,保藏有动物细胞500多株。Riken BRC成立于1920年,是英国的国家菌种保藏中心。该中心一直致力于细菌、真菌、植物病毒等的分类、鉴定和保藏工作。日本Riken BRC(Riken生物资源保藏中心)是全球三大典型培养物收集中心之一。Riken保藏中心提供了很多细胞系。在世界范围内,这些细胞系,都在医学、科学和兽医中具有重要意义。Riken生物资源中心支持了各种学术、健康、食品和兽医机构的研究工作,并在世界各地不同组织的微生物实验室和研究机构中使用。
产品包装:复苏发货:T25培养瓶(一瓶)或冻存发货:1ml冻存管(两支)
来源说明:细胞主要来源ATCC、ECACC、DSMZ、RIKEN等细胞库
U-937人组织细胞淋巴瘤细胞代次低|培养基|送STR图谱
物种来源:人源、鼠源等其它物种来源
Hs888T Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;每周换液2-3次;生长特性:贴壁生长;形态特性:成纤维细胞和上皮细胞的混合样;相关产品有:C4 I细胞、LPC-H12细胞、GOS3细胞
SU.86.86 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:D6P2T细胞、U031细胞、IMR90细胞
MBdSMC Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NCIH810细胞、MC3T3-E细胞、HCT.116细胞
Fetal Human Colon Cells;背景说明:胎儿;结肠;自发永生;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:GM04154细胞、PBMC细胞、SR786细胞
┈订┈购(技术服务)┈热┈线:1┈3┈6┈4┈1┈9┈3┈0┈7┈9┈1【微信同号】┈Q┈Q:3┈1┈8┈0┈8┈0┈7┈3┈2┈4;
形态特性:淋巴母细胞样
细胞冻存复苏材料与方法步骤:常用的细胞冷冻贮存器为贮存器,规格有35L和50L两种。使用时要注意以下几点:(1)一般两周需充一次,至少一个月充一次。温度达-196℃,使用时注意勿让溅到皮肤上,以免引起冻伤。(2)容器为双层结构,中间为真空层,瓶口有双层焊接处,应防止焊接部裂开。(3)在装入时,要注意缓慢小心,并用厚纸卷筒或制漏斗作引导,使直达瓶底,如有专用灌注装置则更HAO。若为初次使用,加时更要缓慢,以免温度骤降而使容器损坏。细胞冻存时常备的材料有:0.25%胰蛋白酶,含10%~20%的血清培养,DMSO(分析纯)或无色新鲜甘油(121°C蒸气GAO压消毒),2mL安瓿(或专用细胞冻存管)、吸管、离心管、喷灯、纱布袋(或冻存管架)等。主要操作步骤为:(1)选择处于对数生长期的细胞,在冻存前一天ZuiHAO换。将多个培养瓶中的细胞培养 去掉,用0.25%胰蛋白酶消化。适时去掉胰蛋白酶,加入少量新培养。用吸管吸取培养反复吹打瓶壁上的细胞,使其成为均匀分散的细胞悬。悬浮生产细胞则不要消化处理。然后将细胞收集于离心管中离心(1000r/min,10分钟)。(2)去上清,加入含20%小牛血清的完全培养基,于4℃预冷15分钟后,逐滴加入已无菌的DMSO或甘油,用吸管轻轻吹打使细胞均匀,细胞浓度为3×106~1×107/mL之间。(3)将上述细胞分装于安瓿或专用冷冻塑料管中,安瓿装1~1.5mL在火焰喷灯上封口,封口处要完全封闭,圆滑无勾。冷冻管要将盖子盖紧,并标记HAO细胞名称和冻存日期,同时作HAO登记(日期、细胞种类及代次、冻存支数)。(4)将装HAO细胞的安瓿或冻存管装入沙布袋内;置于容器颈口处存放过夜,次日转入中。采用控制降温速度的方法也可采用下列步骤:先将安瓿置入4℃冰箱中2~3小时,再移至冰箱冷冻室内3~4小时,再吊入容器颈气态部分存放2小时,Zui后沉入中。细胞冻存在中可以长期保存,但为妥善起见,冻存半年后,ZuiHAO取出一只安瓿细胞复苏培养,观察生长情况,然后再继续冻存。
X63Ag8-653 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:HCMEC(BL12-H)细胞、HCCLM3细胞、GNM细胞
DLD-1 Cells;背景说明:DLD-1是1977-1979年间D.L.Dexter和同事分离的两株结直肠腺癌细胞株中的一株。在ATCC和其它地方进行的DNAfingerprinting和染色体组型分析表明这株细胞与HCT-15(CCL-225)相似,说明这两者是来自同一个人的不同克隆。他们的遗传起源可通过DNAfingerprinting证实,但染色体组型分析显示它们缺乏染色体标记一致改变或数目上一致改变。细胞的CSAp阴性(CSAp-)。DLD-1细胞的p53抗原表达呈阳性(p53抗原产生了一个C->;传代方法:消化5分钟。1:2。4-5天长满。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:HCC1419细胞、BGC-823细胞、LS1034细胞
SKNMC Cells;背景说明:这株细胞与HTB-11都是神经源的。1971年9月分离得到SK-N-MC后,发现它有中性多巴胺-β-羟化酶活性,也有细胞内儿茶胺,用甲醛可以诱导出荧光。;传代方法:1:6-1:12传代,每周2-3次换液。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:KU812-F细胞、BC-028细胞、CAL 39细胞
MDA-MB-134 Cells;背景说明:该细胞1973年由R. Cailleau建系,源自74岁乳腺导管癌女性患者的胸腔积液,细胞生长缓慢,松散贴壁,生长过程中会脱落到培养基,不会汇合,过表达FGF受体;传代方法:1:2—1:4传代,每周换液2—3次;生长特性:松散贴壁生长;形态特性:上皮细胞样;相关产品有:OVCA432细胞、Tu212细胞、624-mel细胞
C8166 Cells;背景说明:T淋巴细胞白血病;HTLV-1转化;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:T 84细胞、Pa17C细胞、L-929细胞
HEC-1-B Cells;背景说明:该细胞是H.Kuramoto1968年分离的HEC-1-A细胞亚株。不同於HEC-A-1的是:该亚株在培养第135天到190天之间表现出稳定的生长周期,且重现扁平,与亲本细胞系相比更具铺路石式样。此外主要染色体组是亲本细胞的两倍。;传代方法:1:3传代,2-3天换液一次;生长特性:贴壁生长;形态特性:上皮样;相关产品有:QBC939细胞、BrCL15细胞、KP-4细胞
LN382 Cells;背景说明:胶质瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:526mel细胞、PL5细胞、GC1-SPG细胞
C3H/10T1/2 clone 8 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:TE 32细胞、PIG1细胞、RPMI-8402细胞
PANC 1005 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:BEP2D细胞、Psi-2-DAP细胞、JVM-3细胞
NCI-H196 Cells;背景说明:详见相关文献介绍;传代方法:1:4-1:6传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:NIE-115细胞、Centre Antoine Lacassagne-12T细胞、L615细胞
HS940 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:Panc_02_03细胞、Anip-973细胞、A-9细胞
10T1/2 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:BGC-823细胞、MT2细胞、NTERA2细胞
Hs 294T Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:4传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:混合星状和多边形;相关产品有:NTERA-2 clone D1细胞、OVCAR.5细胞、CHL细胞
Hs 274 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代,每周换液2-3次。;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:CFPAC-1细胞、TK-10细胞、AML 12细胞
NCI-H2081 Cells;背景说明:详见相关文献介绍;传代方法:随细胞的密度而增加;生长特性:悬浮生长;形态特性:聚团悬浮;相关产品有:NCI-H102细胞、Mouse podocyte细胞、Evsa-T细胞
MDCC-MSB-1 Cells;背景说明:淋巴瘤;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:C-33-A细胞、RDES-1细胞、NCI-H1623细胞
TGW Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:神经元细胞;相关产品有:Clone Y-1细胞、ARO细胞、RCC-JF细胞
201B3 Cells(提供STR鉴定图谱)
Abcam HeLa NOTCH1 KO Cells(提供STR鉴定图谱)
AG24178 Cells(提供STR鉴定图谱)
BayGenomics ES cell line RRG392 Cells(提供STR鉴定图谱)
BayGenomics ES cell line XH065 Cells(提供STR鉴定图谱)
C0929 Cells(提供STR鉴定图谱)
CY123 Cells(提供STR鉴定图谱)
DRS [Rabbit] Cells(提供STR鉴定图谱)
GM03813 Cells(提供STR鉴定图谱)
HCASMC Cells;背景说明:冠状动脉平滑肌;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NR-8383细胞、J-774细胞、MA-104细胞
U-937人组织细胞淋巴瘤细胞代次低|培养基|送STR图谱
LO2 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:IOSE 29细胞、NR 8383细胞、Hs 695T细胞
HeLa S 3 Cells;背景说明:该细胞是1955年由PuckTT,MarcusPI和CieciuraSJ建系的,含HPV-18序列;角蛋白阳性;可用于与染色体突变、细胞营养、集落形成相关的哺乳动物细胞的克隆分析。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:YD-38细胞、C2BBe 1细胞、L-363细胞
SH-SY5Y Parental Cells;背景说明:据报道,该细胞的密度可高达1×106cells/cm2,具有中等水平的多巴胺β羟化酶的活性。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:KYSE-70细胞、YD38细胞、Calu6细胞
T-98G Cells;背景说明:详见相关文献介绍;传代方法:按1:3传代;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:COLO 320DM细胞、TC7细胞、MV-522细胞
Intestinal Epithelioid Cell line No. 18 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:Hx-147细胞、H510A细胞、NIH:OVCAR3细胞
6C2 Cells(提供STR鉴定图谱)
Hs606 Cells;背景说明:详见相关文献介绍;传代方法:1:2—1:3传代,2—3天换液一次;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:JHH7细胞、HDMEC细胞、Panc 8.13细胞
AAV293 Cells;背景说明:我们推荐使用AAV-293细胞株繁殖腺病毒相关重组病毒。 AAV-293源自普遍使用的 HEK293细胞株,但产生的病毒滴度更高。 HEK293细胞是剪切过的腺病毒5型DNA转染的人胚肾细胞。 跟HEK293细胞一样,AAV-293细胞反式表达腺病毒E1基因,当共转染三个AAV助质粒(一个含ITR的质粒,pAAV-RC, 和E1缺失助质粒)时,可以产生有感染力的腺病毒-相关病毒颗粒。;传代方法:消化3-5分钟。1:2。3天内可长满。;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:COS1细胞、MLE12细胞、NCIH2171细胞
LUDLU-1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:HOP62细胞、SY5Y细胞、NCIH1734细胞
SVEC 4-10 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:H-711细胞、RMG-1细胞、GLC-82细胞
TGW Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:神经元细胞;相关产品有:Clone Y-1细胞、ARO细胞、RCC-JF细胞
NH6 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;每周换液2-3次;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:MonoMac6细胞、WERI细胞、HDQ-P1细胞
SKNBE-1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:SKOV-433细胞、BC3H-1细胞、JS1细胞
RPVSMC Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:SUM-149细胞、NCI-H1651细胞、NCIH1975细胞
GXRCas9 Cells(提供STR鉴定图谱)
HAP1 PRKRIR (-) 1 Cells(提供STR鉴定图谱)
NPC-TW 039 Cells;背景说明:鼻咽癌;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Leghorn Male Hepatoma cell line细胞、LLC PK1细胞、CAL51细胞
MCMEC Cells;背景说明:心脏微血管;内皮 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:IB-RS2细胞、HUT28细胞、PC-3/M细胞
KYSE-140 Cells;背景说明:食管鳞癌细胞;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:MDA-MB-453细胞、PCI-SG231细胞、BV-2细胞
RK-13 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:CALU 1细胞、Hep II细胞、MES-23.5细胞
Jurkat Clone E6-1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:CNE2Z细胞、D-324MED细胞、RIN-m细胞
SW 756 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:G422细胞、RBL-1细胞、CCD 966SK细胞
LCD Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:NCI-SNU-520细胞、ISHI细胞、GM12878细胞
Caki-2 Cells;背景说明:该细胞源自一位69岁白人男性的初期肾腺癌组织;传代方法:1:3—1:6传代,每周换液2—3次;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:SK-Mel 1细胞、B16-F10-BL6细胞、MPVECs细胞
HUES 70 Cells(提供STR鉴定图谱)
L-929 F Cells(提供STR鉴定图谱)
MSCC-1 Cells(提供STR鉴定图谱)
ODSBFC_31->28_14 Cells(提供STR鉴定图谱)
RNK-7 Cells(提供STR鉴定图谱)
TUSMi009-A Cells(提供STR鉴定图谱)
UM-SCC-52 Cells(提供STR鉴定图谱)
HepLi5 Cells(提供STR鉴定图谱)
HO1-N-1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:143TK-细胞、NCIH847细胞、YD15细胞
SEG-1 Cells;背景说明:食管腺癌;胸腔积液转移;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:H-1522细胞、CNLMG-B5537SKIN细胞、AR4-2J细胞
Hs578Bst Cells;背景说明:乳腺 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:RCC10 RGB细胞、A427细胞、EFM192C细胞
Panc4.03 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:RMG-1细胞、EB2细胞、Melanoma 14细胞
MDA-MB231 Cells;背景说明:MDA-MB-231来自患有转移乳腺腺癌的51岁女病人的胸水。在裸鼠和ALS处理的BALB/c小鼠中,它能形成低分化腺癌(III级)。;传代方法:消化3-5分钟,1:2,3天内可长满;生长特性:贴壁生长;形态特性:上皮样;相关产品有:SF-126细胞、NCI-H1184细胞、TW-039细胞
MDA-MB231 Cells;背景说明:MDA-MB-231来自患有转移乳腺腺癌的51岁女病人的胸水。在裸鼠和ALS处理的BALB/c小鼠中,它能形成低分化腺癌(III级)。;传代方法:消化3-5分钟,1:2,3天内可长满;生长特性:贴壁生长;形态特性:上皮样;相关产品有:SF-126细胞、NCI-H1184细胞、TW-039细胞
TR 146 Cells;背景说明:食管鳞癌;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SW1222细胞、SNB19细胞、KM H-2细胞
32Dcl3 Cells;背景说明:骨髓淋巴瘤;C3H/HeJ;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:NIH3T3细胞、A 2780 CP细胞、WPMY-1细胞
H322 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:P3-x63-Ag8 653细胞、Jiyoye细胞、293F细胞
BCECs Cells;背景说明:脑;毛细血管;内皮 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:PANC403细胞、MCF-7/ADR-RES细胞、MDA-MB 468细胞
MDA-MB-231 Cells;背景说明:MDA-MB-231来自患有转移乳腺腺癌的51岁女病人的胸水。在裸鼠和ALS处理的BALB/c小鼠中,它能形成低分化腺癌(III级)。;传代方法:消化3-5分钟,1:2,3天内可长满;生长特性:贴壁生长;形态特性:上皮样;相关产品有:KYSE70细胞、MLA-144细胞、CTX TNA2细胞
MDAMB134VI Cells;背景说明:该细胞1973年由R. Cailleau建系,源自74岁乳腺导管癌女性患者的胸腔积液,细胞生长缓慢,松散贴壁,生长过程中会脱落到培养基,不会汇合,过表达FGF受体;传代方法:1:2—1:4传代,每周换液2—3次;生长特性:松散贴壁生长;形态特性:上皮细胞样;相关产品有:R2C细胞、HCC0015细胞、RPMI 1846细胞
BCPAP Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长 ;形态特性:详见产品说明书;相关产品有:NCCIT细胞、X63-AG 8.653细胞、COLO-357细胞
HuTu-80 Cells;背景说明:详见相关文献介绍;传代方法:1:2—1:5传代,每周换液2-3次;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:Alpha Mouse Liver 12细胞、3T3-L1 ad细胞、Vero from pool #76细胞
H-2227 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:4传代;每周换液2次。;生长特性:该细胞既有悬浮生长,又有贴壁生长;形态特性:上皮细胞;相关产品有:HT1197细胞、HUT 125细胞、J.E6-1细胞
SZ-DM15 Cells(提供STR鉴定图谱)
H-209 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:4传代;每周换液2次。;生长特性:悬浮生长,有少数细胞疏松贴壁;形态特性:上皮样;相关产品有:253J-BV细胞、UCLA RO-81A-1细胞、KS-1 [Human glioblastoma]细胞
BERH-2 Cells;背景说明:肝癌;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:MM1-S细胞、HL-7702细胞、Roswell Park Memorial Institute 2650细胞
MV4;11 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:Transformed Human Liver Epithelial-2细胞、LICR-HN6细胞、PA1细胞
H-2452 Cells;背景说明:详见相关文献介绍;传代方法:消化3-5分钟。1:2。3天内可长满。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:S-16细胞、hOMF细胞、BCaP 37细胞
Hep G2-Luc Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:SUDHL-5细胞、A673细胞、Ls-174-T细胞
SK-RC 39 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:TE-15细胞、HT1080细胞、NCI.H23细胞
U-937人组织细胞淋巴瘤细胞代次低|培养基|送STR图谱
AR-42J Cells;背景说明:在肾上腺皮质激素刺激下可诱导出外分泌活性,并伴有广泛的内质网重构。;传代方法:消化3-5分钟。1:2。3天内可长满。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:SCC4细胞、RAEC细胞、RCC_7860细胞
PC-9/GR Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:PC 61-5-3细胞、NCI-H2172细胞、MDA MB 134VI细胞
H-1522 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:KNS-42细胞、CAL-78细胞、Hs 766.T细胞
HEK293 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:U-343-MG细胞、A375S2细胞、MA-c细胞
SVEC 4-10 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:H-711细胞、HDSMC细胞、Ramos (RA 1)细胞
Rat Lung Epithelial-6-T-antigen Negative Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:上皮细胞样;相关产品有:U-87 MG细胞、SR细胞、SKLU-1细胞
HCC941122 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:NCI-H498细胞、H226细胞、AG06814-N细胞
HEL299 Cells;背景说明:红白细胞白血病;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:NCI-H727细胞、UPCI:SCC090细胞、H-1437细胞
BayGenomics ES cell line RRK454 Cells(提供STR鉴定图谱)
BayGenomics ES cell line XM256 Cells(提供STR鉴定图谱)
GM11687 Cells(提供STR鉴定图谱)
OP6 Cells(提供STR鉴定图谱)
24/04-10B4-24-8 Cells(提供STR鉴定图谱)
MDA-EJ-1 Cells(提供STR鉴定图谱)
" "PubMed=6091813; DOI=10.1182/blood.V64.5.1059.1059
Palumbo A., Minowada J., Erikson J., Croce C.M., Rovera G.
Lineage infidelity of a human myelogenous leukemia cell line.
Blood 64:1059-1063(1984)
PubMed=6582512; DOI=10.1073/pnas.81.2.568; PMCID=PMC344720
Mattes M.J., Cordon-Cardo C., Lewis J.L. Jr., Old L.J., Lloyd K.O.
Cell surface antigens of human ovarian and endometrial carcinoma defined by mouse monoclonal antibodies.
Proc. Natl. Acad. Sci. U.S.A. 81:568-572(1984)
PubMed=2985879; DOI=10.1016/0145-2126(85)90084-0
Drexler H.G., Gaedicke G., Minowada J.
Isoenzyme studies in human leukemia-lymphoma cell lines -- 1 carboxylic esterase.
Leuk. Res. 9:209-229(1985)
PubMed=3159941; DOI=10.1016/0145-2126(85)90134-1
Drexler H.G., Gaedicke G., Minowada J.
Isoenzyme studies in human leukemia-lymphoma cell lines -- III Beta-hexosaminidase (E.C. 3.2.1.30).
Leuk. Res. 9:549-559(1985)
PubMed=3874327; DOI=10.1016/0145-2126(85)90133-x
Drexler H.G., Gaedicke G., Minowada J.
Isoenzyme studies in human leukemia-lymphoma cells lines -- II. Acid phosphatase.
Leuk. Res. 9:537-548(1985)
DOI=10.1159/000415060
Morikawa S., Harada T., Katoh T.
Heterogeneity of cellular origins in human malignant lymphoma cell line derived from histo-monocytic lineage cells.
(In book chapter) Cellular, molecular, genetic approaches to immunodiagnosis and immunotherapy. 8th International conference on labeled antibodies, Tokyo, November 1985; Kano K., Mori S., Sugisaki T., Torisu M. (eds.); pp.373-380; Karger; Basel; Switzerland (1988)
PubMed=2140233; DOI=10.1111/j.1440-1827.1990.tb01549.x
Nakano A., Harada T., Morikawa S., Kato Y.
Expression of leukocyte common antigen (CD45) on various human leukemia/lymphoma cell lines.
Acta Pathol. Jpn. 40:107-115(1990)
PubMed=2243057; DOI=10.1007/BF02624468
Kong Z.-L., Miwa M., Murakami H., Shinohara K.
Establishment of a macrophagelike cell line derived from U-937, human histiocytic lymphoma, grown serum-free.
In Vitro Cell. Dev. Biol. 26:949-954(1990)
DOI=10.1007/978-94-011-3550-4_20
Shinohara K., Kong Z.-L., Murakami H.
Characterization of a human derived macrophage-like cell line, U-M.
(In book chapter) Animal cell culture and production of biologicals; Sasaki R., Ikura K. (eds.); pp.181-186; Springer; Dordrecht; Netherlands (1991)
PubMed=1913629; DOI=10.1016/0304-3835(91)90051-I
Chang K.S.-S., Liu W.-T., Josephs S.F.
Regulation of cellular trans-activating activities in two different promonocytic leukemia cell lines.
Cancer Lett. 60:75-83(1991)
PubMed=1571549; DOI=10.1182/blood.V79.9.2378.2378
Sugimoto K., Toyoshima H., Sakai R., Miyagawa K., Hagiwara K., Ishikawa F., Takaku F., Yazaki Y., Hirai H.
Frequent mutations in the p53 gene in human myeloid leukemia cell lines.
Blood 79:2378-2383(1992)
PubMed=8300570; DOI=10.1016/S0021-9258(17)41964-8
Rubin E.H., Pantazis P., Bharti A., Toppmeyer D., Giovanella B.C., Kufe D.W.
Identification of a mutant human topoisomerase I with intact catalytic activity and resistance to 9-nitro-camptothecin.
J. Biol. Chem. 269:2433-2439(1994)
PubMed=7759961; DOI=10.1002/jlb.57.5.804
Reid Y.A., McGuire L., O'Neill K., Macy M.L., Chen T.-R., McClintock P.R., Dorotinsky C.S., Hay R.J.
Cell line cross-contamination of U-937.
J. Leukoc. Biol. 57:804-804(1995)
PubMed=8547074; DOI=10.1111/j.1365-2141.1995.tb05302.x
Siebert R., Willers C.P., Schramm A., Fossa A., Dresen I.M.G., Uppenkamp M.J., Nowrousian M.R., Seeber S., Opalka B.
Homozygous loss of the MTS1/p16 and MTS2/p15 genes in lymphoma and lymphoblastic leukaemia cell lines.
Br. J. Haematol. 91:350-354(1995)
PubMed=8558913
Morita S., Tsuchiya S., Fujie H., Itano M., Ohashi Y., Minegishi M., Imaizumi M., Endo M., Takano N., Konno T.
Cell surface c-kit receptors in human leukemia cell lines and pediatric leukemia: selective preservation of c-kit expression on megakaryoblastic cell lines during adaptation to in vitro culture.
Leukemia 10:102-105(1996)
PubMed=8558920
Dirks W.G., Zaborski M., Jager K., Challier C., Shiota M., Quentmeier H., Drexler H.G.
The (2;5)(p23;q35) translocation in cell lines derived from malignant lymphomas: absence of t(2;5) in Hodgkin-analogous cell lines.
Leukemia 10:142-149(1996)
PubMed=8643484; DOI=10.1073/pnas.93.10.4804; PMCID=PMC39360
Dreyling M.H., Martinez-Climent J.A., Zheng M., Mao J.-i., Rowley J.D., Bohlander S.K.
The t(10;11)(p13;q14) in the U937 cell line results in the fusion of the AF10 gene and CALM, encoding a new member of the AP-3 clathrin assembly protein family.
Proc. Natl. Acad. Sci. U.S.A. 93:4804-4809(1996)
PubMed=9371509
Saleem A., Ibrahim N., Patel M., Li X.-G., Gupta E., Mendoza J.T., Pantazis P., Rubin E.H.
Mechanisms of resistance in a human cell line exposed to sequential topoisomerase poisoning.
Cancer Res. 57:5100-5106(1997)
PubMed=9510473; DOI=10.1111/j.1349-7006.1998.tb00476.x; PMCID=PMC5921588
Hosoya N., Hangaishi A., Ogawa S., Miyagawa K., Mitani K., Yazaki Y., Hirai H.
Frameshift mutations of the hMSH6 gene in human leukemia cell lines.
Jpn. J. Cancer Res. 89:33-39(1998)
PubMed=9685479; DOI=10.1093/nar/26.16.3651; PMCID=PMC147775
Hultdin M., Gronlund E., Norrback K.-F., Eriksson-Lindstrom E., Just T., Roos G.
Telomere analysis by fluorescence in situ hybridization and flow cytometry.
Nucleic Acids Res. 26:3651-3656(1998)
PubMed=9738977; DOI=10.1111/j.1349-7006.1998.tb03275.x; PMCID=PMC5921886
Takizawa J., Suzuki R., Kuroda H., Utsunomiya A., Kagami Y., Joh T., Aizawa Y., Ueda R., Seto M.
Expression of the TCL1 gene at 14q32 in B-cell malignancies but not in adult T-cell leukemia.
Jpn. J. Cancer Res. 89:712-718(1998)
PubMed=10352142; DOI=10.1096/fasebj.13.9001.s23
Hatton J.P., Gaubert F., Lewis M.L., Darsel Y., Ohlmann P., Cazenave J.-P., Schmitt D.
The kinetics of translocation and cellular quantity of protein kinase C in human leukocytes are modified during spaceflight.
FASEB J. 13 Suppl. 1:S23-S33(1999)
PubMed=10676951; DOI=10.1038/35000501
Alizadeh A.A., Eisen M.B., Davis R.E., Ma C., Lossos I.S., Rosenwald A., Boldrick J.C., Sabet H., Tran T., Yu X., Powell J.I., Yang L.-M., Marti G.E., Moore T., Hudson J. Jr., Lu L.-S., Lewis D.B., Tibshirani R., Sherlock G., Chan W.-C., Greiner T.C., Weisenburger D.D., Armitage J.O., Warnke R.A., Levy R., Wilson W.H., Grever M.R., Byrd J.C., Botstein D., Brown P.O., Staudt L.M.
Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling.
Nature 403:503-511(2000)
PubMed=10739008; DOI=10.1016/S0145-2126(99)00182-4
Inoue K., Kohno T., Takakura S., Hayashi Y., Mizoguchi H., Yokota J.
Frequent microsatellite instability and BAX mutations in T cell acute lymphoblastic leukemia cell lines.
Leuk. Res. 24:255-262(2000)
PubMed=10966170; DOI=10.1034/j.1600-0609.2000.90181.x
Aggerholm A., Gronbaek K., Guldberg P., Hokland P.
Mutational analysis of the tumour suppressor gene MMAC1/PTEN in malignant myeloid disorders.
Eur. J. Haematol. 65:109-113(2000)
PubMed=11226526; DOI=10.1016/S0145-2126(00)00121-1
Inoue K., Kohno T., Takakura S., Hayashi Y., Mizoguchi H., Yokota J.
Corrigendum to: Frequent microsatellite instability and BAX mutations in T cell acute lymphoblastic leukemia cell lines Leukemia Research 24 (2000), 255-262.
Leuk. Res. 25:275-278(2001)
PubMed=11416159; DOI=10.1073/pnas.121616198; PMCID=PMC35459
Masters J.R.W., Thomson J.A., Daly-Burns B., Reid Y.A., Dirks W.G., Packer P., Toji L.H., Ohno T., Tanabe H., Arlett C.F., Kelland L.R., Harrison M., Virmani A.K., Ward T.H., Ayres K.L., Debenham P.G.
Short tandem repeat profiling provides an international reference standard for human cell lines.
Proc. Natl. Acad. Sci. U.S.A. 98:8012-8017(2001)
PubMed=11701946; DOI=10.1159/000048774
Strefford J.C., Foot N.J., Chaplin T., Neat M.J., Oliver R.T.D., Young B.D., Jones L.K.
The characterisation of the lymphoma cell line U937, using comparative genomic hybridisation and multi-plex FISH.
Cytogenet. Cell Genet. 94:9-14(2001)
PubMed=12393283; DOI=10.1016/S0165-4608(02)00565-4
Lee J.-Y., Lee C.-H., Shim S.H., Seo H.-K., Kyhm J.-H., Cho S., Cho Y.-H.
Molecular cytogenetic analysis of the monoblastic cell line U937 karyotype clarification by G-banding, whole chromosome painting, microdissection and reverse painting, and comparative genomic hybridization.
Cancer Genet. Cytogenet. 137:124-132(2002)
PubMed=15637111; DOI=10.1096/fj.04-3062fje
Parson W., Kirchebner R., Muhlmann R., Renner K., Kofler A., Schmidt S., Kofler R.
Cancer cell line identification by short tandem repeat profiling: power and limitations.
FASEB J. 19:434-436(2005)
PubMed=15843827; DOI=10.1038/sj.leu.2403749
Andersson A., Eden P., Lindgren D., Nilsson J., Lassen C., Heldrup J., Fontes M., Borg A., Mitelman F., Johansson B., Hoglund M., Fioretos T.
Gene expression profiling of leukemic cell lines reveals conserved molecular signatures among subtypes with specific genetic aberrations.
Leukemia 19:1042-1050(2005)
PubMed=16311011; DOI=10.1016/j.tiv.2005.10.012
Ashikaga T., Yoshida Y., Hirota M., Yoneyama K., Itagaki H., Sakaguchi H., Miyazawa M., Ito Y., Suzuki H., Toyoda H.
Development of an in vitro skin sensitization test using human cell lines: the human Cell Line Activation Test (h-CLAT). I. Optimization of the h-CLAT protocol.
Toxicol. In Vitro 20:767-773(2006)
PubMed=16337770; DOI=10.1016/j.tiv.2005.10.014
Sakaguchi H., Ashikaga T., Miyazawa M., Yoshida Y., Ito Y., Yoneyama K., Hirota M., Itagaki H., Toyoda H., Suzuki H.
Development of an in vitro skin sensitization test using human cell lines; human Cell Line Activation Test (h-CLAT). II. An inter-laboratory study of the h-CLAT.
Toxicol. In Vitro 20:774-784(2006)
PubMed=16408098; DOI=10.1038/sj.leu.2404081
Quentmeier H., MacLeod R.A.F., Zaborski M., Drexler H.G.
JAK2 V617F tyrosine kinase mutation in cell lines derived from myeloproliferative disorders.
Leukemia 20:471-476(2006)
PubMed=20801507; DOI=10.1016/j.leukres.2010.07.040
Minafra L., Di Cara G., Albanese N.N., Cancemi P.
Proteomic differentiation pattern in the U937 cell line.
Leuk. Res. 35:226-236(2011)
PubMed=21269460; DOI=10.1186/1752-0509-5-17; PMCID=PMC3039570
Burkard T.R., Planyavsky M., Kaupe I., Breitwieser F.P., Burckstummer T., Bennett K.L., Superti-Furga G., Colinge J.
Initial characterization of the human central proteome.
BMC Syst. Biol. 5:17.1-17.13(2011)
PubMed=22460905; DOI=10.1038/nature11003; PMCID=PMC3320027
Barretina J.G., Caponigro G., Stransky N., Venkatesan K., Margolin A.A., Kim S., Wilson C.J., Lehar J., Kryukov G.V., Sonkin D., Reddy A., Liu M., Murray L., Berger M.F., Monahan J.E., Morais P., Meltzer J., Korejwa A., Jane-Valbuena J., Mapa F.A., Thibault J., Bric-Furlong E., Raman P., Shipway A., Engels I.H., Cheng J., Yu G.-Y.K., Yu J.-J., Aspesi P. Jr., de Silva M., Jagtap K., Jones M.D., Wang L., Hatton C., Palescandolo E., Gupta S., Mahan S., Sougnez C., Onofrio R.C., Liefeld T., MacConaill L.E., Winckler W., Reich M., Li N.-X., Mesirov J.P., Gabriel S.B., Getz G., Ardlie K., Chan V., Myer V.E., Weber B.L., Porter J., Warmuth M., Finan P., Harris J.L., Meyerson M.L., Golub T.R., Morrissey M.P., Sellers W.R., Schlegel R., Garraway L.A.
The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity.
Nature 483:603-607(2012)
DOI=10.1016/j.actaastro.2013.06.007
Paulsen K., Tauber S., Golz N., Simmet D.M., Engeli S., Birlem M., Dumrese C., Karer A., Hunziker S., Biskup J., Konopasek S., Suh D., Breuer-Hurlimann E., Signer C., Wang A., Sang C., Grote K.-H., Zhuang F.-Y., Ullrich O.
Severe disruption of the cytoskeleton and immunologically relevant surface molecules in a human macrophageal cell line in microgravity -- results of an in vitro experiment on board of the Shenzhou-8 space mission.
Acta Astronaut. 94:277-292(2013)
PubMed=25485619; DOI=10.1038/nbt.3080
Klijn C., Durinck S., Stawiski E.W., Haverty P.M., Jiang Z.-S., Liu H.-B., Degenhardt J., Mayba O., Gnad F., Liu J.-F., Pau G., Reeder J., Cao Y., Mukhyala K., Selvaraj S.K., Yu M.-M., Zynda G.J., Brauer M.J., Wu T.D., Gentleman R.C., Manning G., Yauch R.L., Bourgon R., Stokoe D., Modrusan Z., Neve R.M., de Sauvage F.J., Settleman J., Seshagiri S., Zhang Z.-M.
A comprehensive transcriptional portrait of human cancer cell lines.
Nat. Biotechnol. 33:306-312(2015)
PubMed=25877200; DOI=10.1038/nature14397
Yu M., Selvaraj S.K., Liang-Chu M.M.Y., Aghajani S., Busse M., Yuan J., Lee G., Peale F.V., Klijn C., Bourgon R., Kaminker J.S., Neve R.M.
A resource for cell line authentication, annotation and quality control.
Nature 520:307-311(2015)
PubMed=26589293; DOI=10.1186/s13073-015-0240-5; PMCID=PMC4653878
Scholtalbers J., Boegel S., Bukur T., Byl M., Goerges S., Sorn P., Loewer M., Sahin U., Castle J.C.
TCLP: an online cancer cell line catalogue integrating HLA type, predicted neo-epitopes, virus and gene expression.
Genome Med. 7:118.1-118.7(2015)
PubMed=29787063; DOI=10.1007/978-3-319-16104-4_14
Chanput W., Peters V., Wichers H.J.
THP-1 and U937 cells.
(In book chapter) The impact of food bioactives on health. In vitro and ex vivo models; Verhoeckx K., Cotter P., Lopez-Exposito I., Kleiveland C., Lea T., Mackie A., Requena T., Swiatecka D., Wichers H. (eds.); pp.147-159; Springer; Cham; Switzerland (2015)
PubMed=30285677; DOI=10.1186/s12885-018-4840-5; PMCID=PMC6167786
Tan K.-T., Ding L.-W., Sun Q.-Y., Lao Z.-T., Chien W., Ren X., Xiao J.-F., Loh X.-Y., Xu L., Lill M., Mayakonda A., Lin D.-C., Yang H.H., Koeffler H.P.
Profiling the B/T cell receptor repertoire of lymphocyte derived cell lines.
BMC Cancer 18:940.1-940.13(2018)
PubMed=30629668; DOI=10.1371/journal.pone.0210404; PMCID=PMC6328144
Uphoff C.C., Pommerenke C., Denkmann S.A., Drexler H.G.
Screening human cell lines for viral infections applying RNA-Seq data analysis.
PLoS ONE 14:E0210404-E0210404(2019)
PubMed=30894373; DOI=10.1158/0008-5472.CAN-18-2747; PMCID=PMC6445675
Dutil J., Chen Z.-H., Monteiro A.N.A., Teer J.K., Eschrich S.A.
An interactive resource to probe genetic diversity and estimated ancestry in cancer cell lines.
Cancer Res. 79:1263-1273(2019)
PubMed=31068700; DOI=10.1038/s41586-019-1186-3; PMCID=PMC6697103
Ghandi M., Huang F.W., Jane-Valbuena J., Kryukov G.V., Lo C.C., McDonald E.R. 3rd, Barretina J.G., Gelfand E.T., Bielski C.M., Li H.-X., Hu K., Andreev-Drakhlin A.Y., Kim J., Hess J.M., Haas B.J., Aguet F., Weir B.A., Rothberg M.V., Paolella B.R., Lawrence M.S., Akbani R., Lu Y.-L., Tiv H.L., Gokhale P.C., de Weck A., Mansour A.A., Oh C., Shih J., Hadi K., Rosen Y., Bistline J., Venkatesan K., Reddy A., Sonkin D., Liu M., Lehar J., Korn J.M., Porter D.A., Jones M.D., Golji J., Caponigro G., Taylor J.E., Dunning C.M., Creech A.L., Warren A.C., McFarland J.M., Zamanighomi M., Kauffmann A., Stransky N., Imielinski M., Maruvka Y.E., Cherniack A.D., Tsherniak A., Vazquez F., Jaffe J.D., Lane A.A., Weinstock D.M., Johannessen C.M., Morrissey M.P., Stegmeier F., Schlegel R., Hahn W.C., Getz G., Mills G.B., Boehm J.S., Golub T.R., Garraway L.A., Sellers W.R.
Next-generation characterization of the Cancer Cell Line Encyclopedia.
Nature 569:503-508(2019)
PubMed=31160637; DOI=10.1038/s41598-019-44491-x; PMCID=PMC6547646
Quentmeier H., Pommerenke C., Dirks W.G., Eberth S., Koeppel M., MacLeod R.A.F., Nagel S., Steube K.G., Uphoff C.C., Drexler H.G.
The LL-100 panel: 100 cell lines for blood cancer studies.
Sci. Rep. 9:8218-8218(2019)"