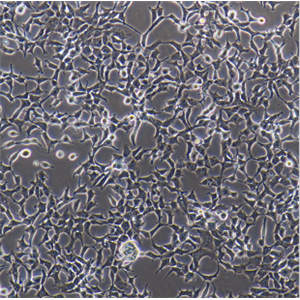
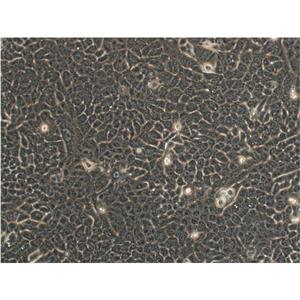
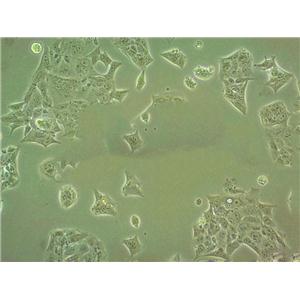
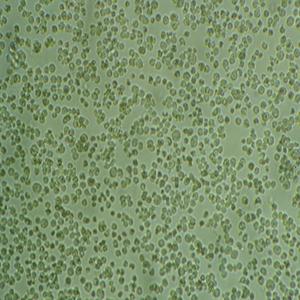
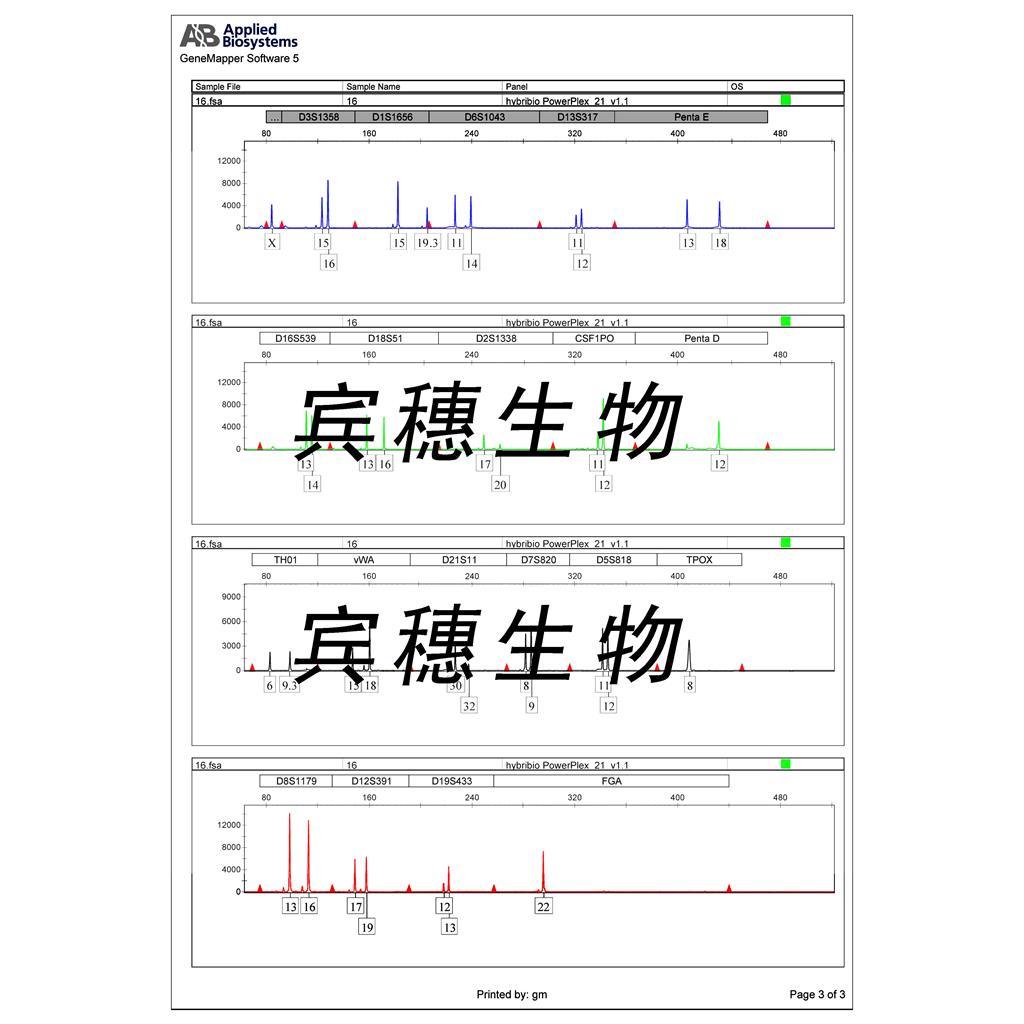
"FaDu人咽鳞癌细胞代次低|培养基|送STR图谱
传代比例:1:2-1:4(首次传代建议1:2)
生长特性:贴壁生长
【细胞培养经验分享】启蒙老师的重要性:一般进实验室都有师兄师姐带着做,他们就是你做细胞的启蒙老师。他们的操作手法、细节、理论讲解就成了你操作的准则,如营养液、细胞瓶的摆放位置、灭菌处理程序、开盖手法、细胞吹打手法等等。要学会他们的正确操作,在第一次的时候就要重视。像养孩子一样养细胞,细胞有时真的很脆弱,最好每天都去看看它,以防止出现培养箱缺水、缺二氧化碳、停电、温度不够等异常现象,也好及时解决这些意外,避免重复实验带来的更大痛苦。好细胞要及时保种:细胞要分批传代,这样即使有一批出了问题,还有一批备用的。像后者一般人可能不容易做到。但这是我血的教训,有一次细胞污染了,全军覆没。当时可后悔没有保种。细胞跟人一样,不同的细胞,培养特性是不一样的。培养过程中要细细体会,不同细胞系使用不同的培养基和血清。
换液周期:每周2-3次
SNU-368 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:AML12细胞、MS 751细胞、5-8F细胞
OB2 Cells;背景说明:详见相关文献介绍;传代方法:每周2-3次。;生长特性:悬浮生长;形态特性:淋巴母细胞;相关产品有:Lieming Xu-2细胞、OCI/AML4细胞、A2780细胞
PC-9/S1 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:SU86-86细胞、H-498细胞、D407细胞
FaDu人咽鳞癌细胞代次低|培养基|送STR图谱
背景信息:1968年从一位印度下咽骨肿瘤患者的钻孔活组织切片中建立了FaDu细胞株。在建立的细胞株中发现细胞质中含有成束的细丝,并且细胞分界上的桥粒特别突出。
┈订┈购(技术服务)┈热┈线:1┈3┈6┈4┈1┈9┈3┈0┈7┈9┈1【微信同号】┈Q┈Q:3┈1┈8┈0┈8┈0┈7┈3┈2┈4;
ATCC细胞库(American Type Culture Colection),该中心一直致力于细胞分类、鉴定和保藏工作。ATCC是全球最大的生物资源保藏中心,ATCC通过行业标准产品、服务和创新解决方案支持全球学术、政府、生物技术、制药、食品、农业和工业领域的科学进步。ATCC提供的服务和定制解决方案包括细胞和微生物培养、鉴定、生物衍生物的开发和生产、性能测试和生物资源保藏服务。美国国家标准协会(ANSI)认可了ATCC标准开发组织,并制定了标准协议,以确保生物材料的可靠性和可重复性。ATCC的使命是为了获取、鉴定、保存、开发、标准化和分发生物资源和生物信息,以提高和应用生物科学知识。
产品包装:复苏发货:T25培养瓶(一瓶)或冻存发货:1ml冻存管(两支)
来源说明:细胞主要来源ATCC、ECACC、DSMZ、RIKEN等细胞库
FaDu人咽鳞癌细胞代次低|培养基|送STR图谱
物种来源:人源、鼠源等其它物种来源
NB4 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:Hep G2细胞、H524细胞、COR-L105细胞
H-128 Cells;背景说明:小细胞肺癌;胸腔积液转移;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:NCI-H125细胞、UO-31细胞、H-9细胞
SiHa Cells;背景说明:该细胞来源于一位日本病人的手术切除的肿瘤组织。电镜下可以看到细胞间典型的桥粒和细胞质中大量的张力丝。1975年发现有支原体污染,而后被去除。该细胞整合有HPV16基因组,每个细胞中有1~2个拷贝。;传代方法:1:3传代,2-3天换液一次;生长特性:贴壁生长;形态特性:上皮样;相关产品有:SW 620细胞、HCT8细胞、A.704细胞
MADB-106 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:MNNG/HOS Clone F-5细胞、MUTZ-1细胞、Caov-3细胞
┈订┈购(技术服务)┈热┈线:1┈3┈6┈4┈1┈9┈3┈0┈7┈9┈1【微信同号】┈Q┈Q:3┈1┈8┈0┈8┈0┈7┈3┈2┈4;
形态特性:上皮细胞样
细胞株(系)的使用,为医学研究和测试工作带来了大的方便。但细胞的传代是有限制的,长期连续传代的细胞,不仅消耗大量的人力和物力,而且细胞的生长与形态等会有一定退变或转化,因而细胞失去原有的遗传性,有时还会由于细胞污染而造成传代中断,种子丢失。因此,在实际工作中常需冻存一定数量的细胞,以备替换使用。细胞冷冻与复苏是细胞培养 室的常规工作和通用技术。目前,细胞冻存Zui常用的技术是冷冻保存法,主要采用加适量保护剂的缓慢冷冻法冻存细胞。细胞在不加任何保护剂的情况下直接冷冻,细胞内外的水分会很快形成冰晶,从而引起一系列不良反应。如细胞脱水使局部电解质浓度增GAO,pH值改变,部分蛋白质由于上述原因而变性,引起细胞内部空间结构紊乱,溶酶体膜由此遭到损伤而释放出溶酶体酶,使细胞内结构成分造成破坏,线粒体肿胀,功能丢失,并造成能量代谢障碍。胞膜上的类脂蛋白复合体也易破坏引起细胞膜通透性的改变,使细胞内容物丢失。如果细胞内冰晶形成较多,随冷冻温度的降低,冰晶体积膨胀造成细胞核DNA空间构型发生不可逆的损伤,而致细胞死亡。因此,细胞冷冻技术的关键是尽可能地减少细胞内水分,减少细胞内冰晶的形成。采用甘油或二甲基亚砜作保护剂,这两种物质分子量小,溶解度大,易穿透细胞,可以使冰点下降,提GAO细胞膜对水的通透性,且对细胞无明显毒性。慢速冷冻方法又可使细胞内的水分渗出细胞外,减少胞内形成冰结晶的机会,从而减少冰晶对细胞的损伤。
SNU-387 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:H-1395细胞、NCIH1105细胞、UMNSAH/DF#1细胞
Toledo Cells;背景说明:详见相关文献介绍;传代方法:每2-3天换液;生长特性:悬浮生长 ;形态特性:淋巴母细胞样;相关产品有:G-361细胞、H-295细胞、KP4细胞
Hs839T Cells;背景说明:详见相关文献介绍;传代方法:1:2传代,2-3天换液1次。;生长特性:贴壁生长;形态特性:成纤维细胞;相关产品有:U-87MG ATCC细胞、PANC0203细胞、SK-Hep1细胞
TE 671 Cells;背景说明:胚胎性横纹肌肉瘤;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SCC15细胞、RT4细胞、SACCLM细胞
67NR Cells;背景说明:乳腺癌;BALB/cfC3H;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Hs839T细胞、H2195细胞、LLCMK2细胞
MDA-MB-453 Cells;背景说明:该细胞系由CailleauR在1976年从一名48岁的患有转移性乳腺癌的白人女性的心包渗出液中分离建立的。该细胞表达FGF的受体。;传代方法:1:2-1:4传代;2-3天换液1次;生长特性:贴壁生长;形态特性:上皮样;多角形;相关产品有:H-2444细胞、C57 Mouse Tumor 64细胞、HS-729细胞
OCI-AML-3 Cells;背景说明:急性髓系白血病;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:HS-294T细胞、MHCC-97细胞、UMUC3细胞
EVSAT Cells;背景说明:乳腺癌;腹水转移;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:MB49细胞、HCC0044细胞、PVEC细胞
C-33 A Cells;背景说明:C-33A细胞株是N. Auersperg从宫颈癌切片中建立的一系列细胞株(参见ATCC CRL-1594和ATCC CRL-1595)中的一株。 细胞一开始就表现出亚二倍体核型及上皮细胞形态。 连续传代可以观察到核型不稳定。 存在成视网膜细胞瘤蛋白(pRB),但大小不正常。 P53表达上调,且有一个273位密码子的点突变导致Arg -> Cys的替换。 人乳头瘤病毒DNA及RNA阴性。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:ST2细胞、KRC-Y细胞、VP 229细胞
A2780/Taxol Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:RT112细胞、OVMANA细胞、HSC/mHSC细胞
SW-780 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:U-251 MG细胞、Kasumi 1细胞、ID8细胞
HEK.EBNA Cells;背景说明:详见相关文献介绍;传代方法:1:4-1:10传代;每周2次。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:NCIH2196细胞、WM115F细胞、NCIH226细胞
H-2291 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:4传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:SuDHL 4细胞、BCaP-37细胞、HeLa/DDP细胞
Balb/3T3-4-Cl31 Cells;背景说明:胚胎;成纤维;自发永生;雄性;BALB/c;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:PL-5细胞、Tb1.Lu细胞、CHG5细胞
NCI-H1688 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:MOLT3细胞、P 3 HR 1细胞、CCD 1112SK细胞
PLCPRF5 Cells;背景说明:该细胞系分泌乙肝病毒表面抗原(HBsAg)。 此细胞系原先被支原体污染,后用BM-cycline去除支原体;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:SCL-II细胞、QBC939细胞、L929(NCTC)细胞
MV4-11 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:EBTr (NBL-4)细胞、AC16 [Human hybrid]细胞、SKLU01细胞
0138F-1 Cells(提供STR鉴定图谱)
Abcam HEK293T TAB1 KO Cells(提供STR鉴定图谱)
AG13014 Cells(提供STR鉴定图谱)
BayGenomics ES cell line RRC212 Cells(提供STR鉴定图谱)
BayGenomics ES cell line XE630 Cells(提供STR鉴定图谱)
BY00483 Cells(提供STR鉴定图谱)
CSL 224 Cells(提供STR鉴定图谱)
DMD-iPS (DYS-HAC)1 Cells(提供STR鉴定图谱)
GM03281 Cells(提供STR鉴定图谱)
SAOS 2 Cells;背景说明:该细胞是FoghJ和TrempeG分离和鉴定的众多人类肿瘤细胞系中的一种;该细胞来自一位11岁的白人女性的骨肉瘤组织。患者经过放疗以及甲喋呤、阿霉素、长春新碱、环磷酰胺和aramycin-C等多种药物治疗。该细胞在免疫抑制小鼠中不致瘤,细胞表达表皮生长因子EGF受体、转化生长因子β(1型和2型)受体。;传代方法:1:2-1:4传代;每周1-2次。;生长特性:贴壁生长;形态特性:上皮样;多角形;相关产品有:EO771细胞、SU.86细胞、Toledo细胞
FaDu人咽鳞癌细胞代次低|培养基|送STR图谱
CL 1-0 Cells;背景说明:肺癌;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:HFT-8810细胞、U373-MG细胞、NCI-H292细胞
TALL-104 Cells;背景说明:急性T淋巴细胞白血病;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:Mino细胞、LTEP-sm 1细胞、HEK-293-EBNA细胞
HGC-27 Cells;背景说明:未分化胃癌,能分泌粘液素。;传代方法:消化3-5分钟,1:2,3天内可长满;生长特性:贴壁生长;形态特性:上皮样;相关产品有:FLS细胞、H510细胞、Roswell Park Memorial Institute 7951细胞
COLO 320 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:淋巴母细胞;相关产品有:THLE-2细胞、UM-UC-3细胞、NCI-H1876细胞
Renal Carcinoma Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:LNCaP subline C4-2细胞、H9c2细胞、Hs 888.T细胞
5F7 [Mouse hybridoma against influenza A virus HA] Cells(提供STR鉴定图谱)
GL-261 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:上皮细胞样;相关产品有:Hs-746T细胞、NCI-H1623细胞、CCLP-1细胞
SK N SH Cells;背景说明:SK-N-SH细胞系由J.L.Bieder建系,它与SK-N-MC所不同的是倍增时间较长且多巴胺-β-羟基酶水平较高。 SK-N-SH在细胞介导的细胞毒性试验中用作靶细胞系。;传代方法:1:2传代;生长特性:悬浮生长;形态特性:上皮细胞样;相关产品有:MDCC MSB1细胞、Hopkins-92细胞、H-1341细胞
NL20 Cells;背景说明:支气管上皮细胞;SV40转化;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:RIN m5F细胞、MLFC细胞、LTEP-sm 1细胞
NCTC-3960 Cells;背景说明:黑色素瘤;雄性;DBA;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:JVM-2细胞、HuT102细胞、TPC-1细胞
SKNEP-1 Cells;背景说明:超微结构有少许微绒毛,连接复合物,形态完整的高尔基体,内质网多为光滑型,脂滴,没有病毒棵粒。;传代方法:1:2传代。3天内可长满。;生长特性:半贴壁生长;形态特性:上皮细胞;相关产品有:HuLEC-5a细胞、KM-12细胞、786-O细胞
NOMO-1 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:786-O细胞、CII细胞、HEK293T/17细胞
NOMO-1 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:786-O细胞、CII细胞、HEK293T/17细胞
WEHI 164 TC Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:Hs683T细胞、OVCA 432细胞、MARC 145细胞
H460-16-2 Cells(提供STR鉴定图谱)
HAP1 RABGAP1 (-) 2 Cells(提供STR鉴定图谱)
BJAB-1 Cells;背景说明:Burkitt's淋巴瘤;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:SF767细胞、SkMel31细胞、Hs739T细胞
CCRFCEM Cells;背景说明:G.E. Foley 等人建立了类淋巴母细胞细胞株CCRF-CEM。 细胞是1964年11月从一位四岁白人女性急性淋巴细胞白血病患者的外周血白血球衣中得到。此细胞系从香港收集而来。;传代方法:1:2传代。3天内可长满。;生长特性:悬浮生长;形态特性:淋巴母细胞样;相关产品有:MM-1S细胞、SR786细胞、HTori:3细胞
H1563 Cells;背景说明:详见相关文献介绍;传代方法:1:3-1:4传代;每周换液2次。;生长特性:贴壁生长;形态特性:详见产品说明书;相关产品有:GM00346细胞、T98细胞、MT2细胞
JJN3 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:DrG细胞、SK-RC 39细胞、MiaPaca.2细胞
CAMA-1 Cells;背景说明:详见相关文献介绍;传代方法:1:3—1:4传代;每周换液2-3次。;生长特性:贴壁生长;形态特性:上皮细胞贴壁斑块;紧凑,很少汇合;相关产品有:Human Microglia Clone 3细胞、PC3M-IE8细胞、WERI细胞
Fu97 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:KRC/Y细胞、T 84细胞、LN 229细胞
LAD2 Cells;背景说明:肥大 Cells;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:IPEC-1细胞、RGB细胞、WERIRb1细胞
Sarcoma OSteogenic-2 Cells;背景说明:该细胞是FoghJ和TrempeG分离和鉴定的众多人类肿瘤细胞系中的一种;该细胞来自一位11岁的白人女性的骨肉瘤组织。患者经过放疗以及甲喋呤、阿霉素、长春新碱、环磷酰胺和aramycin-C等多种药物治疗。该细胞在免疫抑制小鼠中不致瘤,细胞表达表皮生长因子EGF受体、转化生长因子β(1型和2型)受体。;传代方法:1:2-1:4传代;每周1-2次。;生长特性:贴壁生长;形态特性:上皮样;多角形;相关产品有:8305C_1细胞、MZ-CRC-1细胞、MC116细胞
HuH7-SLCO2A1-KO-c2 Cells(提供STR鉴定图谱)
L6.C10 Cells(提供STR鉴定图谱)
MTH53a Cells(提供STR鉴定图谱)
OnH Cells(提供STR鉴定图谱)
Royan H9 Cells(提供STR鉴定图谱)
TR-BBB5 Cells(提供STR鉴定图谱)
UiPSC-042 Cells(提供STR鉴定图谱)
HG02382 Cells(提供STR鉴定图谱)
A-875 Cells;背景说明:NGF受体阳性。;传代方法:1:3传代;3-4天1次。;生长特性:贴壁生长;形态特性:多角形;相关产品有:OVCA-433细胞、Helacyton gartleri细胞、MIA Paca2细胞
C2BBe 1 Cells;背景说明:详见相关文献介绍;传代方法:1:6—1:10传代,每周换液2次;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:KYSE-510细胞、Hepa-RG细胞、130T细胞
LN 382 Cells;背景说明:胶质瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SK-N-FI细胞、T98G细胞、HuNS1细胞
PaTu-8988s Cells;背景说明:胰腺癌;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:8305-C细胞、EBC-1/original细胞、SCC154细胞
TE-9 Cells;背景说明:详见相关文献介绍;传代方法:消化3-5分钟。1:2。3天内可长满。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:DMS-79细胞、MCF/Adr细胞、ECC10细胞
TE-9 Cells;背景说明:详见相关文献介绍;传代方法:消化3-5分钟。1:2。3天内可长满。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:DMS-79细胞、MCF/Adr细胞、ECC10细胞
AM38 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:RPMI8226/S细胞、VMRCLCD细胞、Co 205细胞
KHYG1 Cells;背景说明:NK细胞淋巴瘤/白血病;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:no-11细胞、Michigan Cancer Foundation-12A细胞、P30OHK细胞
Tb 1 Lu Cells;背景说明:肺;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:MCF.10A细胞、BEL 7402细胞、NHRF细胞
HEC151 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:Monomac-1细胞、LN-382细胞、253J细胞
TE-8 Cells;背景说明:详见相关文献介绍;传代方法:消化3-5分钟。1:2。3天内可长满。;生长特性:贴壁生长;形态特性:上皮样;相关产品有:Wien-133细胞、Daudi细胞、Wien 133细胞
TE-85 clone 5 Cells;背景说明:骨肉瘤;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:TE6细胞、MRC-5细胞、FT-293细胞
COLO684 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:悬浮生长;形态特性:详见产品说明书;相关产品有:GP5d细胞、MDA134细胞、SNUC1细胞
MuM-2C Cells;背景说明:脉络膜;黑色素瘤;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:Hs688(A)T细胞、Calu6细胞、OV2008细胞
SK RC 20 Cells;背景说明:肾癌;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:OV1-P细胞、3T3-J2细胞、P3X63Ag8细胞
T3 2Cr NKX2.1 Pt 3 Cells(提供STR鉴定图谱)
H-1395 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;5-6天传代一次。;生长特性:贴壁生长;形态特性:上皮样;多角形;相关产品有:A549-Taxol细胞、NCI-322细胞、UO-31细胞
Colon 38 Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:SKMEL-31细胞、Ls-174-T细胞、SkMel31细胞
LN 382 Cells;背景说明:胶质瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:SK-N-FI细胞、T98G细胞、HuNS1细胞
SNU-601 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:NT2/D1细胞、PANC-03-27细胞、DSL-6A-C1细胞
MX-1 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:HFE-145细胞、Stanford University-Diffuse Histiocytic Lymphoma-8细胞、N-2a细胞
NCIH2126 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:4传代,每周2-3次。;生长特性:贴壁生长;形态特性:上皮细胞样;相关产品有:GM05862细胞、H1954细胞、HS-766T细胞
FaDu人咽鳞癌细胞代次低|培养基|送STR图谱
HeLa S3 Cells;背景说明:该细胞是1955年由PuckTT,MarcusPI和CieciuraSJ建系的,含HPV-18序列;角蛋白阳性;可用于与染色体突变、细胞营养、集落形成相关的哺乳动物细胞的克隆分析。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:NCI-H82细胞、H676B细胞、Mink细胞
alphaTC1 Clone 6 Cells;背景说明:胰岛素瘤;a细胞;C57BL/6xDBA/2;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:CCRF.CEM细胞、HBE135-E6E7细胞、ZR-75-1细胞
Hs 766T Cells;背景说明:详见相关文献介绍;传代方法:1:2—1:8传代,每周换液2—3次;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:HRVEC细胞、MDA MB 436细胞、WM-266-4细胞
Karpas-299 Cells;背景说明:间变性大细胞淋巴瘤;男性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:悬浮;形态特性:详见产品说明书;相关产品有:HCM细胞、COLO 320细胞、C22 (Clara)细胞
COLO-738 Cells;背景说明:详见相关文献介绍;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁或悬浮,详见产品说明书部分;形态特性:详见产品说明书;相关产品有:Roswell Park Memorial Institute 1846细胞、SCL-1细胞、NCIADR.RES细胞
SNU251 Cells;背景说明:卵巢内膜癌;腹水转移;女性;传代方法:1:2-1:3传代;每周换液2-3次。;生长特性:贴壁;形态特性:详见产品说明书;相关产品有:LS 513细胞、LNCaP-ATCC细胞、SN12-PM6细胞
AM Cells;背景说明:详见相关文献介绍;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮细胞;相关产品有:MDA-436细胞、SCL-I细胞、Centre Antoine Lacassagne-33细胞
SKMES1 Cells;背景说明:源于一位65岁患有肺鳞状细胞癌的白人男性,自转移性胸腔积液分离而来。;传代方法:1:2传代;生长特性:贴壁生长;形态特性:上皮样;相关产品有:KU-812-F细胞、KP4细胞、Hs819T细胞
BayGenomics ES cell line RRJ226 Cells(提供STR鉴定图谱)
BayGenomics ES cell line XK182 Cells(提供STR鉴定图谱)
FM3A H-5 Cells(提供STR鉴定图谱)
NMu2Li Cells(提供STR鉴定图谱)
WEHI-231 Cells(提供STR鉴定图谱)
MCF10A-ERBB2m-1 Cells(提供STR鉴定图谱)
" "PubMed=6935474; DOI=10.1093/jnci/66.2.239
Wright W.C., Daniels W.P., Fogh J.
Distinction of seventy-one cultured human tumor cell lines by polymorphic enzyme analysis.
J. Natl. Cancer Inst. 66:239-247(1981)
PubMed=7459858
Rousset M., Zweibaum A., Fogh J.
Presence of glycogen and growth-related variations in 58 cultured human tumor cell lines of various tissue origins.
Cancer Res. 41:1165-1170(1981)
PubMed=2990217; PMCID=PMC1888002
Yee C., Krishnan-Hewlett I., Baker C.C., Schlegel R., Howley P.M.
Presence and expression of human papillomavirus sequences in human cervical carcinoma cell lines.
Am. J. Pathol. 119:361-366(1985)
PubMed=3518877; DOI=10.3109/07357908609038260
Fogh J.
Human tumor lines for cancer research.
Cancer Invest. 4:157-184(1986)
PubMed=3138611; DOI=10.1177/019459988809800603
Wustrow T.P.U., Raffael A., Valet G.K.
Multiparametric flow cytometry of human squamous cell carcinoma lines from the head and neck.
Otolaryngol. Head Neck Surg. 98:552-557(1988)
PubMed=1394225
Somers K.D., Merrick M.A., Lopez M.E., Incognito L.S., Schechter G.L., Casey G.
Frequent p53 mutations in head and neck cancer.
Cancer Res. 52:5997-6000(1992)
DOI=10.1016/B978-0-12-333530-2.50007-1
Carey T.E.
Head and neck tumor cell lines.
(In book chapter) Atlas of human tumor cell lines; Hay R.J., Park J.-G., Gazdar A.F. (eds.); pp.79-120; Academic Press; New York; USA (1994)
PubMed=8552396
Patel A.M., Incognito L.S., Schechter G.L., Wasilenko W.J., Somers K.D.
Amplification and expression of EMS-1 (cortactin) in head and neck squamous cell carcinoma cell lines.
Oncogene 12:31-35(1996)
PubMed=9815580
Wu Y.-G., Palad A.J., Wasilenko W.J., Blackmore P.F., Pincus W.A., Schechter G.L., Spoonster J.R., Kohn E.C., Somers K.D.
Inhibition of head and neck squamous cell carcinoma growth and invasion by the calcium influx inhibitor carboxyamido-triazole.
Clin. Cancer Res. 3:1915-1921(1997)
PubMed=11799138; DOI=10.1177/002215540205000207
Eicheler W., Zips D., Dorfler A., Grenman R., Baumann M.
Splicing mutations in TP53 in human squamous cell carcinoma lines influence immunohistochemical detection.
J. Histochem. Cytochem. 50:197-204(2002)
PubMed=17848307; DOI=10.1016/j.ijrobp.2007.04.082
Yarbrough W.G., Whigham A., Brown B., Roach M., Slebos R.J.C.
Phosphoinositide kinase-3 status associated with presence or absence of human papillomavirus in head and neck squamous cell carcinomas.
Int. J. Radiat. Oncol. Biol. Phys. 69:S98-S101(2007)
PubMed=20164919; DOI=10.1038/nature08768; PMCID=PMC3145113
Bignell G.R., Greenman C.D., Davies H.R., Butler A.P., Edkins S., Andrews J.M., Buck G., Chen L., Beare D., Latimer C., Widaa S., Hinton J., Fahey C., Fu B.-Y., Swamy S., Dalgliesh G.L., Teh B.T., Deloukas P., Yang F.-T., Campbell P.J., Futreal P.A., Stratton M.R.
Signatures of mutation and selection in the cancer genome.
Nature 463:893-898(2010)
PubMed=20215515; DOI=10.1158/0008-5472.CAN-09-3458; PMCID=PMC2881662
Rothenberg S.M., Mohapatra G., Rivera M.N., Winokur D., Greninger P., Nitta M., Sadow P.M., Sooriyakumar G., Brannigan B.W., Ulman M.J., Perera R.M., Wang R., Tam A., Ma X.-J., Erlander M., Sgroi D.C., Rocco J.W., Lingen M.W., Cohen E.E.W., Louis D.N., Settleman J., Haber D.A.
A genome-wide screen for microdeletions reveals disruption of polarity complex genes in diverse human cancers.
Cancer Res. 70:2158-2164(2010)
PubMed=21833476; DOI=10.3892/or.2011.1418
Ma J.-K., Lu S.-M., Yu L., Tian J.-J., Li J.-F., Wang H.-B., Xu W.
FaDu cell characteristics induced by multidrug resistance.
Oncol. Rep. 26:1189-1195(2011)
PubMed=21868764; DOI=10.1158/1078-0432.CCR-11-0690; PMCID=PMC3229662
Zhao M., Sano D., Pickering C.R., Jasser S.A., Henderson Y.C., Clayman G.L., Sturgis E.M., Ow T.J., Lotan R., Carey T.E., Sacks P.G., Grandis J.R., Sidransky D., Heldin N.-E., Myers J.N.
Assembly and initial characterization of a panel of 85 genomically validated cell lines from diverse head and neck tumor sites.
Clin. Cancer Res. 17:7248-7264(2011)
PubMed=22460905; DOI=10.1038/nature11003; PMCID=PMC3320027
Barretina J.G., Caponigro G., Stransky N., Venkatesan K., Margolin A.A., Kim S., Wilson C.J., Lehar J., Kryukov G.V., Sonkin D., Reddy A., Liu M., Murray L., Berger M.F., Monahan J.E., Morais P., Meltzer J., Korejwa A., Jane-Valbuena J., Mapa F.A., Thibault J., Bric-Furlong E., Raman P., Shipway A., Engels I.H., Cheng J., Yu G.-Y.K., Yu J.-J., Aspesi P. Jr., de Silva M., Jagtap K., Jones M.D., Wang L., Hatton C., Palescandolo E., Gupta S., Mahan S., Sougnez C., Onofrio R.C., Liefeld T., MacConaill L.E., Winckler W., Reich M., Li N.-X., Mesirov J.P., Gabriel S.B., Getz G., Ardlie K., Chan V., Myer V.E., Weber B.L., Porter J., Warmuth M., Finan P., Harris J.L., Meyerson M.L., Golub T.R., Morrissey M.P., Sellers W.R., Schlegel R., Garraway L.A.
The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity.
Nature 483:603-607(2012)
PubMed=23613873; DOI=10.1371/journal.pone.0061555; PMCID=PMC3629194
Martens-de Kemp S.R., Dalm S.U., Wijnolts F.M.J., Brink A., Honeywell R.J., Peters G.J., Braakhuis B.J.M., Brakenhoff R.H.
DNA-bound platinum is the major determinant of cisplatin sensitivity in head and neck squamous carcinoma cells.
PLoS ONE 8:E61555-E61555(2013)
PubMed=25485619; DOI=10.1038/nbt.3080
Klijn C., Durinck S., Stawiski E.W., Haverty P.M., Jiang Z.-S., Liu H.-B., Degenhardt J., Mayba O., Gnad F., Liu J.-F., Pau G., Reeder J., Cao Y., Mukhyala K., Selvaraj S.K., Yu M.-M., Zynda G.J., Brauer M.J., Wu T.D., Gentleman R.C., Manning G., Yauch R.L., Bourgon R., Stokoe D., Modrusan Z., Neve R.M., de Sauvage F.J., Settleman J., Seshagiri S., Zhang Z.-M.
A comprehensive transcriptional portrait of human cancer cell lines.
Nat. Biotechnol. 33:306-312(2015)
PubMed=25877200; DOI=10.1038/nature14397
Yu M., Selvaraj S.K., Liang-Chu M.M.Y., Aghajani S., Busse M., Yuan J., Lee G., Peale F.V., Klijn C., Bourgon R., Kaminker J.S., Neve R.M.
A resource for cell line authentication, annotation and quality control.
Nature 520:307-311(2015)
PubMed=25888065; DOI=10.1016/j.molonc.2015.03.008; PMCID=PMC4523436
Stanam A., Love-Homan L., Joseph T.S., Espinosa-Cotton M., Simons A.L.
Upregulated interleukin-6 expression contributes to erlotinib resistance in head and neck squamous cell carcinoma.
Mol. Oncol. 9:1371-1383(2015)
PubMed=26122845; DOI=10.1158/0008-5472.CAN-15-0528
Stoepker C., Ameziane N., van der Lelij P., Kooi I.E., Oostra A.B., Rooimans M.A., van Mil S.E., Brink A., Dietrich R., Balk J.A., Ylstra B., Joenje H., Feller S.M., Brakenhoff R.H.
Defects in the Fanconi anemia pathway and chromatid cohesion in head and neck cancer.
Cancer Res. 75:3543-3553(2015)
PubMed=26589293; DOI=10.1186/s13073-015-0240-5; PMCID=PMC4653878
Scholtalbers J., Boegel S., Bukur T., Byl M., Goerges S., Sorn P., Loewer M., Sahin U., Castle J.C.
TCLP: an online cancer cell line catalogue integrating HLA type, predicted neo-epitopes, virus and gene expression.
Genome Med. 7:118.1-118.7(2015)
CLPUB00484
Xu Z.-H., Sun W.-W., Hang J.-B., Gao B.-L., Hu J.-A.
RNA-seq identified a novel functional MET fusion in head and neck cancer 5-8F cell line.
Int. J. Clin. Exp. Pathol. 9:8308-8317(2016)
PubMed=26754630; DOI=10.1186/s13046-016-0284-4; PMCID=PMC4709939
Hyakusoku H., Sano D., Takahashi H., Hatano T., Isono Y., Shimada S., Ito Y., Myers J.N., Oridate N.
JunB promotes cell invasion, migration and distant metastasis of head and neck squamous cell carcinoma.
J. Exp. Clin. Cancer Res. 35:6.1-6.12(2016)
PubMed=27397505; DOI=10.1016/j.cell.2016.06.017; PMCID=PMC4967469
Iorio F., Knijnenburg T.A., Vis D.J., Bignell G.R., Menden M.P., Schubert M., Aben N., Goncalves E., Barthorpe S., Lightfoot H., Cokelaer T., Greninger P., van Dyk E., Chang H., de Silva H., Heyn H., Deng X.-M., Egan R.K., Liu Q.-S., Miroo T., Mitropoulos X., Richardson L., Wang J.-H., Zhang T.-H., Moran S., Sayols S., Soleimani M., Tamborero D., Lopez-Bigas N., Ross-Macdonald P., Esteller M., Gray N.S., Haber D.A., Stratton M.R., Benes C.H., Wessels L.F.A., Saez-Rodriguez J., McDermott U., Garnett M.J.
A landscape of pharmacogenomic interactions in cancer.
Cell 166:740-754(2016)
PubMed=28196595; DOI=10.1016/j.ccell.2017.01.005; PMCID=PMC5501076
Li J., Zhao W., Akbani R., Liu W.-B., Ju Z.-L., Ling S.-Y., Vellano C.P., Roebuck P., Yu Q.-H., Eterovic A.K., Byers L.A., Davies M.A., Deng W.-L., Gopal Y.N.V., Chen G., von Euw E.M., Slamon D.J., Conklin D., Heymach J.V., Gazdar A.F., Minna J.D., Myers J.N., Lu Y.-L., Mills G.B., Liang H.
Characterization of human cancer cell lines by reverse-phase protein arrays.
Cancer Cell 31:225-239(2017)
PubMed=28476783; DOI=10.21873/anticanres.11555
Hagemann J., Jacobi C., Hahn M., Schmid V., Welz C., Schwenk-Zieger S., Stauber R.H., Baumeister P., Becker S.
Spheroid-based 3D cell cultures enable personalized therapy testing and drug discovery in head and neck cancer.
Anticancer Res. 37:2201-2210(2017)
PubMed=29156801; DOI=10.18632/oncotarget.21174; PMCID=PMC5689691
Kalu N.N., Mazumdar T., Peng S.-H., Shen L., Sambandam V., Rao X.-Y., Xi Y.-X., Li L.-R., Qi Y., Gleber-Netto F.O., Patel A., Wang J., Frederick M.J., Myers J.N., Pickering C.R., Johnson F.M.
Genomic characterization of human papillomavirus-positive and -negative human squamous cell cancer cell lines.
Oncotarget 8:86369-86383(2017)
PubMed=28844650; DOI=10.1016/j.anl.2017.07.011
Cho K.-J., Park E.-J., Kim M.-S., Joo Y.-H.
Characterization of FaDu-R, a radioresistant head and neck cancer cell line, and cancer stem cells.
Auris Nasus Larynx 45:566-573(2018)
PubMed=30135316; DOI=10.1172/jci.insight.122204; PMCID=PMC6141174
Jamieson S.M.F., Tsai P., Kondratyev M.K., Budhani P., Liu A., Senzer N.N., Chiorean E.G., Jalal S.I., Nemunaitis J.J., Kee D., Shome A., Wong W.W., Li D., Poonawala-Lohani N., Kakadia P.M., Knowlton N.S., Lynch C.R.H., Hong C.R., Lee T.W., Grenman R., Caporiccio L., McKee T.D., Zaidi M., Butt S., Macann A.M.J., McIvor N.P., Chaplin J.M., Hicks K.O., Bohlander S.K., Wouters B.G., Hart C.P., Print C.G., Wilson W.R., Curran M.A., Hunter F.W.
Evofosfamide for the treatment of human papillomavirus-negative head and neck squamous cell carcinoma.
JCI Insight 3:e122204.1-e122204.19(2018)
PubMed=30894373; DOI=10.1158/0008-5472.CAN-18-2747; PMCID=PMC6445675
Dutil J., Chen Z.-H., Monteiro A.N.A., Teer J.K., Eschrich S.A.
An interactive resource to probe genetic diversity and estimated ancestry in cancer cell lines.
Cancer Res. 79:1263-1273(2019)
PubMed=30971826; DOI=10.1038/s41586-019-1103-9
Behan F.M., Iorio F., Picco G., Goncalves E., Beaver C.M., Migliardi G., Santos R., Rao Y., Sassi F., Pinnelli M., Ansari R., Harper S., Jackson D.A., McRae R., Pooley R., Wilkinson P., van der Meer D.J., Dow D., Buser-Doepner C.A., Bertotti A., Trusolino L., Stronach E.A., Saez-Rodriguez J., Yusa K., Garnett M.J.
Prioritization of cancer therapeutic targets using CRISPR-Cas9 screens.
Nature 568:511-516(2019)
PubMed=31068700; DOI=10.1038/s41586-019-1186-3; PMCID=PMC6697103
Ghandi M., Huang F.W., Jane-Valbuena J., Kryukov G.V., Lo C.C., McDonald E.R. 3rd, Barretina J.G., Gelfand E.T., Bielski C.M., Li H.-X., Hu K., Andreev-Drakhlin A.Y., Kim J., Hess J.M., Haas B.J., Aguet F., Weir B.A., Rothberg M.V., Paolella B.R., Lawrence M.S., Akbani R., Lu Y.-L., Tiv H.L., Gokhale P.C., de Weck A., Mansour A.A., Oh C., Shih J., Hadi K., Rosen Y., Bistline J., Venkatesan K., Reddy A., Sonkin D., Liu M., Lehar J., Korn J.M., Porter D.A., Jones M.D., Golji J., Caponigro G., Taylor J.E., Dunning C.M., Creech A.L., Warren A.C., McFarland J.M., Zamanighomi M., Kauffmann A., Stransky N., Imielinski M., Maruvka Y.E., Cherniack A.D., Tsherniak A., Vazquez F., Jaffe J.D., Lane A.A., Weinstock D.M., Johannessen C.M., Morrissey M.P., Stegmeier F., Schlegel R., Hahn W.C., Getz G., Mills G.B., Boehm J.S., Golub T.R., Garraway L.A., Sellers W.R.
Next-generation characterization of the Cancer Cell Line Encyclopedia.
Nature 569:503-508(2019)
PubMed=31541927; DOI=10.1016/j.oraloncology.2019.09.004; PMCID=PMC7372097
van Harten A.M., Poell J.B., Buijze M., Brink A., Wells S.I., Leemans C.R., Wolthuis R.M.F., Brakenhoff R.H.
Characterization of a head and neck cancer-derived cell line panel confirms the distinct TP53-proficient copy number-silent subclass.
Oral Oncol. 98:53-61(2019)
PubMed=31978347; DOI=10.1016/j.cell.2019.12.023; PMCID=PMC7339254
Nusinow D.P., Szpyt J., Ghandi M., Rose C.M., McDonald E.R. 3rd, Kalocsay M., Jane-Valbuena J., Gelfand E.T., Schweppe D.K., Jedrychowski M.P., Golji J., Porter D.A., Rejtar T., Wang Y.K., Kryukov G.V., Stegmeier F., Erickson B.K., Garraway L.A., Sellers W.R., Gygi S.P.
Quantitative proteomics of the Cancer Cell Line Encyclopedia.
Cell 180:387-402.e16(2020)
PubMed=33802339; DOI=10.3390/cancers13051069; PMCID=PMC7959143
Gottgens E.-L., Ansems M., Leenders W.P.J., Bussink J., Span P.N.
Genotyping and characterization of HPV status, hypoxia, and radiosensitivity in 22 head and neck cancer cell lines.
Cancers (Basel) 13:1069.1-1069.12(2021)"