一、肿瘤坏死因子超家族概述
肿瘤坏死因子(TNF)超家族自1975年被首次报道以来,已成为一类包含19个配体及29个受体的重要细胞因子家族。该家族成员通过精密调控细胞增殖、分化、凋亡以及免疫应答等关键生物学过程,在多种生理及病理机制中发挥核心作用。
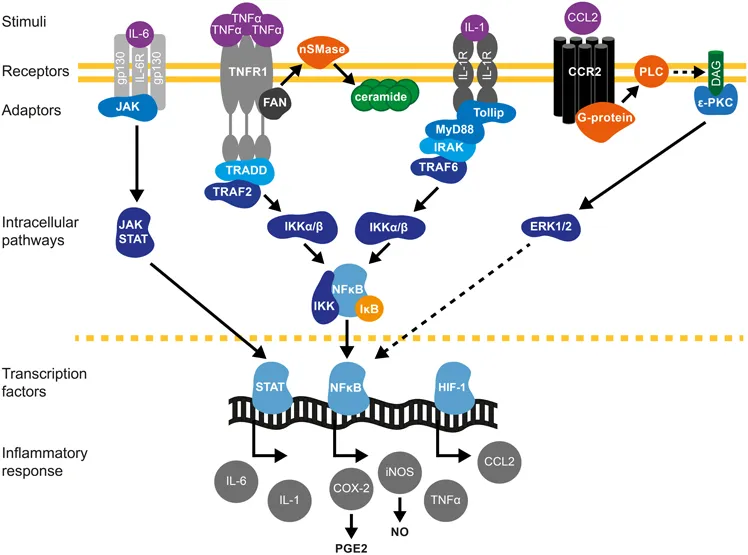
在分子结构特征上,该家族配体以特征性的三聚体形式与相应受体结合,激活包括核因子κB(NF-κB)、丝裂原活化蛋白激酶(MAPK)在内的多条重要信号通路,最终形成广泛而复杂的免疫调控网络。鉴于其在免疫稳态和病理过程中的关键调控作用,TNF超家族已成为肿瘤治疗、自身免疫性疾病干预以及感染性疾病防控等领域的重要分子靶点。
二、配体与受体结构特征
TNF超家族配体主要包括TNF-α、TNF-β(LTα)、FasL、TRAIL、CD40L及OX40L等类型。除LTα和VEGI为分泌型分子外,多数配体属于Ⅱ型跨膜蛋白。其胞外区通常包含约150个氨基酸组成的TNF同源结构域(THD),该结构域由10条β折叠链形成特征性的“春卷样”三明治构象,并以三聚体形式完成受体识别与结合。以TNF-α为例,其由三个含157个氨基酸的单体构成,借助第69位与第101位半胱氨酸形成的分子内二硫键以稳定空间构象;而TRAIL则通过特异性识别肿瘤细胞表面的DR4与DR5受体,激活选择性凋亡过程。
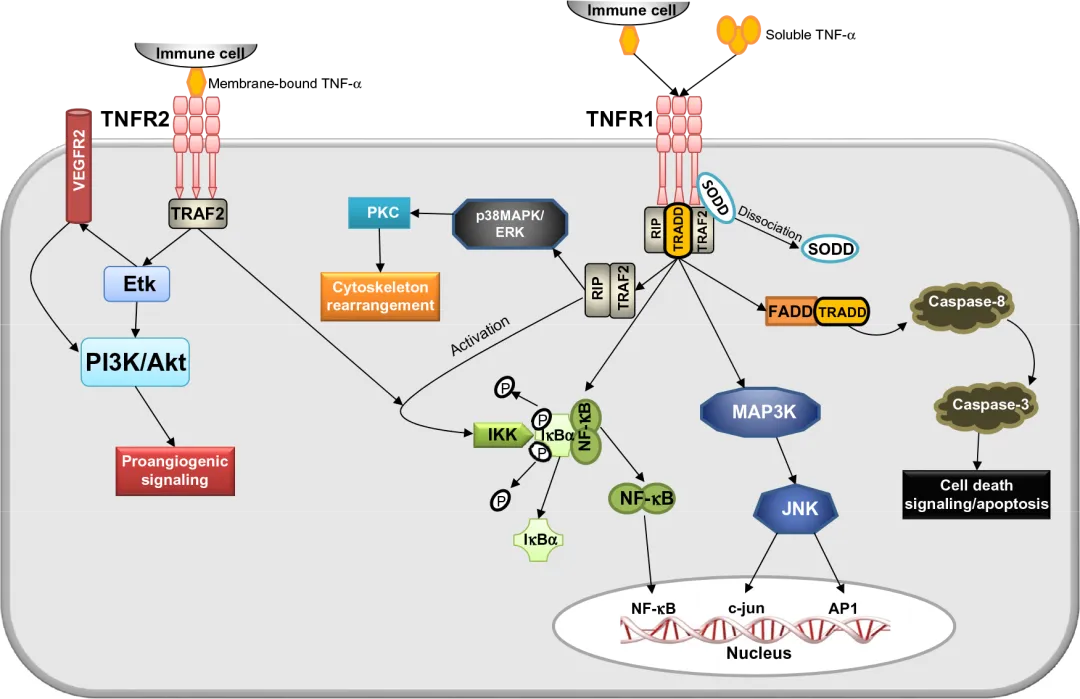
受体家族(TNFRSF)包含29种成员,如TNFR1、TNFR2、FAS、CD40等,大多属于Ⅰ型跨膜蛋白。其胞外域通常含有多个富含半胱氨酸的结构域(CRD),这些结构域在配体识别与特异性结合中起决定性作用。其中,TNFR1胞内区含有死亡结构域(DD),能够招募接头蛋白FADD/TRADD从而启动凋亡信号通路;TNFR2则主要通过结合TRAF2,激活NF-κB信号传导,参与炎症反应及免疫调节过程。
三、TNF-β/LTα的发现与生物学特征
淋巴毒素-α(Lymphotoxin-alpha,LTα),最初以其诱导肿瘤细胞坏死的功能被命名为肿瘤坏死因子-β(TNF-β),是TNF超家族中一类重要的分泌型细胞因子。与家族中多数膜结合型成员不同,LTα以其可溶性分泌特征,形成了独特的全身性和局部组织作用模式。
在分子结构层面,LTα以同源三聚体形式存在,其单体具有典型的TNF同源结构域(THD),包含约150个氨基酸,形成保守的β折叠“春卷样”三明治结构。三聚体界面主要通过疏水相互作用维持稳定,整体构象与TNF-α高度相似,但二者在受体结合特征与生物学功能上存在显著差异。
四、TNF-β/LTα受体系统与信号转导机制
LTα通过与不同受体结合形成多元信号系统,体现其功能多样性:
(一)主要受体系统
✔️LTβR受体复合体:LTα通常与LTβ形成异源三聚体LTα1β2,特异性结合淋巴毒素β受体(LTβR)
✔️TNFR1/2受体系统:同源三聚体LTα3可直接与TNFR1和TNFR2结合,但亲和力低于TNF-α
(二)信号转导通路
✔️经典NF-κB通路:LTβR激活后招募TRAF2/TRAF5适配蛋白,激活IKK复合体,介导IκBα磷酸化与降解,促进NF-κB p50/p65二聚体核转位及靶基因转录调控
✔️非经典NF-κB通路:通过NIK介导激活,调控p100向p52的加工处理过程
✔️MAPK信号通路:激活JNK、p38和ERK信号级联反应,参与细胞增殖、分化与凋亡的精密调控
✔️细胞死亡信号:在特定微环境条件下可诱导caspase依赖的凋亡通路
五、结论与展望
淋巴毒素-α作为TNF超家族的重要成员,在免疫系统发育、组织稳态维持及疾病发生发展过程中发挥着复杂而精细的调控作用。其独特的分泌型特征与特异性受体系统,使其在功能上既与TNF-α存在部分重叠,又具有自身特异的生物学特性。
未来研究应重点关注以下方向:
✔️深入解析LT信号在特定疾病背景下的精确作用机制
✔️开发具有组织选择性和信号通路选择性的靶向治疗策略
✔️建立基于LT系统功能状态的患者分层与疗效预测体系
✔️探索LT靶向治疗与其他治疗模式的协同效应及联合应用潜力
随着对LTα/LTβ系统生物学特性认识的不断深化,以及新型治疗手段的持续开发,这一重要的细胞因子家族有望为多种免疫相关疾病的精准治疗提供新策略,在个体化医疗时代展现出独特的临床应用价值。
六、TNF-β因子检测服务哪个公司有?
LabEx为您提供专业、特异的TNF-β因子检测服务。TNF-β(又称淋巴毒素-α, LT-α)是肿瘤坏死因子超家族的重要成员,主要由活化的淋巴细胞分泌,在淋巴器官发育、免疫细胞招募、炎症反应及抗肿瘤免疫中发挥关键调控作用。我们采用高灵敏度、高特异性的检测平台(如ELISA),能够对血清、血浆、细胞培养上清液及组织匀浆等多种样本中的TNF-β进行准确定量。

