
4YR企业会员
发布人:上海优宁维生物科技股份有限公司
发布日期:2025/2/26 13:09:51
蛋白质翻译后修饰是一个关键过程,它涉及在蛋白质的氨基酸残基上添加或移除特定的化学基团。这一修饰机制能够显著改变蛋白质的结构特征、稳定性以及生物活性,从而在细胞信号传导的调控、细胞功能的维持以及细胞间相互作用的调节中发挥着举足轻重的作用。此前,通过一系列公众号推文,已经深入探讨了磷酸化、泛素化和乙酰化等几种常见的蛋白质翻译后修饰类型。若读者对此感兴趣,可以通过以下链接进一步了解:“蛋白翻译后修饰——磷酸化(一)”、“蛋白翻译后修饰——磷酸化(二)”、“蛋白翻译后修饰——泛素化”、“蛋白翻译后修饰——泛素化(二)”、“蛋白翻译后修饰——乙酰化”。
蛋白质糖基化修饰:生物体内的重要翻译后调控机制
在真核生物中,多肽和蛋白质分子在核糖体合成后,往往需要经历翻译后修饰的步骤,才能有效发挥其生物学功能。其中,蛋白质糖基化作为一种广泛存在的翻译后修饰方式,扮演着至关重要的角色。这一过程是在糖基转移酶的催化下,通过糖苷键将糖链分子与蛋白质分子连接起来,生成糖蛋白。蛋白质糖基化不仅深度参与细胞间的相互作用、细胞外基质组织的构建以及细胞信号的传递等核心细胞活动,而且还能够调整蛋白质的结构、定位以及运输模式,进而影响其稳定性、生物学活性及整体功能,对生物体的生理机能产生深远的影响。
蛋白质糖基化修饰的多样类型
依据糖肽链结构的差异性,蛋白质糖基化修饰展现出丰富的类型,主要包括以下几类:N-糖基化、O-糖基化、通过糖基磷脂酰肌醇(GPI)锚定的修饰,以及其他多种形式的糖基化修饰。这些修饰手法各具特色,共同构成了蛋白质糖基化修饰的复杂网络。
N-糖基化
N-糖基化是一个特定的生物化学过程,其中糖基转移酶起着关键作用,它能够将聚糖链连接到蛋白质的特定部位——天冬酰胺(Asn)的氨基(-NH₂)上,从而生成糖蛋白。值得注意的是,并非蛋白质中的所有天冬酰胺残基都能参与这一过程,只有符合特定序列模式“Asn-X-Ser/Thr”的天冬酰胺残基才能发生N-糖基化。这里的“X”代表除脯氨酸(Pro)以外的任意氨基酸,而紧邻X的氨基酸残基则必须是丝氨酸(Ser)或苏氨酸(Thr)。这种特定的序列特征是N-糖基化发生的先决条件。

在N-糖基化过程中,除了要求特定的氨基酸序列外,聚糖的结构也展现出独特的特征。特别是在植物中,常见的参与N-糖基化的聚糖结构由3个葡萄糖分子(Glc)、9个甘露糖分子(Man)和2个N-乙酰氨基葡萄糖分子(GlcNAc)组成,这一结构被标记为Glc₃Man₉GlcNAc₂。
聚糖的合成主要在内质网中进行,这一过程可以细分为两个关键阶段。在第一阶段,内质网的基质内,两个GlcNAc首先被连接到多萜醇(Dolichol)载体上,随后五个Man与这些GlcNAc相连,形成中间产物Man₅-GlcNAc₂-Dolichol。进入第二阶段,这一反应转移至内质网的管腔内侧,其中四个Man和三个Glc被逐一添加到聚糖链上,最终生成成熟的聚糖结构Glc₃-Man₉-GlcNAc₂-Dolicol。随后,在内质网的管腔环境中,特定的酶——寡糖转移酶(OTase)负责将这一成熟的聚糖结构转移到蛋白质的天冬酰胺氨基上,从而完成N-糖基化过程,形成糖蛋白。
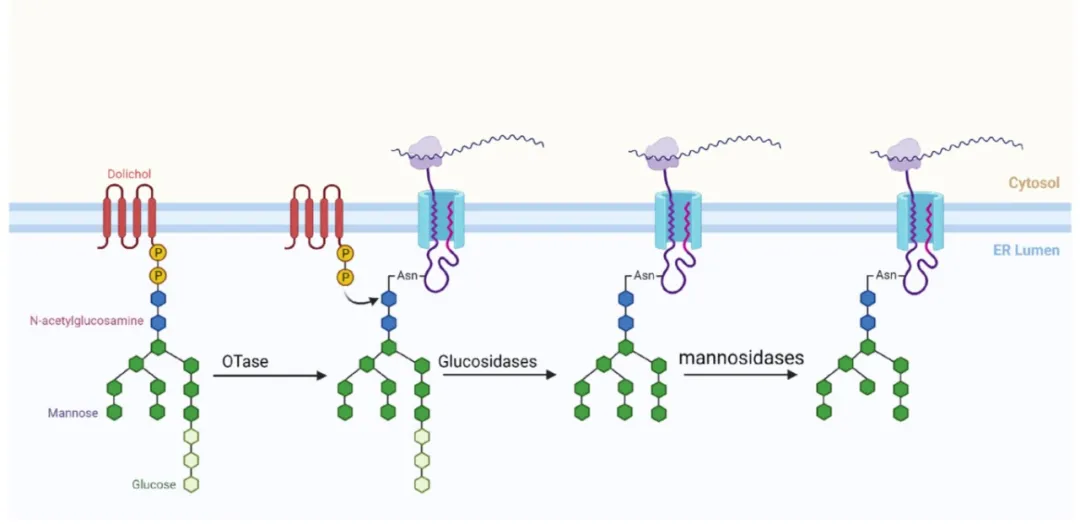
O-糖基化
O-糖基化是一个生物化学过程,通过糖基转移酶的催化作用,将糖链分子连接到蛋白质的丝氨酸、苏氨酸或赖氨酸的羟基(-OH)上,从而形成糖蛋白。依据与这些氨基酸残基相连的单糖残基种类的差异,O-糖基化修饰被进一步细分为黏蛋白型和非黏蛋白型两大类。在黏蛋白型O-糖基化中,N-乙酰半乳糖胺(GalNAc)是关键的连接单糖;而在非黏蛋白型中,则可能包括N-乙酰氨基葡萄糖(GlcNAc)、岩藻糖(Fuc)、甘露糖(Man)、葡萄糖(Glu)、木糖(Xyl)和半乳糖(Gal)等多种单糖类型(Mulagapati S等, 2017)。
与N-糖基化相比,O-糖基化在多个方面表现出显著的不同。首先,它并不依赖于特定的氨基酸序列模式;其次,其糖链分子也缺乏一个固定的核心寡糖结构。相反,O-糖基化中的聚糖种类和数量展现出高度的多样性。此外,由于目前缺乏一种能够普遍适用于从蛋白质中水解O-聚糖的酶,这使得O-糖基化的研究更加复杂。因此,O-糖基化被视为一个随机、多变且难以预测的过程,这进一步增加了其修饰的糖蛋白结构的复杂性。
GPI锚定:糖基磷脂酰肌醇介导的蛋白质锚定机制
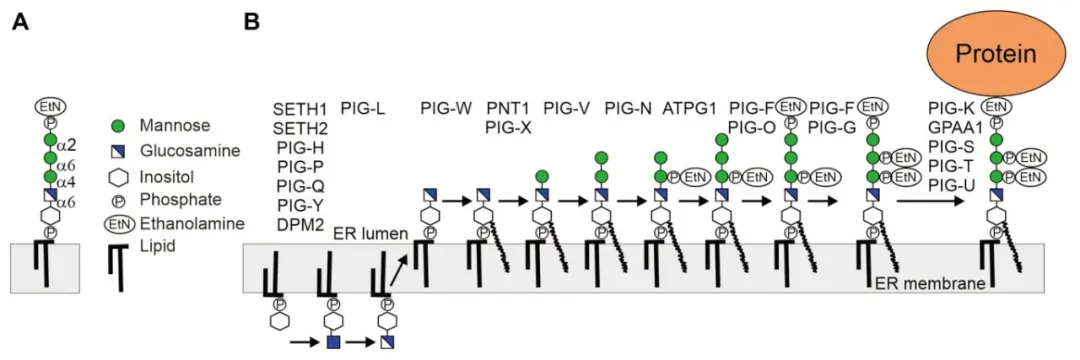
糖基磷脂酰肌醇(GPI)锚定是真核生物蛋白质翻译后修饰的一种普遍形式,它通过多糖链的桥梁作用,将乙醇胺磷酸与蛋白质的羧基末端相连,并利用肌醇上的甘油磷脂部分嵌入细胞膜的双分子层,从而将蛋白质牢牢地固定在细胞质膜上。GPI的结构相对固定,由乙醇胺磷酸(EtNP)、核心聚糖以及磷脂酰肌醇(PI)三大组件构成。其中,核心聚糖包含三个甘露糖(Man)分子和一个葡萄糖胺(GlcN)残基,而磷脂酰肌醇则可能呈现为1-烷基-2酰基磷脂酰肌醇、二酰基磷脂酰肌醇或肌醇磷酸神经酰胺等多种结构形式。这些组件通过特定的化学键连接,形成了一种以“EtNP-6Manα1-2Manα1-6Manα1-4GlcNα1-6myo-磷脂酰肌醇”为核心的GPI骨架。作为一种关键的糖基化修饰方式,GPI锚定在信号传导、膜蛋白的精确定位以及胞间连丝的物质运输等生物过程中发挥着不可或缺的作用。
其他蛋白质糖基化修饰类型
在植物界中,除了已知的三种蛋白质糖基化修饰方式外,还存在一种较为罕见的修饰类型——C-糖基化。这种修饰主要在黄酮碳苷的生物合成路径中展现其独特作用。具体来说,C-糖基化是在C-糖基转移酶的催化下,将糖基直接连接到黄酮苷的碳原子上的过程,或者先形成糖基与黄酮碳原子的连接,随后再由黄酮苷合成酶介入,促成黄酮苷的最终生成。这一过程是黄酮碳苷代谢途径中的一个关键环节。
上海优宁维生物科技股份有限公司
试剂 | 耗材 | 仪器 | 软件 | 定制 | 实验服务 | 供应链
免费热线:4008-168-068
咨询邮箱:info@univ-bio.com
订购商城:www.univ-bio.com
微信公众平台:优宁维抗体专家,欢迎关注!
小优博士(小程序):5大课堂, 让你的科研不再难!


相关新闻资讯