m6A
一、m6A 的神秘面纱
m6A 修饰即 N6 - 甲基腺苷修饰,是真核生物信使 RNA (mRNA) 的一种重要修饰方式。其化学结构中,一个甲基基团(-CH3)连接到 RNA 上的腺苷酸(A)上,形成 N6 - 甲基腺苷。其分子式为 C11H15N5O4,分子量为 281.27,具有一定的物理特性,如闪点为 49.3±17.7 °C,沸点为 162.9±23.0 °C at 760 mmHg,密度为 1.1±0.1 g/cm3 等。
m6A 标签通常位于 mRNA 的 3' 非翻译区(3'UTR),但也有研究表明在其他位置也可能存在。m6A 作为一种重要的调控元件,在细胞生物学过程中发挥着关键作用。它可以通过与多种蛋白质结合来实现不同的生物学功能。例如,与 poly (A) 结合蛋白(PABP)结合,促进 PABP 对 mRNA 的保护和稳定作用;与多种 RNA 结合蛋白(如 HuR、ELAVL1 等)结合,影响 mRNA 的翻译效率和细胞定位。
m6A 修饰是动态可逆的,可被多种酶识别和去除。其中,FTO、ALKBH5 等酶能介导 m6A 的去甲基化,从而影响其在细胞中的作用和稳定性。总的来说,m6A 修饰在真核生物中普遍存在,对于细胞的生物学过程和疾病的发生发展具有重要的影响。它不仅在基因表达调控、剪接、RNA 编辑等方面扮演重要角色,还在胚胎干细胞的自我更新和分化等生物过程中起作用。例如,N6 - 甲基腺苷是一种大型蛋白质复合物,由甲基转移酶样 3(METTL3)和甲基转移酶样 14(METTL14)催化亚基的一部分组成,在调节胚胎干细胞的自我更新和分化中发挥作用。
二、m6A 的研究进展
植物领域新突破:西北农林科技大学马闯教授团队在分子进化生物学知名期刊《Molecular Biology and Evolution》发表研究论文。该团队以小立碗藓、拟南芥、玉米、水稻、小麦等 13 种具有代表性植物物种为对象,构建了对应的 RNA m6A 修饰全转录组图谱。研究表明,m6A 修饰偏好性地保留在进化起源古老的直系同源基因中;相对于新产生的基因,早期进化起源的直系同源基因对之间的 m6A 差异更小;全基因组复制后的序列变异和局部基因组复制事件导致的基因家族扩张是引起同源基因间 m6A 修饰差异的重要因素;同源基因间 m6A 修饰的差异影响了基因组复制事件产生的重复基因的转录水平和翻译效率的变化。该研究为 RNA 甲基化修饰调控基因表达研究提供了新视角,也为后续进一步研究 m6A 修饰调控基因功能的进化机制提供了丰富的数据资源。
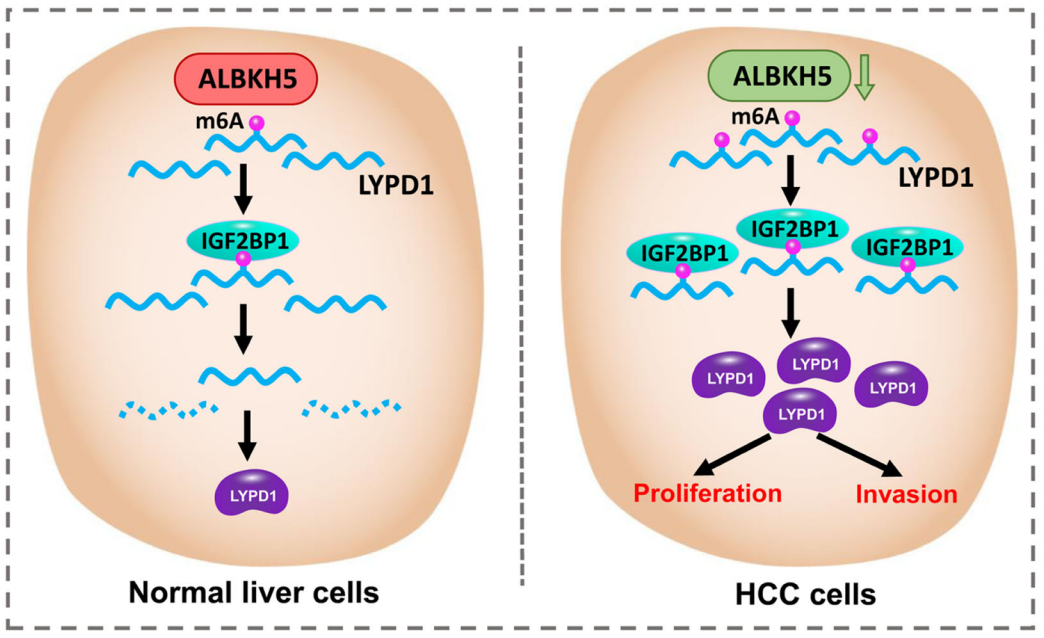
急性白血病新发现:齐鲁医院纪春岩教授团队在急性白血病 m6A 甲基化研究领域取得多项新进展。他们发现 m6A 甲基化 “阅读蛋白” IGF2BP2 在 T-ALL 中有促癌作用,筛选并功能鉴定出可特异性靶向 IGF2BP2 的小分子抑制剂,为 T-ALL 靶向治疗提供新思路。此外,研究还证实了 METTL3 可以通过调控 ITGA4 mRNA 的 m6A 甲基化调节 AML 细胞归巢,并最终介导化疗耐药的发生。全面揭示了 m6A 甲基化修饰系统在 AML 耐药中的作用新机制,有望为难治 / 复发 AML 的靶向联合治疗提供极具前景的治疗策略。
心脏功能障碍新研究:复旦大学葛均波等发现 m6A 去甲基酶 FTO 在心脏功能障碍中起着重要作用。研究表明,m6A 去甲基酶 FTO 通过调节葡萄糖摄取和糖酵解减轻小鼠心脏功能障碍。TAC 诱导的 HF 小鼠模型中,FTO 过表达降低了 TAC 诱导的高 m6A 甲基化,显著减轻心脏功能障碍、左心室肥厚和扩大症状,改善运动耐力;而 FTO 敲低则加剧心脏功能障碍和重塑、降低心脏能量供应。该研究为 HF 的预防和治疗提供了潜在目标。
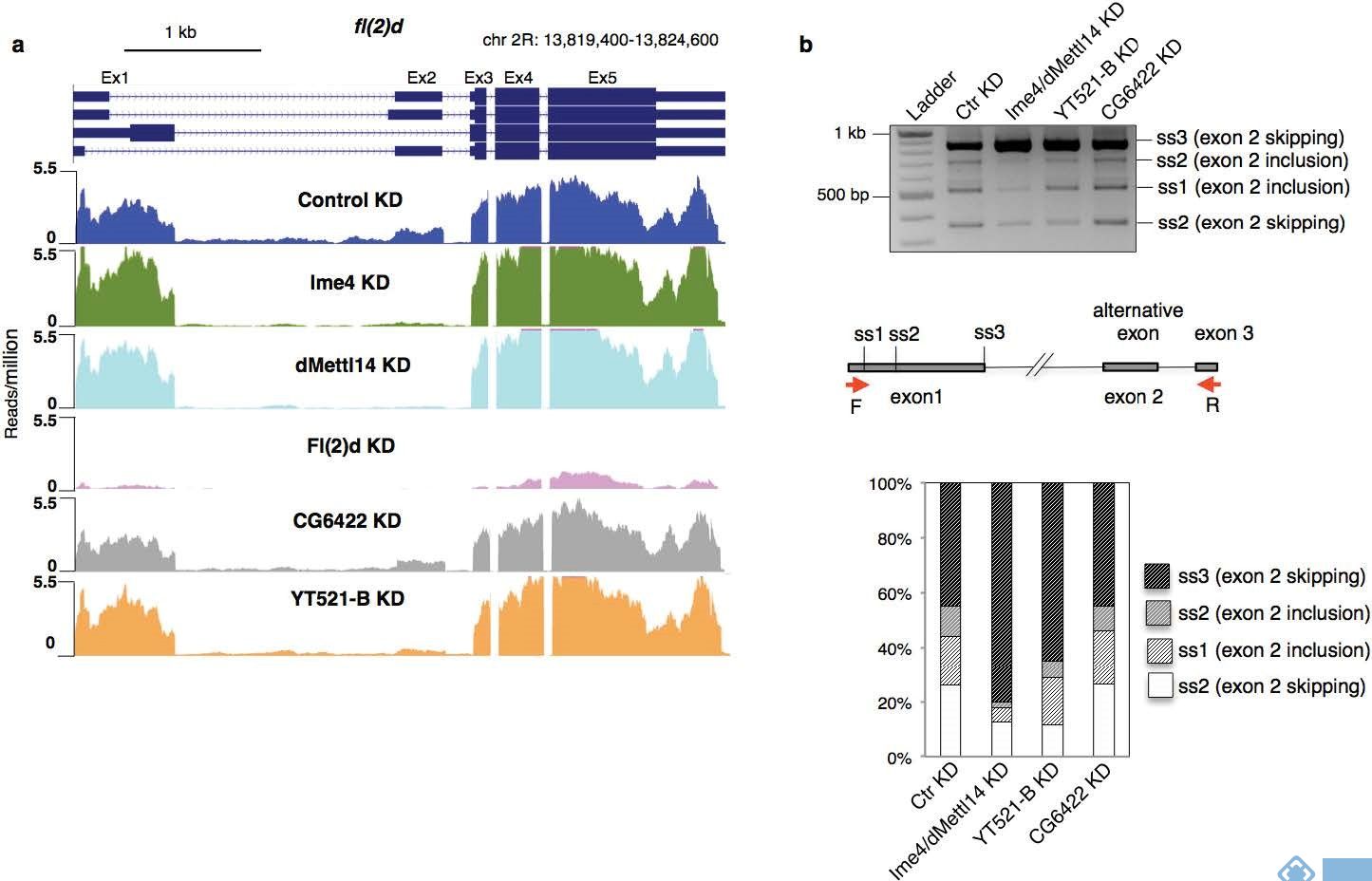
RNA 调控染色质新机制:中国科学院广州生物医药与健康研究院陈捷凯课题组发现了 RNA m6A 修饰调控异染色质形成的新机制。研究发现,RNA m6A 阅读器 YTHDC1 能够直接结合转座子元件转录出来的 RNA 上的 m6A 修饰,并招募 SETDB1 到相应的染色质位置,催化转座元件上的 H3K9me3 形成异染色质并使这些转座元件沉默。敲除 Ythdc1 会导致 Setdb1 依赖性的 H3K9me3 信号大幅下降,证明了 YTHDC1 是 SETDB1 介导逆转录转座子沉默的重要机制环节,也揭示了 RNA m6A 调控染色质的功能。
神经发育新成果:南方科技大学生物系姬生健课题组在 m6A 修饰调控神经发育方面取得多项成果。他们发现 m6A 修饰在调控神经元轴突导向、视网膜神经节细胞树突发育及功能等方面起着重要作用。例如,m6A 阅读器蛋白 YTHDF1 调控轴突导向通过翻译控制 Robo3.1 表达;m6A 阅读器蛋白 YTHDF2 调控视网膜神经节细胞树突发育及功能,并参与调控其神经退行性病变的过程。
染色质状态和转录活性新机制:同济大学生命科学与技术学院高亚威教授联合美国芝加哥大学教授何川、中科院北京基因组研究所研究员韩大力合作完成的研究成果揭示了 RNA 的 m6A 修饰调控染色质状态和转录活性的重要机制。研究发现,METTL3 缺陷的小鼠胚胎干细胞中,m6A 修饰显著影响了染色质上的 RNA,尤其是位于基因调控区域以及重复序列区域转录出的 RNA。这种依赖于 m6A 的 carRNA 降解机制对于细胞非常重要,敲除 METTL3 或 YTHDC1 后,carRNA 出现累积会直接影响相关区域以及下游基因的转录活性,从而引起基因组水平的转录活性增加、染色质开放程度增加。
自噬调控新成果:实验动物管理中心肖东课题组在 Nature Communications 发表了 m6A 阅读器 YTHDF3 调控自噬的新成果。研究首次揭示了 m6A 阅读器 YTHDF3 作为营养反应器调节自噬诱导的作用和机制。YTHDF3 通过识别 METTL3 介导的 m6A 高甲基化发挥营养反应器的作用诱导自噬,其识别 FOXO3 mRNA 终止密码周围的高 m6A 修饰,并募集 eIFs 以促进 FOXO3 翻译,进一步转录激活自噬相关基因表达,进而促进自噬。此研究揭示 RNA 甲基化修饰可作为潜在靶点,通过其调控自噬干预某些疾病的进展。
三、m6A 的作用与功能
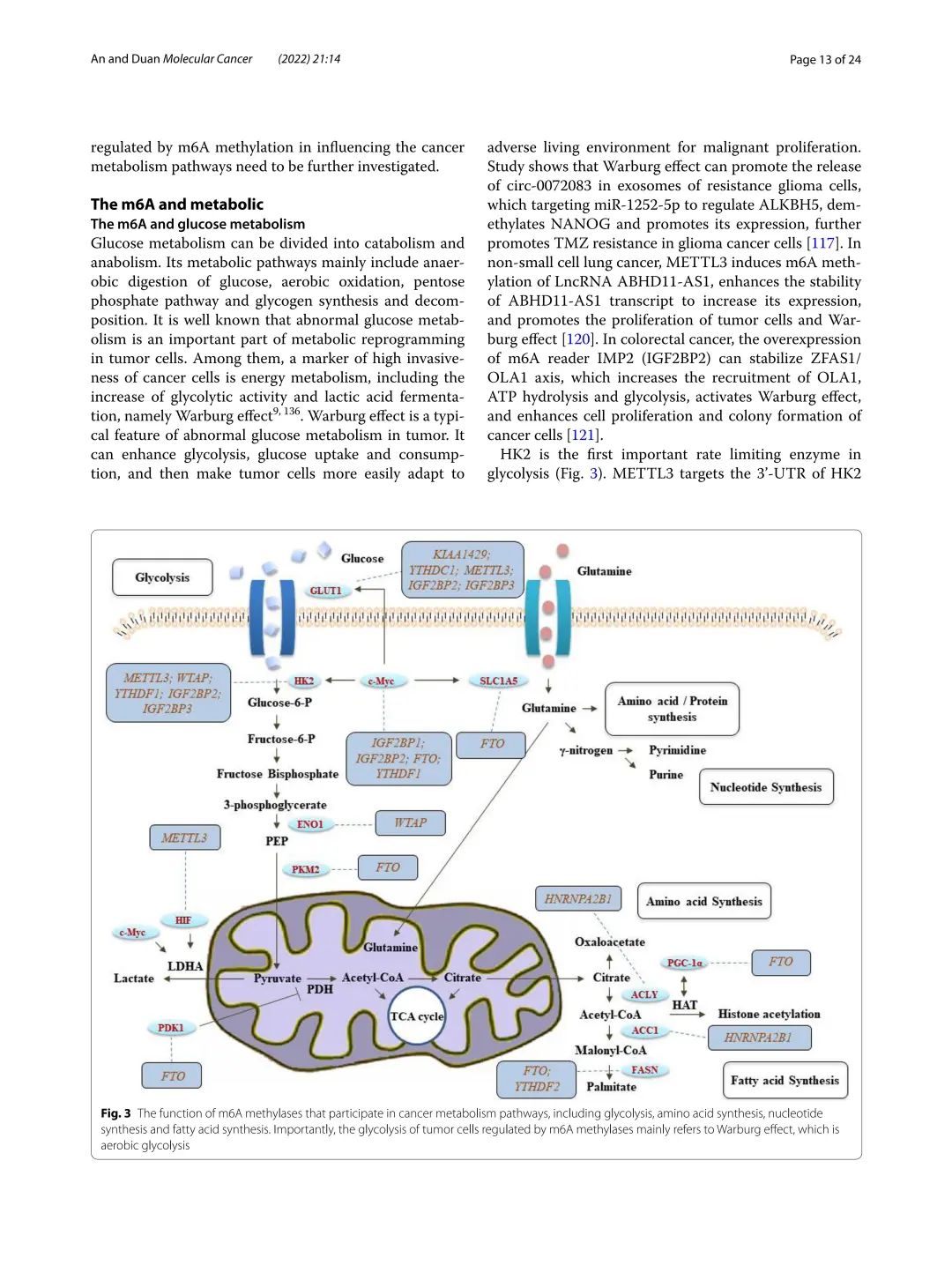
调控元件作用:m6A 标签作为重要的调控元件,在 mRNA 的代谢过程中发挥着关键作用。研究表明,m6A 修饰可以影响 mRNA 的稳定性。例如,当 m6A 修饰存在时,可能会改变 mRNA 与特定蛋白质的结合能力,从而影响 mRNA 在细胞内的降解速率。在某些情况下,m6A 修饰可以使 mRNA 更容易被降解,从而降低其稳定性;而在另一些情况下,m6A 修饰可能会保护 mRNA 免受降解,提高其稳定性。
此外,m6A 修饰还可以调控 mRNA 的翻译效率。一些研究发现,m6A 修饰可以影响核糖体与 mRNA 的结合能力,从而调节翻译的起始和速率。在某些细胞环境中,m6A 修饰可能会促进核糖体与 mRNA 的结合,提高翻译效率;而在其他情况下,m6A 修饰可能会抑制核糖体与 mRNA 的结合,降低翻译效率。
m6A 修饰还对细胞定位有着重要影响。特定的蛋白质可以识别 m6A 修饰的 mRNA,并将其运输到特定的细胞区域。例如,一些 m6A 结合蛋白可以将 mRNA 运输到细胞质中的特定区域,参与特定的生物学过程。
结合蛋白质实现功能:m6A 能够与多种蛋白质结合,从而实现不同的生物学功能。当 m6A 与 poly (A) 结合蛋白(PABP)结合时,它可以促进 PABP 对 mRNA 的保护和稳定作用。PABP 与 mRNA 的 poly (A) 尾结合,参与 mRNA 的稳定性调控和翻译起始。m6A 与 PABP 的结合可能增强了 PABP 与 mRNA 的结合能力,从而提高了 mRNA 的稳定性。
m6A 还可以与多种 RNA 结合蛋白如 HuR、ELAVL1 等结合,影响 mRNA 的翻译效率和细胞定位。例如,HuR 可以结合含有 m6A 修饰的 mRNA,并促进其翻译。HuR 可能通过与翻译起始因子相互作用,增强核糖体与 mRNA 的结合,从而提高翻译效率。ELAVL1 也可以结合含有 m6A 修饰的 mRNA,并将其运输到特定的细胞区域,参与特定的生物学过程。
被酶识别和去除:m6A 可被 FTO、ALKBH5 等酶识别和去除,这一过程对其在细胞中的作用和稳定性产生重要影响。FTO 是一种去甲基化酶,属于 Alkb 蛋白家族中的一员并且与肥胖相关。FTO 可以识别并去除 m6A 修饰,从而改变 mRNA 的生物学功能。研究发现,FTO 被敲除或过表达都会显著改变小鼠的体重,这表明 FTO 对 m6A 修饰的调控在代谢过程中起着重要作用。
ALKBH5 也是一种重要的去甲基化酶,能够对细胞核中的 mRNA 进行去甲基化修饰。在细胞系中敲低 ALKBH5 后,mRNA 上 m6A 修饰水平显著上升。这表明 ALKBH5 在维持 mRNA 的 m6A 修饰水平平衡中起着关键作用。当 m6A 修饰被这些去甲基化酶去除后,mRNA 的稳定性、翻译效率和细胞定位等方面可能会发生改变,从而影响细胞的生物学过程。
M6A CRISPR Activation Plasmid (m)
20ug
M6A CRISPR Activation Plasmid (m2)
20ug
M6A Lentiviral Activation Particles (m)
200 ul
上海优宁维生物科技股份有限公司
试剂 | 耗材 | 仪器 | 软件 | 定制 | 实验服务 | 供应链
免费热线:4008-168-068
咨询邮箱:info@univ-bio.com
订购商城:www.univ-bio.com
微信公众平台:优宁维抗体专家,欢迎关注!
小优博士(小程序):5大课堂, 让你的科研不再难!







