
4YR企业会员
发布人:上海优宁维生物科技股份有限公司
发布日期:2025/2/7 14:01:12
01 采用 His 标签进行蛋白纯化时,为何杂质含量偏高?
可能原因 1:蛋白酶部分降解目的蛋白
可能原因 2:杂质蛋白与镍柱亲和力较强
可能原因 3:杂蛋白和目的蛋白结合
可能原因 4:洗涤不充分
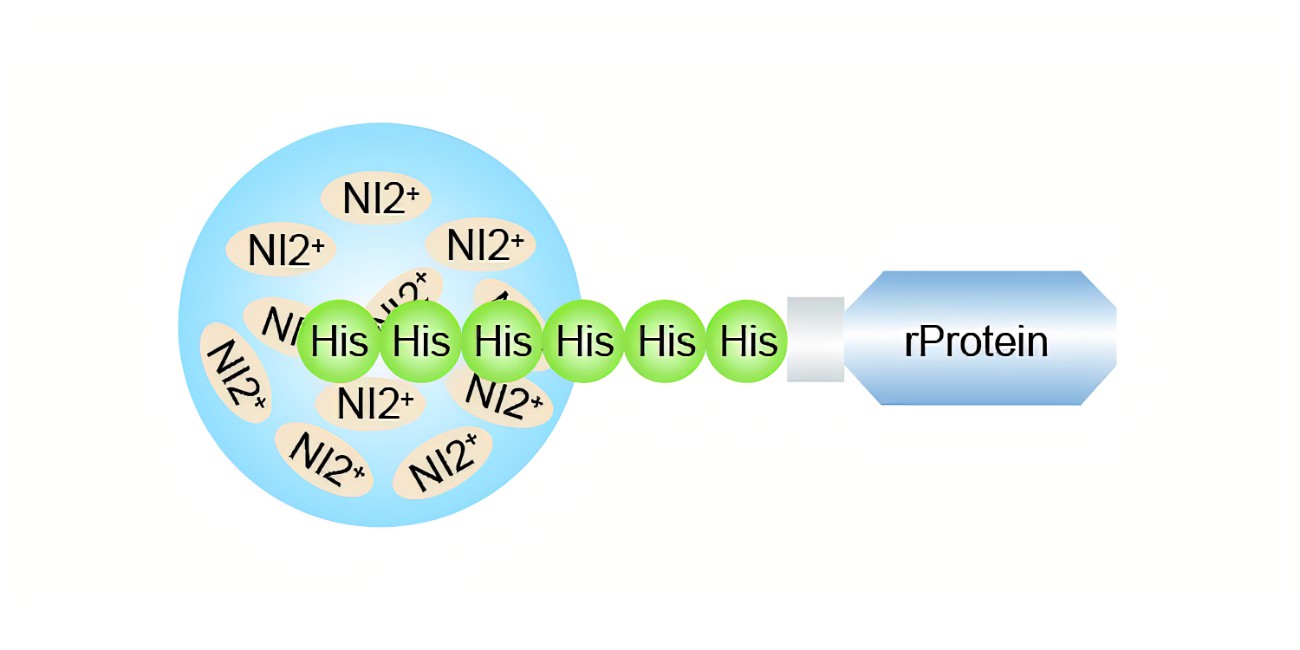
02 为何融合蛋白无法与金属螯合亲和层析柱结合?
可能原因 1:超声功率失当致使蛋白处理异常
可能原因 2:组氨酸标签未能充分暴露
可能原因 3:His 标签出现丢失情况
03 Ni 柱在经过数次使用后,载量出现下降情况,挂柱效率也变低,要如何应对这种状况呢?
可能原因:沉淀累积及蛋白异常结合致使有效位点被占
在 Ni 柱多次使用过程中,沉淀物质逐渐堆积,变性蛋白以及非特异性结合的蛋白会附着在柱体上,它们占据了原本可与目标蛋白有效结合的位点,并且这些杂质无法单纯依靠常规洗脱液完全清除,从而导致柱载量降低,挂柱效率变差。
解决方法:
一、温和清洗流程
此方法旨在以相对温和的试剂处理 Ni 柱,在不损伤柱体结构与性能的前提下,尽可能去除影响柱效的杂质。
针对沉淀或变性物质:使用浓度为 6M 的盐酸胍或 8M 的尿素溶液,以 2 倍柱体积的量对 Ni 柱进行洗涤。这两种试剂能够破坏蛋白质的结构,使沉淀或变性的蛋白质从柱体上解离下来。随后,再用 5 倍柱体积的缓冲液进行冲洗,以去除残留的盐酸胍或尿素以及被解离下来的杂质,恢复柱体的缓冲环境。
针对疏水结合物质:采用 2 倍柱体积的 1% Triton X - 100 溶液进行洗涤。Triton X - 100 是一种非离子型表面活性剂,具有良好的去污和脱脂能力,能够有效去除与柱体发生疏水结合的物质。洗涤后同样用 5 倍柱体积的缓冲液冲洗,确保柱体干净且缓冲体系稳定。若经过上述温和清洗后,Ni 柱的性能改善不明显,则需考虑采用强烈清洗方式。
二、强烈清洗流程
强烈清洗方式较为复杂,涉及多个步骤与不同试剂的使用,但能更深入地清洁 Ni 柱,恢复其载量与挂柱效率。
脱镍操作:首先使用 5 - 10 倍柱体积的脱镍缓冲液(20 mM 磷酸钠,0.5 M NaCl,50 mM EDTA,pH 7.4)对 Ni 柱进行洗涤。EDTA 能够与镍离子形成稳定的络合物,从而将镍离子从柱体上洗脱下来,使柱体处于无镍状态,为后续的深度清洁创造条件。完成脱镍后,用 5 - 10 倍柱体积的平衡缓冲液冲洗,去除残留的脱镍缓冲液,接着再用 5 - 10 倍柱体积的双蒸水冲洗,进一步净化柱体。
去除离子型杂蛋白:用 5 倍柱体积的 1.5 M NaCl 溶液对柱体进行洗涤。高浓度的 NaCl 溶液能够通过离子交换作用,去除与柱体结合的离子型杂蛋白。洗涤后用 10 倍柱体积的双蒸水冲洗,以清除残留的 NaCl 溶液。
去除沉淀或变性蛋白:采用 1M 氢氧化钠溶液处理柱体,结合时间为 1 - 2 小时。氢氧化钠是一种强碱,能够使沉淀或变性的蛋白质发生水解或变性,从而从柱体上脱离。处理后用 10 倍柱体积的平衡缓冲液和 10 倍柱体积的双蒸水依次进行冲洗,确保柱体的酸碱度恢复正常且无残留杂质。
去除疏水蛋白或者脂蛋白:使用 5 - 10 倍柱体积的 30% 异丙醇溶液对柱体进行清洗。异丙醇具有较强的溶解能力,能够有效去除疏水蛋白和脂蛋白。清洗后用 10 倍柱体积的双蒸水洗涤,去除残留的异丙醇。
生镍操作:在完成上述一系列清洁步骤后,需要重新将镍离子加载到柱体上,以恢复其亲和纯化能力。用 0.1M 硫酸镍溶液上柱,使镍离子与柱体结合。随后用 5 倍柱体积的双蒸水和平衡缓冲液进行洗涤,去除多余的硫酸镍溶液,使柱体达到可使用的平衡状态。若 Ni 柱在清洗后不需要立即使用,可将其保存在 20% 乙醇溶液中,防止微生物滋生和柱体干涸。
04 为何融合蛋白与螯合填料结合后难以被洗脱?
可能原因 1:洗脱条件力度不足致使融合蛋白滞留柱上
由于所采用的洗脱条件相对温和,未能有效破坏融合蛋白与螯合填料之间较强的结合力,从而导致融合蛋白依然牢固地附着在柱体之上,无法顺利被洗脱下来。
解决方法:优化洗脱条件以增强洗脱效果
通过逐步增加咪唑的浓度构建梯度洗脱体系,或者适当降低洗脱液的 pH 值,利用这两种方式来探索并确定能够实现融合蛋白最佳洗脱效果的条件组合,促使融合蛋白从螯合填料上有效解离。
可能原因 2:低 pH 洗脱引发镍离子脱落问题
当采用降低 pH 值的方法进行洗脱操作时,如果 pH 值低于 3.5,会导致螯合填料上的镍离子发生脱落现象。这不仅会破坏填料的亲和性能,还会使洗脱过程失去对融合蛋白的特异性洗脱能力,进而导致融合蛋白无法正常洗脱。
解决方法:调整洗脱策略避免镍离子脱落
摒弃低 pH 值洗脱的方法,转而采用咪唑竞争性洗脱方式。咪唑能够与融合蛋白竞争结合填料上的镍离子,在不影响镍离子与填料结合稳定性的前提下,实现融合蛋白的洗脱,确保洗脱过程的有效性和填料的可重复使用性。
可能原因 3:蛋白沉淀于柱体之上阻碍洗脱
在某些情况下,融合蛋白可能会在柱体上发生沉淀现象,这可能是由于上样量过大、蛋白浓度过高或者环境因素等导致的。沉淀后的蛋白会紧密附着在柱体表面,严重阻碍洗脱过程的顺利进行。
解决方法:针对性处理柱上蛋白沉淀问题
可能原因 4:非特异性相互作用干扰洗脱
融合蛋白与螯合填料之间可能存在非特异性的疏水相互作用或者其他类型的非特异性相互作用,这些额外的相互作用会增强蛋白与柱体的结合力,使得在常规洗脱条件下难以将融合蛋白洗脱下来。
解决方法:削弱非特异性相互作用促进洗脱
向洗脱缓冲液中添加非离子去污剂(如 2% Triton X - 100),非离子去污剂能够降低蛋白与柱体之间的疏水相互作用,破坏非特异性结合。或者适当增加 NaCl 的浓度,利用盐离子的屏蔽作用减少蛋白与柱体之间的静电相互作用等非特异性相互作用,从而提高融合蛋白的洗脱效率。
可能原因 5:填料表面蛋白聚集影响洗脱
在填料表面可能会形成高密度的融合蛋白聚集现象,这可能是由于所选用的填料载量与实际样品蛋白含量不匹配,载量过高导致蛋白在填料表面过度堆积而形成聚集。聚集后的蛋白群体与填料之间的相互作用复杂且紧密,不利于洗脱过程的进行。
解决方法:合理选择填料载量避免蛋白聚集
在进行实验之前,根据样品中融合蛋白的含量和性质,选择合适载量的填料,避免盲目追求高载量。合适的填料载量能够使蛋白在填料表面均匀分布,减少聚集现象的发生,从而有利于后续的洗脱操作,提高融合蛋白的回收效率。
上海优宁维生物科技股份有限公司
试剂 | 耗材 | 仪器 | 软件 | 定制 | 实验服务 | 供应链
免费热线:4008-168-068
咨询邮箱:info@univ-bio.com
订购商城:www.univ-bio.com
微信公众平台:优宁维抗体专家,欢迎关注!
小优博士(小程序):5大课堂, 让你的科研不再难!


相关新闻资讯