
6YR企业会员
发布人:广州优南科技有限公司
发布日期:2025/7/1 10:51:41
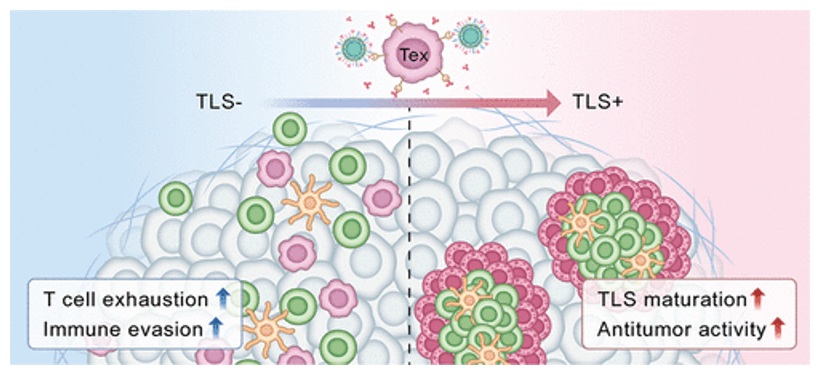
TOC图. 纳米疫苗逆转T细胞耗竭并改善TLS功能
绝大多数胰腺导管腺癌(PDAC)、结直肠癌(CRC)等非免疫原性肿瘤对免疫检查点抑制剂等免疫治疗疗效不佳,可能与其肿瘤微环境的高度免疫抑制性有关,表现为免疫细胞浸润少且T细胞容易进入耗竭状态。已经发现肿瘤内三级淋巴结构(TLS)是免疫细胞活化与协调的关键枢纽,与多种癌症患者的预后改善密切相关。在PDAC中,与TLS相关的CD8+ T细胞高表达TIM-3等耗竭标志物,且既往研究已经发现TIM-3与肿瘤进展和不良预后密切相关。基于上述背景,本研究旨在开发一种能够靶向耗竭T细胞、恢复其功能并增强TLS作用的治疗策略,以改善非免疫原性肿瘤的免疫微环境从而显著提升其免疫治疗疗效。
近日,中山大学附属第六医院孟晓春主任医师团队与附属第三医院帅心涛教授团队联合研究发现:靶向肿瘤耗竭T细胞的纳米疫苗可促进三级淋巴结构功能并增强免疫细胞间的交互作用。该研究工作发表于ACS Nano。
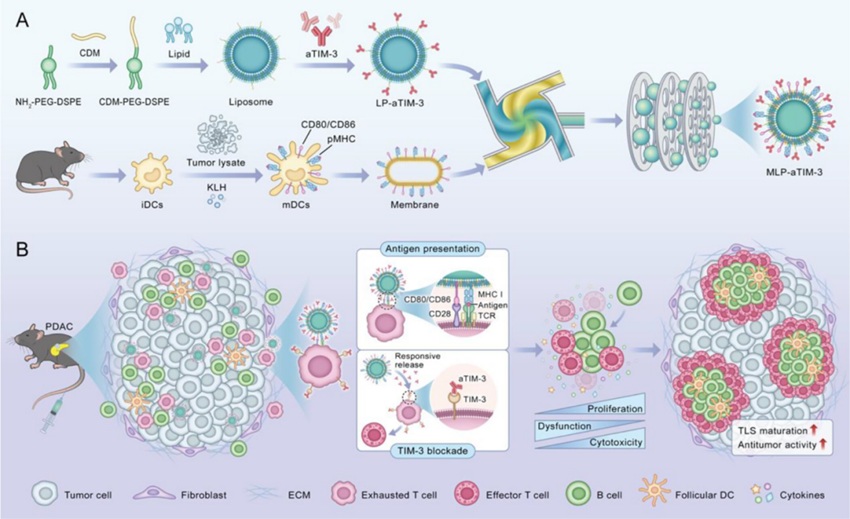
主旨图. 纳米疫苗制备流程与体内靶向耗竭性T细胞机制图
研究者首先基于公共数据集分析,发现HAVCR2高表达与胰腺癌T细胞浸润差及预后不良显著相关(图1A-G);其后在临床样本分析中也发现,化疗以及化疗联合免疫治疗虽然能在一定程度上提高PDAC的T细胞浸润,但也同时导致TIM-3表达升高。基于全病理切片和多色免疫荧光染色,他们发现PDAC中存在TLS、但TLS相关T细胞却处于终末耗竭状态,导致TLS无法发挥高效抗肿瘤免疫应答作用(图1H-K)。
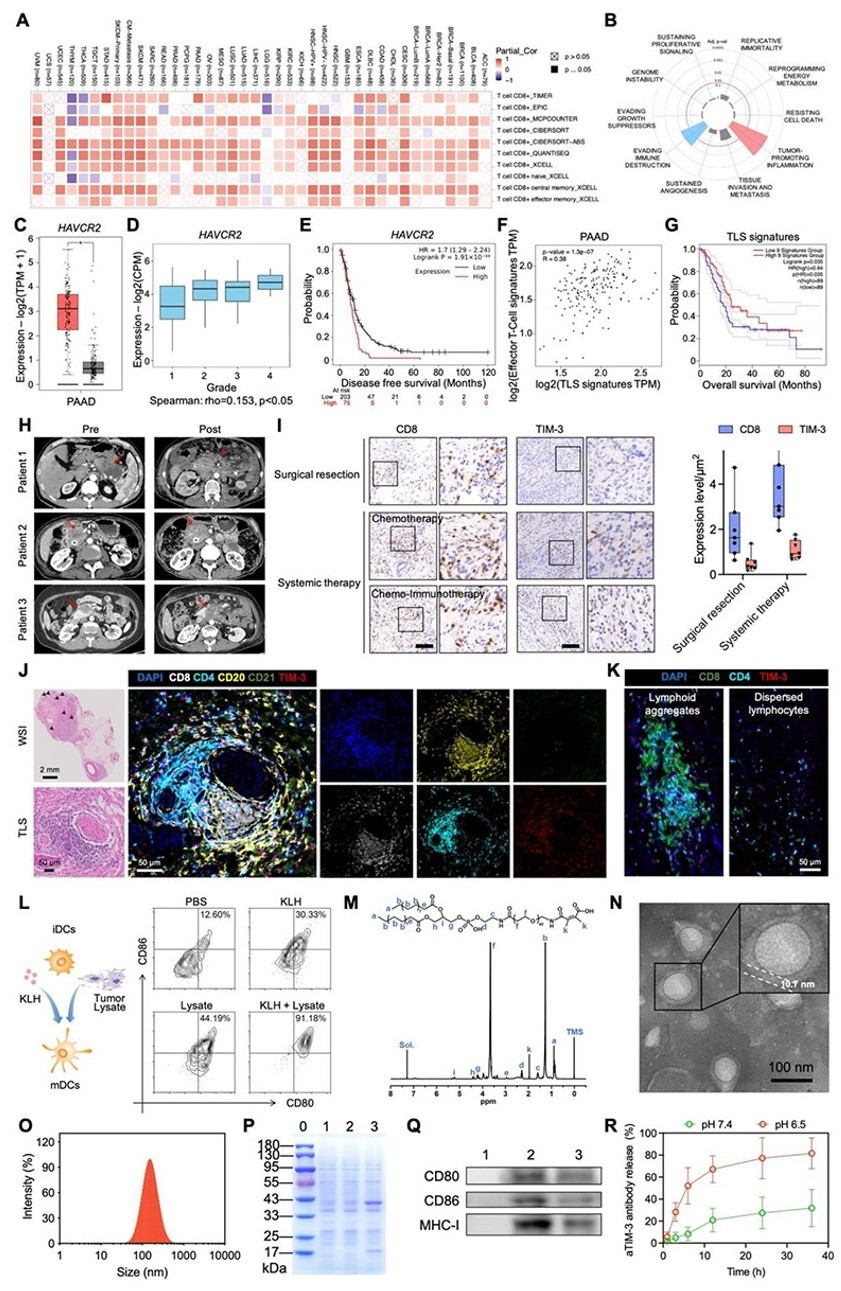
图1. (A-G) TCGA-PAAD队列分析,(H-K) 临床分析,(L-R) 纳米疫苗制备与表征。
针对上述现象,研究者通过将抗原致敏的树突状细胞膜(含pMHC抗原和CD80/CD86共刺激分子)与靶向TIM-3的脂质纳米颗粒融合,开发出MLP-aTIM-3纳米疫苗(图1L-R),并证实该疫苗可逆转T细胞耗竭并促进TLS形成与成熟。将上述纳米疫苗用于多种肿瘤模型(包括PDAC原位模型、肝转移模型和结直肠癌模型),均发现MLP-aTIM-3能够显著增强抗肿瘤免疫应答,延长小鼠生存期,为克服“冷肿瘤”免疫逃逸提供了新思路。
总结及展望
本研究构建的MLP-aTIM-3疫苗通过以下两个环节显著增强抗肿瘤免疫应答:(1)利用TIM-3抗体靶向结合肿瘤内浸润的TIM-3+耗竭性T细胞,阻断其抑制性信号,恢复其增殖能力和效应功能;(2)借助树突状细胞膜直接呈递肿瘤抗原并提供共刺激信号,诱导TLS中B细胞滤泡(CD20+)和滤泡树突状细胞(CD23+)形成,增强T细胞与B细胞的交互作用,促进TLS成熟。RNAseq结果发现,MLP-aTIM-3通过上调促炎基因(如Gzmc、IL2、Ccl4)和B细胞活化相关通路(如CXCR5、Bcl6)重塑肿瘤微环境免疫应答。此外,该疫苗具有良好的生物相容性。
目前关于T细胞耗竭与TLS之间相互作用机制的研究仍不多见,这一研究的创新主要体现在:(1)纳米疫苗设计理念的创新;(2)在一定程度上实现了机制研究的突破;(3)为未来开拓新的治疗策略提供了新思路,通过逆转T细胞耗竭来增强TLS免疫细胞间的交互作用,解决了PDAC内有TLS形成但免疫逃逸显著的矛盾。此外,研究者进一步展望了相关领域的未来研究方向,包括:(1)后续研究可关注T细胞耗竭的上游信号通路;(2)在T细胞耗竭的早期阶段进行干预可否取得更好的治疗效果。
Cognate Nanovaccine Promotes Tertiary Lymphoid Structures Function and Strengthens Immune Cell Cross-Talk by Targeting Exhausted T Cells in Nonimmunogenic Cancers
Gengjia Chen, Tan Li, Rui Duan, Weiye Liang, Bo Li, Xiaoxue Xie, Long Yang, Xintao Shuai*, Xiaochun Meng*
ACS Nano 2025, 19, 23, 21385-21399
https://doi.org/10.1021/acsnano.5c01280
Published June 6, 2025
© 2025 American Chemical Society
以上内容转载自https://www.x-mol.com/news/923165
版权归原作者所有,如有任何问题,请联系我们!
优南推荐产品
纳武单抗
946414-94-4
相关新闻资讯