
11YR企业会员
发布人:深圳振强生物技术有限公司
发布日期:2024/7/16 13:48:34



引言
继去年我们发布了《鼻炎和荨麻疹治疗药-比拉斯汀片相关杂质研究分享》定性研究之后,今天我中心将继续分享比拉斯汀特异性杂质稳定性研究。

实验方案
在本次实验中,我中心参照国家食品药品监督管理总局发布的《比拉斯汀片》进口药品注册标准(标准号JX20130329)中“有关物质”检查项下所使用的色谱条件对比拉斯汀的3个特定杂质进行了溶液稳定性研究,所用样品货号及结构式如下如图1和图2:
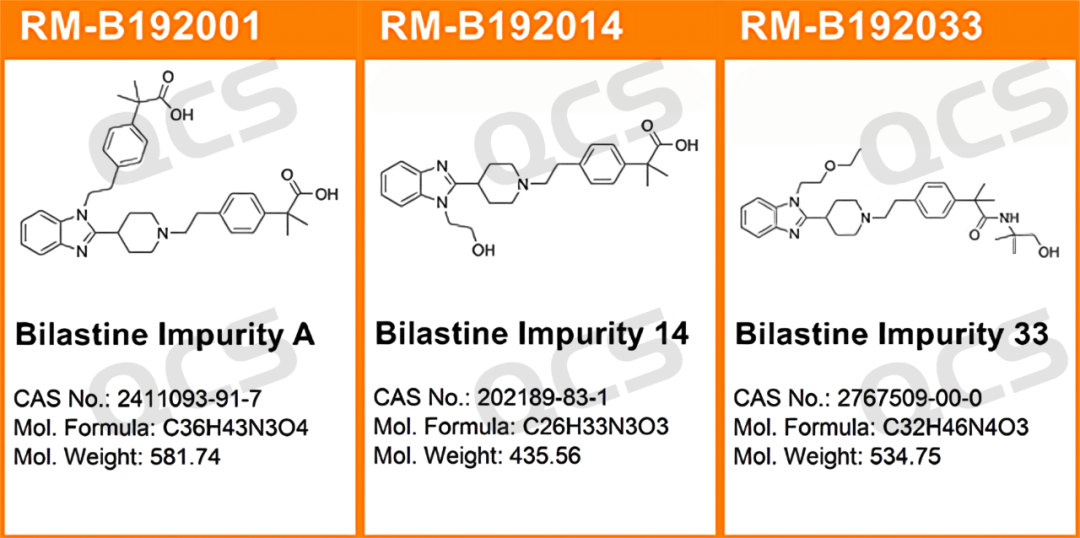
图1:本次研究所用杂质QCS货号及结构
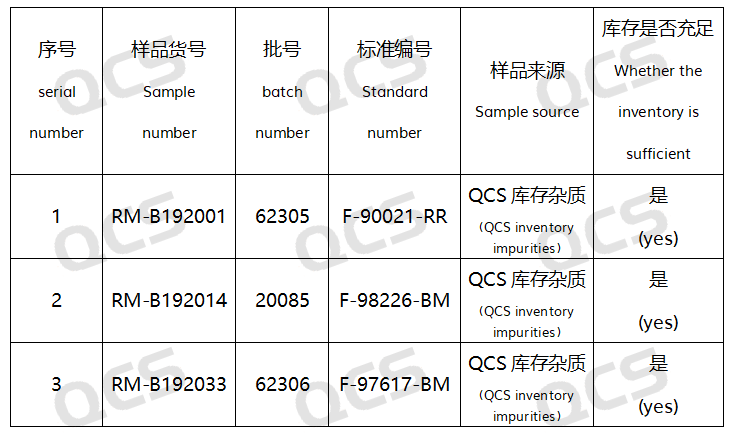
图2:进口标准杂质代码和QCS货号对应关系
在本次实验中,实验员将RM-B192001(F-90021-RR;Bilastine Impurity A;CAS : 2411093-91-7 )、RM-B192014(F-98226-BM;Bilastine Impurity 14;CAS : 202189-83-1 )和RM-B192033(F-97617-BM;Bilastine Impurity 33;CAS : 2767509-00-0 )各取适量,分别放置在酸性、中性和碱性的溶液中,分别于常温常压下放置0、3、6、12、24小时后参照《比拉斯汀片》进口药品注册标准(标准号JX20130329)中“有关物质”检查项下所使用的色谱条件进样检测。观测随着样品放置时间的延长,样品主峰峰面积的变化。以此为根据来确定样品的溶液稳定性。

实验结论
经过检测发现样品RM-B192001(F-90021-RR)在酸性和中性溶液中放置24小时的过程中主峰峰面积变化不大,相对标准偏差均小于2.0%。所以可以认为该样品在酸性和中性溶液中放置24小时的过程中是比较稳定的。但是该样品在碱性溶液中放置24小时的过程中主峰峰面积不断减小,对比该样品在碱性溶液中放置0.0小时检测所得的图谱和在中性溶液中放置0.0小时检测所得的图谱可以发现,该样品在用碱性溶液配制样品溶液的过程中就已经发生了部分降解,在碱性溶液中放置0.0小时到24.0小时的过程中也在发生持续缓慢的降解。样品RM-B192001(F-90021-RR)在各PH值条件下每个检测点主峰峰面积数据如下:
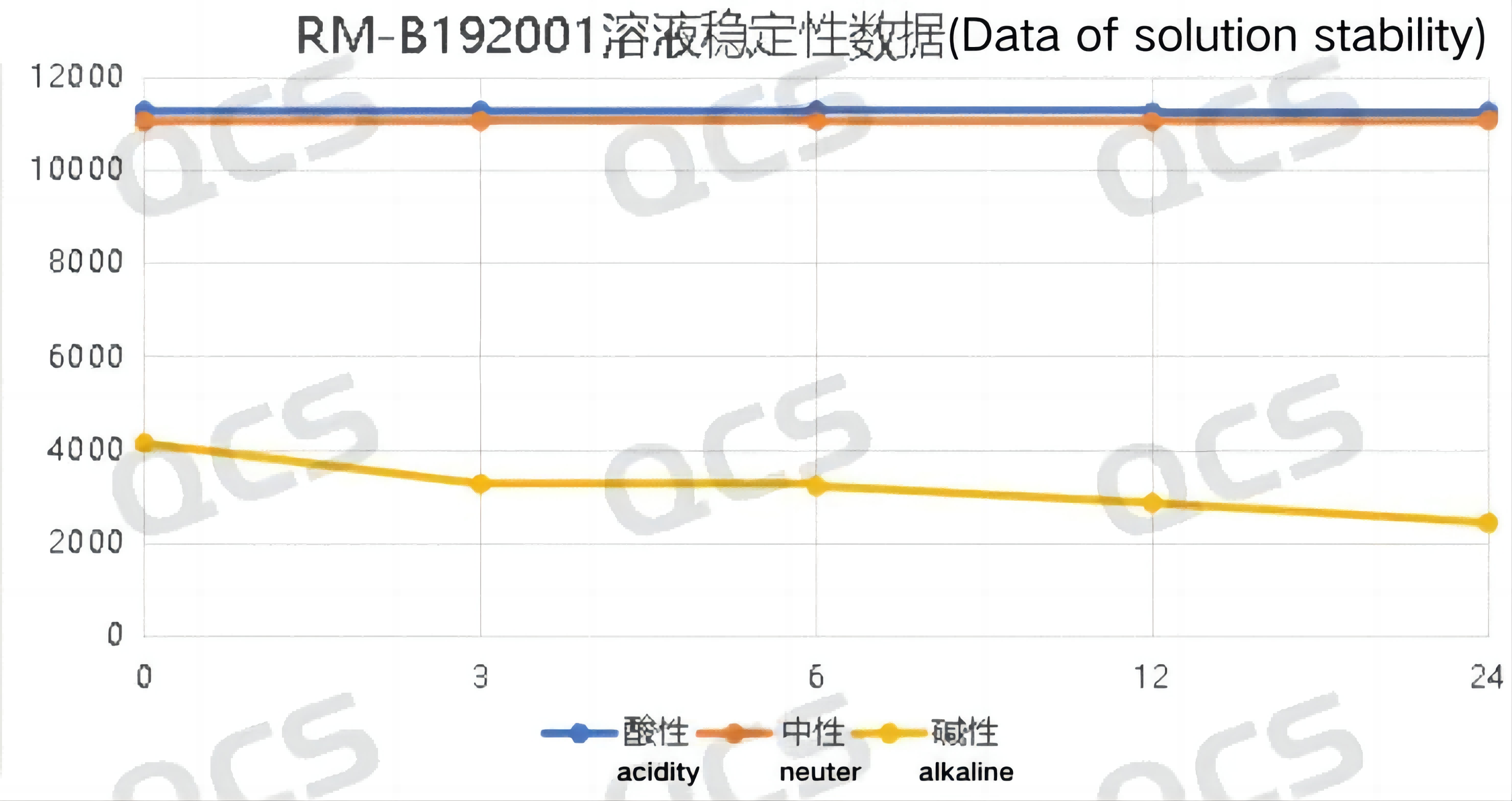
图3:样品RM-B192001(F-90021-RR)的溶液稳定性数据汇总图
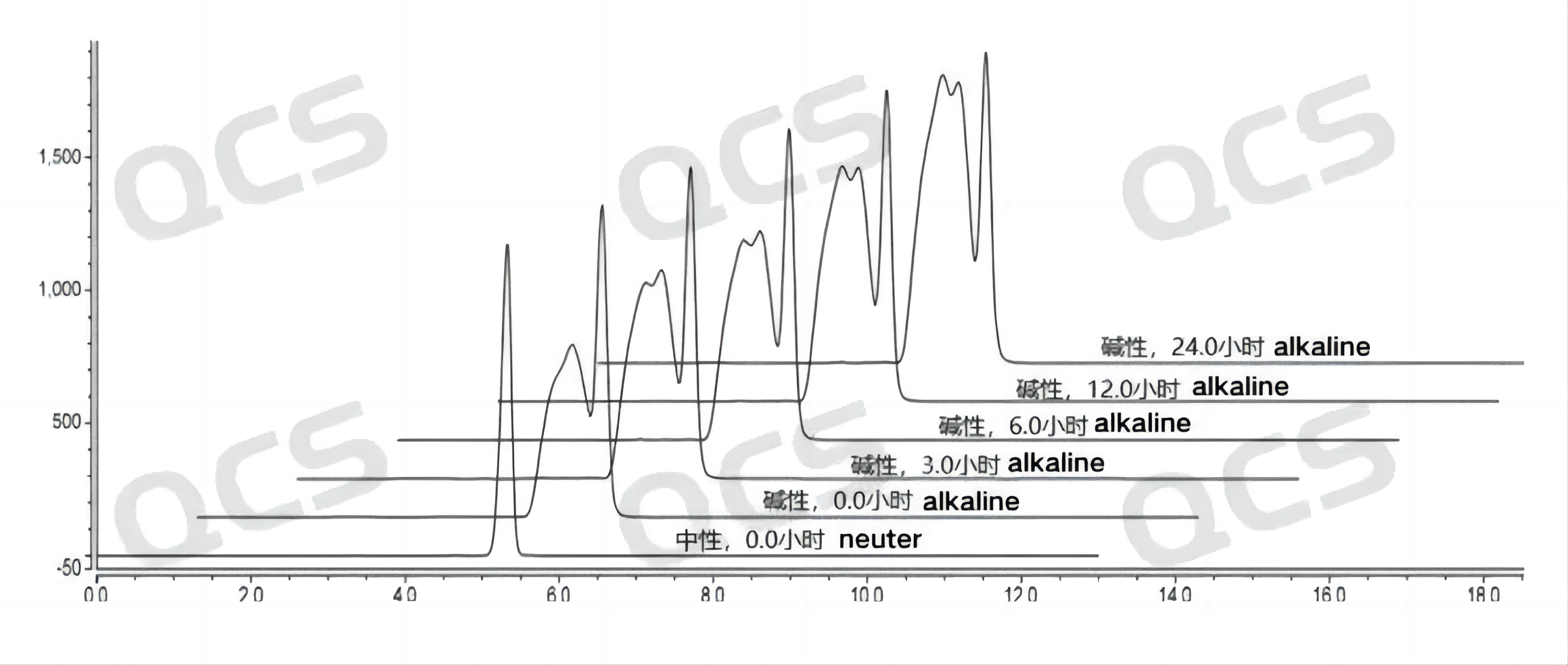
图4:样品RM-B192001(F-90021-RR)的溶液稳定性数据汇总图
经过检测发现样品RM-B192014(F-98226-BM)在酸性和中性溶液中放置24小时的过程中主峰峰面积变化不大,相对标准偏差均小于2.0%。所以可以认为该样品在酸性和中性溶液中放置24小时的过程中是比较稳定的。但是该样品在碱性溶液中表现得“似乎”不是那么稳定,在对该样品进行碱性稳定性测试时,该样品表现出有趣的“异常”实验结果。
当将该样品置于碱性的溶液后立即上机测试(图中0.0小时)检测所得的图谱和以中性溶液条件进行对比发现:该样品在在碱性溶液中检测所得的图谱其主峰保留时间与中性条件发生很大变化,但是随着时间的延长该结果不会进一步的“恶化”。并且,碱性溶液中放置24小时的样品调节其PH为中性后,样品主峰保留时间恢复与在中性溶液条件下结果一致。以上结果说明样品RM-B192014(F-98226-BM)在碱性条件下出现的“异常”结果更可能来源于该PH条件下样品离子状态的改变而非样品降解,随PH的调整样品结果可以恢复。因此可以认为该样品在碱性溶液中放置24小时的过程中是比较稳定的。样品RM-B192014(F-98226-BM)在各PH值条件下每个检测点主峰峰面积数据如下:
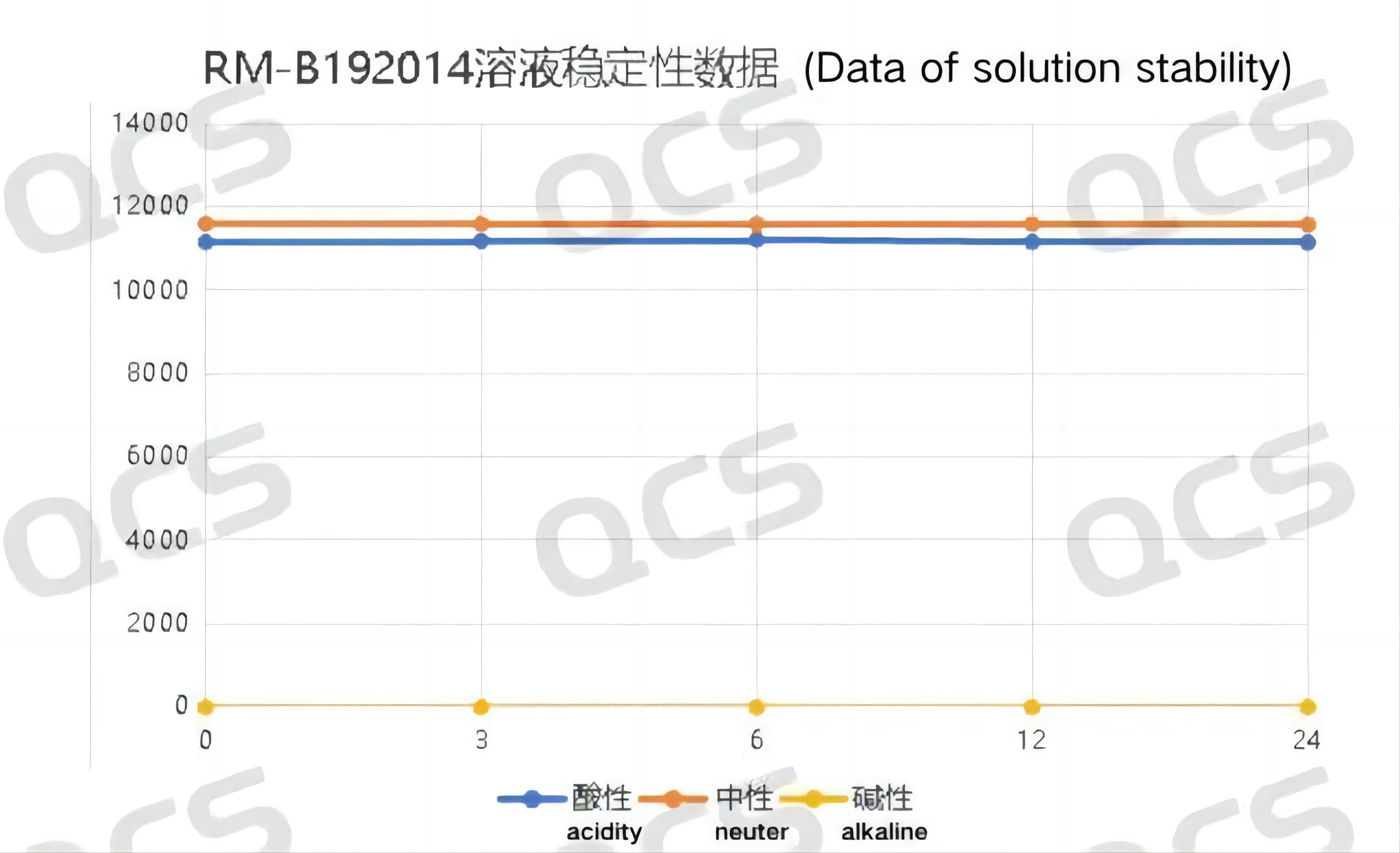
图5:样品RM-B192014(F-98226-BM)的溶液稳定性数据汇总折线图
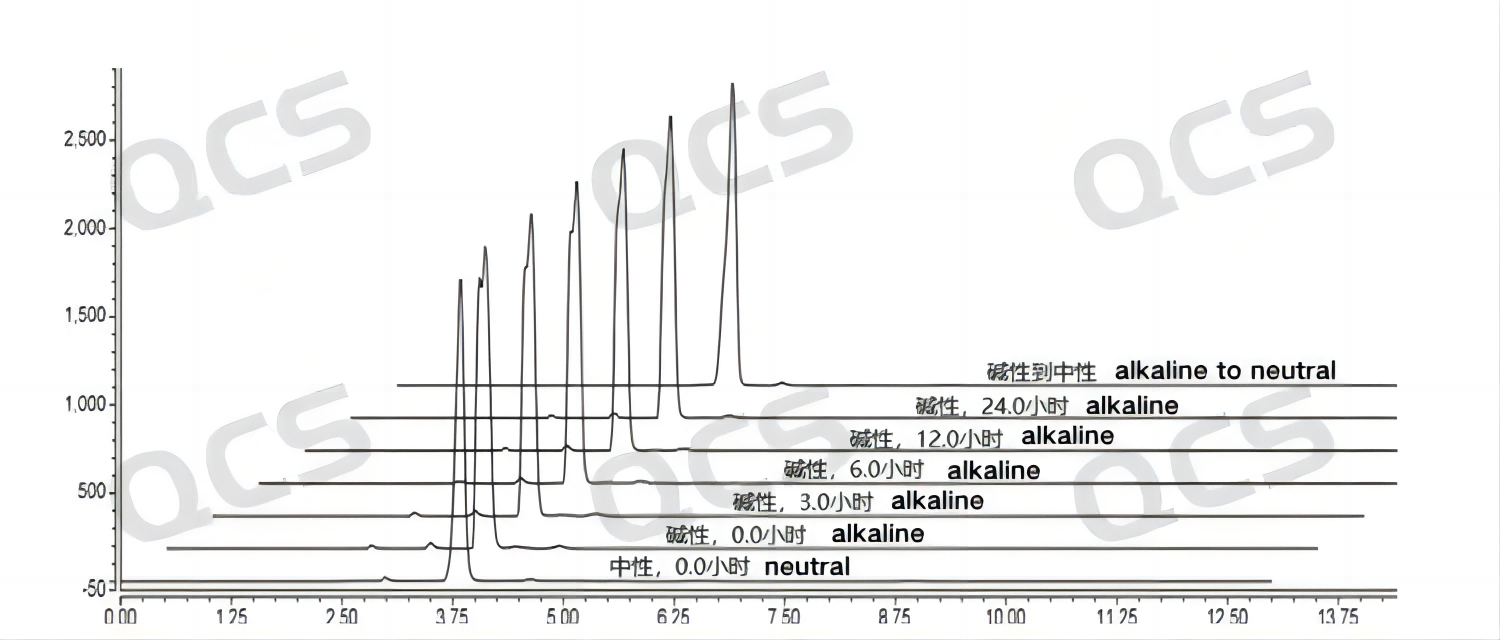
图6:样品RM-B192014(F-98226-BM)的溶液稳定性数据汇总图
经过检测发现样品RM-B192033(F-97617-BM)在碱性和中性溶液中放置24小时的过程中主峰峰面积变化不大,相对标准偏差均小于2.0%。所以可以认为该样品在中性和碱性溶液中放置24小时的过程中是比较稳定的。但是该样品在酸性溶液中放置24小时的过程中主峰峰面积变化较大,对比该样品在酸性溶液中放置0.0小时检测所得的图谱和在中性溶液中放置0.0小时检测所得的图谱可以发现,该样品在用酸性溶液配制样品溶液的过程中就已经完全降解。样品RM-B192033(F-97617-BM)在各PH值条件下每个检测点主峰峰面积数据如下:
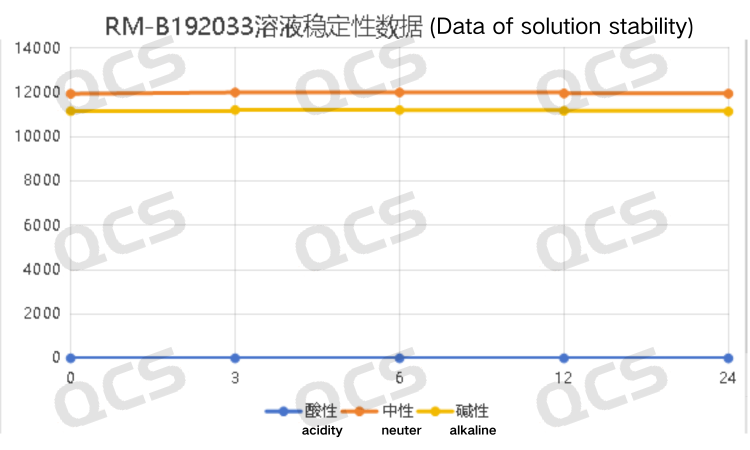
图7:样品RM-B192033(F-97617-BM)的溶液稳定性数据汇总折线图
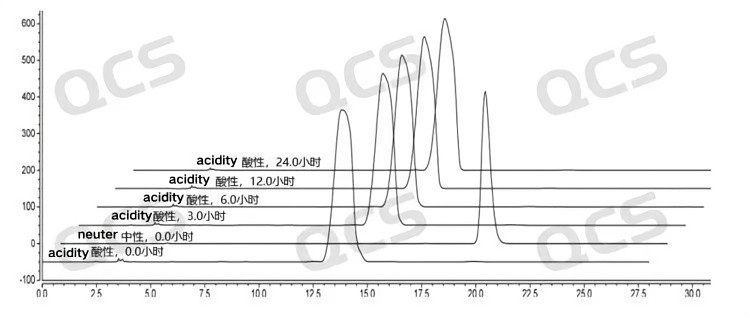
图8:样品RM-B192033(F-97617-BM)的溶液稳定性数据汇总图

总结
综上所述,通过本次实验,我们发现样品RM-B192001(F-90021-RR)在酸性和中性溶液中稳定性都较好,但在碱性溶液中不稳定。样品RM-B192001(F-90021-RR)在用碱性溶液配样过程中就会发生部分降解,而且随着放置时间的延长会不断的发生降解。RM-B192014(F-98226-BM)在酸性、中性和碱性溶液中稳定性都较好,但是如果用碱性稀释剂溶解样品,会导致样品主峰保留时间发生较大的变化。所以客户在检测样品RM-B192001(F-90021-RR)和RM-B192014(F-98226-BM)时,应避免使用碱性稀释剂,在使用、储存和运输过程中也不能碰碱。样品RM-B192033(F-97617-BM)在中性和碱性溶液中稳定性都较好,但在酸性溶液中不稳定,在用酸性溶液配样过程中会全部降解。所以客户在检测样品RM-B192033(F-97617-BM)时,应避免使用酸性稀释剂,在使用、储存和运输过程中也不能碰酸。如果客户对这3个样品的稳定性内容有需要,可以向本公司咨询。


相关新闻资讯