紫杉醇是从短叶紫杉树皮中提取的具有抗肿瘤作用的活性物质,是一种新型的抗微管药物,但与长春新碱和秋水仙碱阻断细胞微管形成的作用机制不同,本品是与微管蛋白结合,通过促进细胞在其分裂间期形成不典型的微管框架并阻止微管正常的生理性解聚,使快速分裂的肿瘤细胞在有丝分裂期内被牢牢限制在这一框架内,最后因复制受到阻断而死亡,本品属广谱抗肿瘤药,治疗指数高。另外紫杉醇还有显著的放射增敏作用,使细胞停止于对放射敏感的G2和M期。临床上紫杉醇主要用于卵巢癌、乳腺癌、肺癌、恶性黑色素瘤等,对实体瘤如食管、头颈部、胃等癌瘤亦有效。
紫杉醇是一种新型的作用于M期的植物类抗肿瘤药,对乳腺癌、卵巢癌、非小细胞肺癌有较好疗效,对转移乳腺癌有效率为11.9%~29%。
紫杉类药物可以在缺少鸟苷三磷酸 (GTP) 与微管相关蛋白 (MAP) 的条件下诱导形成无功能的微管,而且使微管不能解聚。对顺铂、阿霉素耐药的癌细胞也有效。静脉注射本品后血浆内消除呈二室模型,平均t1/2α为0.27h,t1/2β为6.4h,血浆蛋白结合率为95%~98%。本品临床主要适用于卵巢癌和乳腺癌,对肺癌、大肠癌、黑色素瘤、头颈部癌、淋巴瘤、脑瘤也有一定疗效。
【药理作用】
本品是从短叶紫杉中提取或半合成的一种抗癌药。可促进微管蛋白装配成微管,但同时抑制微管的解聚,从而导致微管束的排列异常,使纺锤体失去正常功能,从而导致细胞死亡。还可在缺少鸟苷三磷酸与微管相关蛋白的条件下,诱导形成无功能的微管。本品属于广谱抗肿瘤药。对顺铂、多柔比星耐药者也有效。滴注结束6~12小时后,血药浓度仍可达细胞毒活性的水平。在血浆内消除呈二室模型,平均半衰期α相为0.27小时,β相为6.4小时。主要在肝脏代谢,经胆汁随粪便排泄。
【药代动力学】
本品仅供静脉给药,滴注后血浆药物呈双相消除,T1/2α为5.3~ 17.4小时,总消除率为5.8~ 16.3L/(h·m2),分布容积为42~162 L/m2,有广泛的血管外分布和组织结合的效应。89%~ 98%的药物可与血浆蛋白结合,血药浓度峰值为435~802ng/mL,滴注完后6~ 12小时血药浓度仍达85ng/mL以上,仍具有细胞毒活性。药物仅有少量以原形从尿中排出,占给药剂量13%左右,体内转化可能以肝脏代谢为主,胆道排泄。
【在体外的抗肿瘤作用】
四氮唑(MTT)试验证明人癌细胞体外微量培养的口腔癌细胞(KB)、结肠癌细胞(HCT-8)及卵巢癌细胞(A2780)对紫杉醇最敏感,其ED50分别为0.0019,0.0019及0.0036μg/ml。乳腺癌细胞(MCF-7B)、胃癌细胞(MGC80-3)、肺腺癌细胞(A549)及肝癌细胞(Be17402)次之。对长春新碱耐药的两种癌细胞KB及HCT-8对紫杉醇不够敏感(表1001)。小鼠白血病细胞L1210及黑色素瘤B16细胞的软琼脂集落形成试验表明,紫杉醇对二者的集落形成能力皆有明显抑制作用,并呈剂量依赖性。
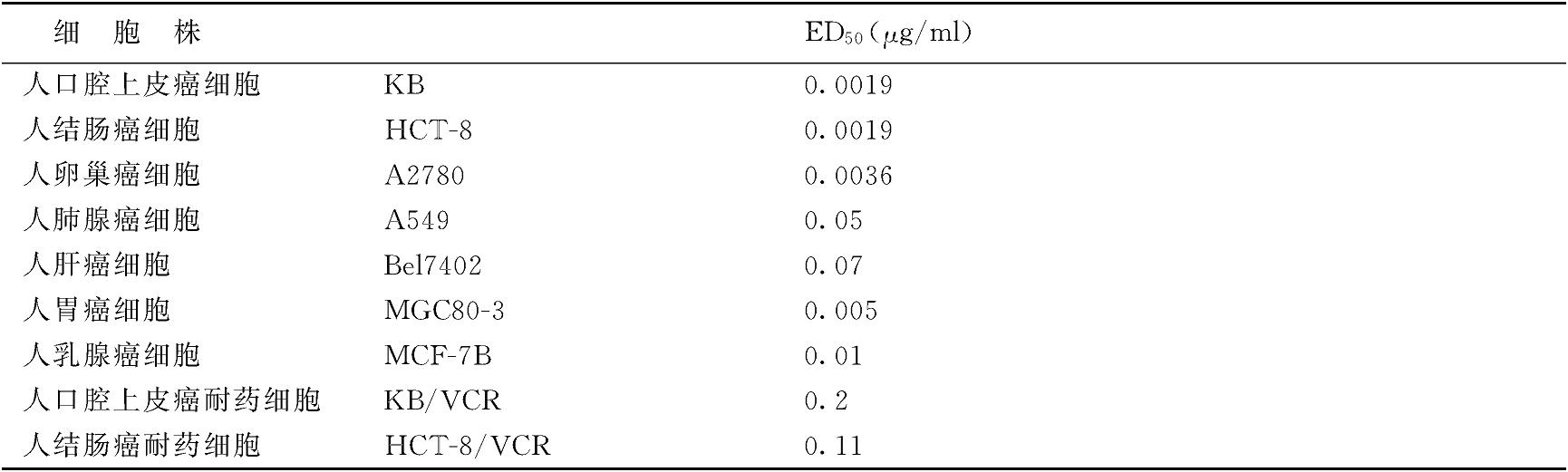
表1001 紫杉醇对人癌细胞的杀伤作用
【在体内对动物移植性肿瘤生长的抑制】
动物移植性肿瘤实验证明,紫杉醇在2.5 mg/kg的剂量,连续腹腔给药10天对小鼠黑色素瘤B16有明显抑制作用,并使肉瘤180小鼠生命明显延长,Walker癌肉瘤256对紫杉醇也很敏感,紫杉醇在8 mg/kg剂量可明显抑制肿瘤的生长(表1002)。
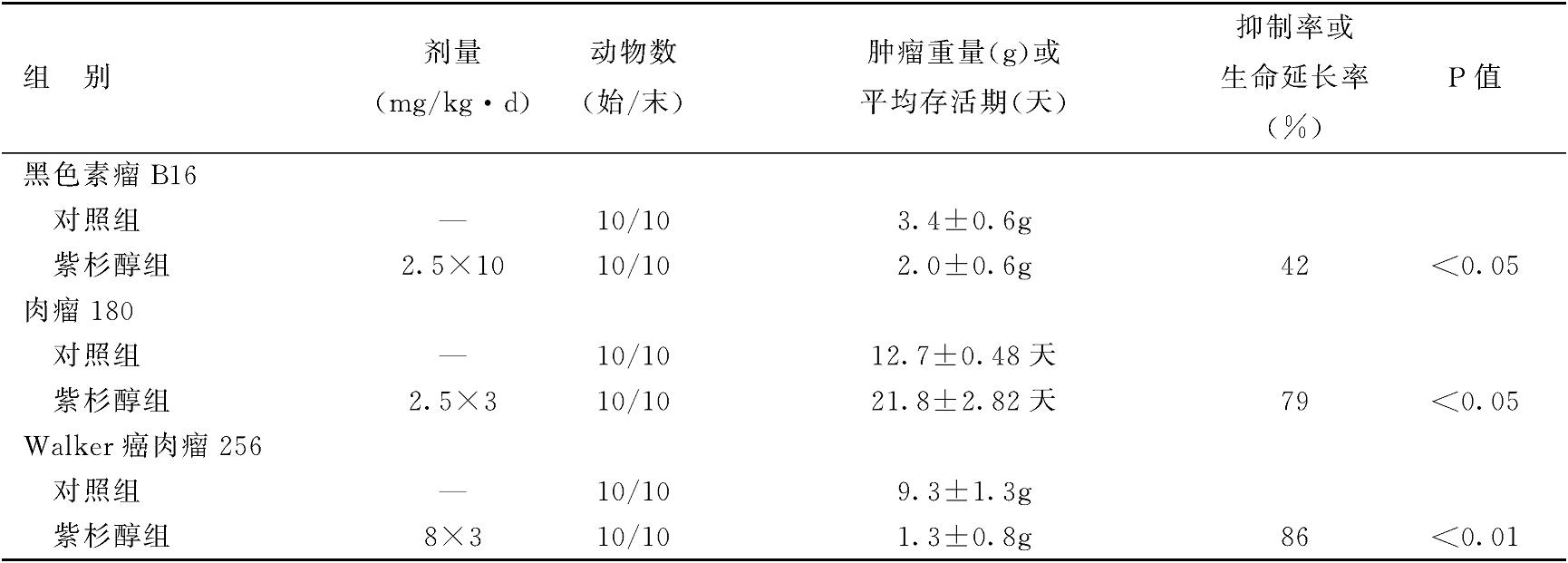
表1002 紫杉醇对动物移植性肿瘤的生长抑制
【紫杉醇的毒理学研究】
(一)急性毒性
取昆明种小鼠50只,每组10只,雌雄各半。紫杉醇采用临床给药剂型,在最大给药剂量45 mg/kg最大给药体积时,小鼠腹腔注射一次给药未见动物死亡。大鼠(SD大鼠)腹腔注射一次给药的LD50为:雄:32.53 mg/kg;雌:35.66 mg/kg。动物死亡多出现在给药后4~7天。动物死前出现竖毛、闭眼、腹部凹陷、身体呈弓形、腹泻等症状。
(二)亚急性毒性
取Wistar大鼠100只,每组20只,雌雄各半。分别腹腔注射不同剂量的紫杉醇溶液1 mg/kg×18,2mg/kg×18及4 mg/kg×18。每天注射1次,每周连续注射6天,共3周,休息一周后再重复注射6天,休息一周,再重复给药一周,定时注射。部分动物从2~3周开始出现血性鼻分泌物,眼、口、唇、耳周围可见少量血痂。高剂量组动物(4 mg/kg×18)在给药第2周开始出现死亡。多数动物濒死时,口鼻出血增多,并伴腹泻,呈极度消瘦、弓背状。紫杉醇3个给药组与溶剂对照组除碱性磷酸酶(ALP)数值高于正常对照组外,其余各项血液生化指标与正常对照相比,无明显差异。紫杉醇高剂量注射引起大鼠白细胞、红细胞减少。尸检可见紫杉醇 4mg/kg×18组动物皆有腹水,腹腔脏器广泛粘连,肝呈灰色,边缘稍钝,脾缩小,前列腺稍小,子宫腔及卵巢有出血点。中剂量、低剂量组动物内脏大体观察除前列腺较小、脾脏稍小外,其余无异常发现。病理学检查,除高剂量组内6例中有3例腹腔内的卵巢和胰腺周围及腹膜等有急性炎症反应外,三组给药动物的其他脏器未发现病理性改变。
(三)紫杉醇的致突变及致畸作用
Ames试验证明,紫杉醇在0.5,5,50,500及1000μg/皿的浓度下不影响沙门氏菌属TA97,TA98,TA100,TA102回复突变。微核试验表明,紫杉醇10.8 mg/kg,21.6 mg/kg及54 mg/kg皆可使微核形成率增加,并呈剂量正相关。染色体畸变实验指出,紫杉醇在1/2 IC50的浓度下使CHL细胞染色体畸变率明显增加。
【主要用途和用法】
紫杉醇主要用于治疗卵巢癌和乳腺癌(经一线化疗或多次化疗失败的卵巢癌;经联合化疗失败的转移性乳腺癌或经辅助性化疗后6个月内复发的乳腺癌),对肺癌、食管癌、胃癌、软组织肉瘤、大肠癌、黑色素瘤、头颈部癌、淋巴瘤、脑瘤、精原细胞瘤等也有一定疗效。用法: 单药治疗,成人每次135~175mg/m2,静滴3小时,每3周1次。现多使用每周1次给药,每次50mg/m2,连用2~3周,每3~4周重复一个疗程。在酌情减量后,可与其他细胞毒药物如多柔比星、顺铂等联用。
【紫杉类药物】
紫杉类药物是一类重要的新型抗肿瘤药,其独特的化学结构与作用机制以及在临床试用中观察到的显著抗肿瘤活性,使之成为近十年来发现的最重要的新型抗癌药之一。紫杉类药物是由短叶紫杉(Taxus brevis)的树干、树皮或针叶中提取或半合成的有效成分。我国的红豆杉(Tchinesis)亦含有这种成份。多西紫杉醇为半合成的衍生物。其前体是从欧洲紫杉(Taxus baccata)的针叶中提取的无活性化合物,在结构上与紫杉醇稍有不同。
紫杉醇属有丝分裂抑制剂或纺锤体毒。与长春碱类抑制微管的装配不同,紫杉醇诱导和促进微管的装配。体内外实验显示,紫杉醇诱导和促进微管蛋白聚合、微管装配和微管的稳定化作用,从而导致微管束的异常排列形成星状体,使纺锤体失去正常功能,导致细胞死亡。此外,紫杉醇类还作用于巨噬细胞上的肿瘤坏死因子,促使释放TNF-α、IL-1、IL-2、IL-6、INF-α、INF-β,抑制或杀伤肿瘤细胞,具有调节免疫的作用。
体外试验证明,紫杉类药物对多种小鼠及人体肿瘤细胞株有细胞毒作用。另外,在克隆形成试验中,对新切除的肿瘤细胞也有细胞毒作用。在细胞内浓度高且潴留时间长,对过度表达P-糖蛋白(由多药耐药基因编码)的许多肿瘤细胞株具有活性。体外试验中,本类药抗瘤谱广,对晚期小鼠和人移植性肿瘤均具有抗肿瘤活性。实验研究表明诱导对紫杉醇耐药需要使微管蛋白的二聚体α和β微管蛋白失活。所以对顺铂、多柔比星耐药的癌细胞也有效。临床上对抗铂类的卵巢癌有效率仍达30%~36%,对铂类敏感者则为41%~50%。多西紫杉醇在敏感细胞中抑制微管解聚的作用为紫杉醇的2倍。在动物和人癌细胞株中本药的杀伤作用为紫杉醇的1.3~12倍。
【不良反应】
国产紫杉醇的主要毒性反应为消化道反应,肌肉酸痛,无力,脱发及骨髓抑制。消化道副作用主要为食欲减退及恶心呕吐,少数病人出现腹泻及口腔炎。肌肉酸痛、无力是紫杉醇较常见的副作用。少数病人有指趾麻木。过敏反应一般较轻,主要表现为面部潮红,个别病例有皮疹、发热。紫杉醇对骨髓的抑制作用较明显,主要表现为白细胞及血小板减少。少数病人可有一过性转氨酶升高。脱发是紫杉醇较常见的副作用,少数病人会有毛囊炎。
①过敏反应:发生率为40%,主要表现为支气管痉挛性呼吸困难、低血压、血管神经性水肿、全身荨麻疹。通常发生在用药后最初的 10 min内,为剂量非依赖性反应。
② 骨髓抑制:为主要的剂量限制性毒性,主要是中性粒细胞减少,延长PTX的输注时间可增加骨髓毒性。
③神经毒性:周围神经毒性发生率约60%,表现为指、趾末端麻木及感觉异常,每周给药方案可减轻神经毒性。
④骨关节和肌肉疼痛:发生率为35%,一般较轻。
⑤心血管毒性:主要为低血压、心动过缓及心电图异常。
⑥肝脏毒性:与剂量有关,表现为胆红素、AST、 ALT、AKP升高。
⑦胃肠道反应、脱发等。
【注意事项】
1,化疗期间密切观察呼吸、心率、血压,发现异常及时处理;
2,经常进行常规外周血液检查;
3,为减少体液潴留的发生率及严重程度以及过敏反应的严重程度,每次治疗前应给肾上腺皮质激素、苯海拉明和H2受体拮抗药物;
4,可用5%葡萄糖或生理盐水稀释,应在玻璃容器中配制和储藏稀释液,24小时内完成输注。
5,对本品或其他用聚氧乙基代蓖麻油配制的药物有过敏反应者和孕妇禁用,中性粒细胞数小于1.5×109/L患者禁用。
6,用药期间应按要求检查血象,每周2~3次。
7,本品溶入50g/L葡萄糖注射液或生理盐水后,在室温(25℃)和室内灯光下24h内稳定。
(1) 哺乳期妇女若使用本品,必须中止哺乳。
(2) 用紫杉醇的上升剂量(110~200mg/m2)和顺铂(50或75mg/m2)给予序贯式的滴注,在先予顺铂之后再使用本品比相反顺序 (本品先于顺铂) 时骨髓抑制更为严重,故一般应按紫杉醇-顺铂的顺序用药。
(3) 在服用酮康唑的患者中,本品的代谢可能受到抑制,因此,同时接受酮康唑的患者,使用本品应注意。
【禁忌证】
对紫杉醇惑其他用Cremophor EL(聚氧乙基代蒽麻油) 配制的药物有过敏反应病史者禁用,也禁用于中性粒细胞基数小于1.5×109/L的患者和孕妇。
【网络相关知识介绍】
紫杉醇是从天然植物红豆杉属树皮中提取的单体双萜类化合物,是一种复杂的次生代谢产物, 也是目前所了解的惟一一种可以促进微管聚合和稳定已聚合微管的药物。同位素示踪表明, 紫杉醇只结合到聚合的微管上, 不与未聚合的微管蛋白二聚体反应。细胞接触紫杉醇后会在细胞内积累大量的微管,这些微管的积累干扰了细胞的各种功能,特别是使细胞分裂停止于有丝分裂期,阻断了细胞的正常分裂。 通过Ⅱ-Ⅲ临床研究,紫杉醇主要适用于卵巢癌和乳腺癌,对肺癌、大肠癌、黑色素瘤、头颈部癌、淋巴瘤、脑瘤也都有一定疗效。
作为抗癌药物,紫杉醇的分子结构非常复杂,有11个立体中心和一个17碳的四环骨架结构,因此对紫杉醇分子的全合成和半合成引起世界上许多有机合成小组的兴趣。1992年为止共有30多个研究组参与到紫杉醇的合成中,这在有机合成史上实属罕见。1989年,佛罗里达州立大学的Robert A. Holton以可以从欧洲紫杉Taxus baccata中大量提取的10-脱乙酰基巴卡丁为起始原料,完成了紫杉醇的半合成。1994年,Holton又完成了紫杉醇的首次全合成。在这之后,Nicolaou (1994)、Danishefsky (1996)、Wender (1997)、Kuwajima (1998)、Mukaiyama (1998)等五个小组又相继完成了紫杉醇的全合成,各自采取了不同的合成策略。
【参考资料】
蒋锦良,张士灵,季大洪 主编.常用新药手册.济南:山东科学技术出版社
http://www.chemicalbook.com/ProductChemicalPropertiesCB3273425.htm
http://baike.baidu.com/view/25454.htm
中国医学科学院药物研究所 编著;宋振玉 主编.中草药现代研究·第三卷
王金萍 主编.肿瘤科临床药物手册.南京:江苏科学技术出版社.2008.
http://zh.wikipedia.org/wiki/%E7%B4%AB%E6%9D%89%E9%86%87
