硫化氢俗称“臭蛋气”,为硫的氢化物,一种无色、具有腐败臭蛋样气味的剧毒气体,由含硫物质分解而来,属于常见的酸性有害气体的一种。硫化氢能与多种离子起化学作用,生成不溶于水的硫化物,能使铜、银表面变黑。广泛存在于金属冶炼、天然气 、盐酸和硫酸等的制造工业中。在制造硫酸盐纸浆、人造丝、人造棉、橡胶、二硫化碳等各种硫化物时,常有硫化氢气体排出。在一些化学反应中,含硫化合物不稳定也会分解出硫化氢,如:炼焦、精制石油及金属冶炼中,硫化氢作为一种常规废气,极易泄漏到空气中。
理化性质
化学式H2S,式量34.08,无色有臭鸡蛋气味的刺激性气体,有毒。分子结构与水相似,呈V形,有极性。密度1.539g/L,熔点-85.5℃,沸点-60.7℃。能溶于水,水溶液叫氢硫酸,水溶液不稳定,可很快被空气氧化析出混浊的硫,还能溶于乙醇和甘油。硫化氢化学性质不稳定,加热时会分解为氢和硫。完全干燥的硫化氢常温下不与空气中氧气反应,点火时可燃烧、有蓝色火焰。空气充足时生成二氧化硫和水,若空气不足或温度较低时生成单质硫和水。硫化氢中的硫易于给出电子,是一种很好的还原剂,能使银、铜制品表面变黑,生成金属硫化物。硫化氢有较强的还原性,跟二氧化硫反应生成硫和水,跟浓硫酸反应生二氧化硫和硫,跟氯气反应生成硫和氯化氢,跟三价铁盐溶液生成二价铁盐和硫,使硝酸还原为二氧化氮,使I2还原为I-,使MnO-4还原为Mn2+,反应中H2S通常被氧化为S,若氧化剂氧化性较强并过量时,H2S还可能被氧化成H2SO4。硫化氢能使银、铜等制品表面变黑。与许多金属离子作用,生成不溶于水或酸的硫化物沉淀。在实验室中常用于分离、鉴定金属离子,精制盐酸,制备单质硫。硫化氢在实验室中多用硫化亚铁与稀盐酸作用来制取。氢与硫只在高温下才能生成硫化氢。
硫化氢主要通过呼吸道吸入引起中毒,对粘膜有明显刺激作用,经呼吸道和消化道很快吸收。进入体内后,能与组织细胞内钠离子形成硫化钠,它是一种神经毒,抑制细胞呼吸酶的活性,阻碍机体氧化反应,引起细胞内窒息,造成中枢神经麻痹以至死亡。其毒性无累积作用,少量能从呼吸道排出,大部分可氧化成为无毒的硫酸盐、硫代硫酸盐,也有部分生成硫化物从肾脏及肠道排出。空气中最高允许浓度为10毫克/米3。低浓度(200~300毫克/米3)硫化氢对人员的眼、鼻、咽及支气管有刺激作用,使人产生头痛、乏力、失明、胸闷、咳嗽等症状。中等浓度(700毫克/米3)硫化氢,可使人产生紫绀、心悸、痉挛、意识模糊、昏迷、支气管炎、肺水肿等症状,中毒严重时引起人员死亡。防护硫化氢,应配戴隔绝式氧气面具。人员硫化氢中毒,须迅速将中毒者移到空气新鲜处休息、保暖,确保呼吸道通畅。眼睛受刺激时,可先用清水或2%碳酸氢钠溶液冲洗,再用4%硼酸水溶液冲洗,并滴入无菌橄榄油。中毒严重时,应采取吸氧、人工呼吸、注射呼吸兴奋剂等措施或送医院治疗。解毒药剂主要有:细胞色素C、美兰溶液等。硫化氢钢瓶贮存时,应避开强氧化剂及硝酸,可置于室外或单独存放,室内存放时,应将其置于凉爽、通风处。
分子结构
中心原子S原子采取sp3杂化(实际按照键角计算的结果则接近于p3杂化),电子对构型为正四面体形,分子构型为V形,H—S—H键角为92.1°,偶极矩0.97 D ,是极性分子。由于H—S键能较弱,300℃左右硫化氢分解。
硫化氢污染
大气中的硫化氢主要来自工业生产和蛋白质腐败。硫化氢能刺激眼和呼吸器官,能使氧化型细胞色素酶失去活性,并有直接抑制呼吸中枢等作用,引起急性和慢性中毒。事故排放时,可造成急性中毒事件。
【污染来源】
大气中硫化氢主要来自天然气净化、炼焦、石油精炼、人造丝生产、造纸、橡胶、染料、制药等工业生产过程。天然的来源有火山喷气、细菌作用下动植物蛋白质腐败和硫酸盐的还原等。一些天然气气田和地热区的空气中也含有相当浓度的硫化氢。硫化氢燃烧时生成二氧化硫,空气中的硫化氢也能氧化成二氧化硫,因而增加大气中二氧化硫的浓度。
【硫化氢中毒】
硫化氢经呼吸道吸入,误服硫化物盐类可经胃酸作用产生硫化氢被胃肠道吸收。硫化氢经肝内氧化或甲基化解毒,以结合或游离硫酸盐形式由肾脏排出。硫化氢对人体有剧毒。低浓度下主要是对眼和呼吸道黏膜的刺激作用,可引起化学性炎症和肺水肿。高浓度下表现对中枢神经系统和全身的毒性作用,硫化氢与酶的碱金属离子和含巯基的蛋白质有很强的亲和力,导致细胞色素氧化酶、琥珀酸脱氢酶、三磷酸腺苷酶的活性抑制和还原型谷胱甘肽的耗竭,阻断了细胞内呼吸和生物氧化过程,使细胞缺氧。缺氧迅速导致脑和心肌损害,并加重了化学性肺炎和肺水肿。部分硫化氢还可与血红蛋白结合生成硫化高铁血红蛋白,降低血液携氧能力。极高浓度的硫化氢可直接刺激颈动脉感受器,反射性地抑制呼吸中枢,导致突然呼吸停止。
【临床表现】
一、接触低浓度硫化氢气体,闻及腐臭味、眼部灼热、刺痛。重者畏光、视力模糊、流泪眼睑痉挛、结膜充血、疼痛,可形成角膜炎。伴咽痒、咳嗽、胸闷、恶心、呕吐、头痛。
二、吸入高浓度硫化氢,迅速感头晕、心悸、四肢无力,很少有力量撤离污染环境;继而出现躁动不安、谵妄、惊厥、迅速昏迷。严重者因呼吸麻痹而窒息。清醒后,先出现兴奋症状随即转变为抑郁状态:头痛、头晕、嗜睡、心情烦闷、懒散无力;面部充血、四肢无力、皮肤发绀。
三、迅速吸入极高浓度硫化氢,发生“电击样中毒”,立即昏倒,迅速死亡。
四、急性中毒症状消失后,部分患者出现后遗症:①神经症综合征:头晕、头痛、失眠、健忘、易激惹;②精神症状:心情抑郁、不愿与人交谈、甚至绝望、自杀;③植物神经功能紊乱:皮肤潮红、多汗、心悸;④前庭功能障碍:步态蹒跚、身体偏倚、闭目难立;⑤多发性神经炎、震颤、感觉障碍、疼痛等。
五、慢性硫化氢中毒,出现四肢厥冷、紫绀多汗、皮肤划痕征、多发性神经炎等。
【现场急救】
立即脱去被污染的衣物,用大量流动清水彻底冲洗皮肤;迅速移至空气新鲜处,保持呼吸道通畅,防止受凉;密切观察其呼吸和意识状态,呼吸困难者给予吸氧,有条件可应用高压氧治疗,呼吸、心跳停止者立即施行人工呼吸(勿用口对口呼吸)、胸外心脏按压等心肺复苏。中、重度中毒者一次肌注4-二甲基氨基苯酚,也可静注亚硝酸钠。同时,注意防止脑水肿和肺水肿发生。目前对急性严重中毒者较好的解毒药物为4-二甲基氨基苯酚(一般1支即可),以防高铁血红蛋白症加重病人缺氧。
眼睛受硫化氢污染时,应立即拉下眼睑,用清水或碳酸氢钠溶液从眼眶上部流经眼球 (避免直接冲洗),反复冲洗至少10分钟,再用硼酸溶液洗眼并滴入无菌橄榄油,防止角膜炎可用醋酸可的松滴眼。
【硫化氢中毒机制、危害和机理】
吸入的硫化氢气体会转入血液中,使细胞色素氧化酶钝化而发生中毒。硫化氢的嗅阈为0.012~0.03mg/m3,它远低于引起危害的最低浓度。当空气中硫化氢浓度为1.4mg/m3(0.1ppm)时,即能嗅到臭味。当浓度超过10mg/m3时,浓度继续增高,臭感觉反而减弱。在硫化氢浓度高或持续存在时,很快引起嗅觉麻痹或疲劳而使人不再察觉它的存在,所以不能以臭味强弱作为判断有无危险的依据。 人的嗅觉最低值为0.0005~0.025ppm,明确感知值为0.06ppm,>20ppm时出现结膜和角膜伤害,并对鼻、眼、上呼吸道有灼痛,400~700ppm引起肺水肿和有生命危险,>700ppm则呼吸中枢麻痹和猝死。急性毒性:大鼠吸入半数致死浓度713ppm·1小时。我国规定的容许浓度为10ppm (15mg/m3)。它对植物的毒性较弱。灵敏品种有荞麦、翠菊、黄瓜、番茄和小萝卜,在20~40ppm暴露5小时,中度抗性的唐菖蒲在60~80ppm · 5小时可见到伤害。高抗性的有石竹属、草莓和桃等。它还是重要的恶臭物质,污染来源为粪尿处理场、畜禽舍、食品加工厂等地。日本规定恶臭的控制标准为0.02~0.2ppm。
硫化氢进入血液分布至全身,与细胞内线粒体中的细胞色素氧化酶结合,使其失去传递电子的能力,造成细胞缺氧;还可能与体内谷胱甘肽中的巯基结合,使谷胱甘肽失活,影响生物氧化过程,加重组织缺氧,发生弥漫性中毒性心肌病。高浓度硫化氢主要通过对嗅神经、呼吸道及颈动脉窦和主动脉体的化学感受器直接刺激,传入中枢神经系统,使其由兴奋迅即转入抑制,发生呼吸麻痹,以至引起“电击样死亡”。硫化氢易溶于粘膜表面的水分中,与钠离子结合成硫化钠,对粘膜有强烈的刺激作用,可引起眼炎和呼吸道炎症,甚至肺水肿。进入肺泡内的硫化氢很快被吸收入血液,一部分被氧化成无毒的硫酸盐、硫代硫酸盐随尿和粪便排出。未被氧化的部分,进入组织细胞,与细胞色素氧化酶及这一类酶的二硫键作用或与三价铁结合,抑制细胞氧化过程,造成组织缺氧,引起全身中毒反应。高浓度硫化氢可直接抑制呼吸中枢,引起窒息而发生迅速死亡。急性中毒后遗症是头痛与智力降低。慢性中毒表现为眼球酸痛、有烧灼感、肿胀畏光、气管炎症状、头痛、头晕、倦怠无力、心动过缓、恶心等。
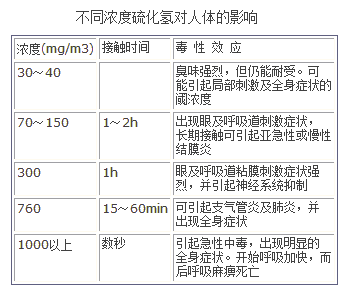
图1:不同浓度硫化氢对人体的影响。
【防治措施】
为了防止硫化氢的污染,应改革工艺,尽量减少或消除硫化氢的排放。处理废气、废水,如用氯化钙或硫酸铁和石灰的混合液处理含硫化氢废水。含硫化钠的废水应严格防止与酸接触,以免放出硫化氢。要防止事故排放造成急性中毒事件。地热的开发利用,也应注意防止硫化氢的危害。我国《工业企业设计卫生标准》中居住区大气中有害物质的最高容许浓度规定硫化氢的一次最高容许浓度为0.01mg/m2。
含硫化氢废气净化
含硫化氢废气主要来自天然气净化、原油精炼、硫化染料的制造、制革工业的皮毛处理、化学和制药工业中硫化物和酸的化合以及某些有色金属冶炼等过程。硫化氢不仅对人体有害,对农作物和建筑物也会有损害,故含硫化氢废气在排放前应加以净化处理。常用的净化处理方法有干法与湿法两大类。
【干法净化】
(1)氧化铁法:是以活性氧化铁加入木粉、熔炉矿渣作吸收剂,吸收硫化氢,回收的副产物为硫磺,其吸收再生的基本反应为:
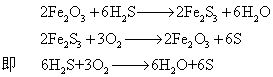
影响反应的主要因素为温度、含湿量与净化剂的pH值。
(2) 吸附法:是以活性炭等作吸附剂,活性炭在常温下具有加速硫化氢氧化的作用。其主要反应为:2H2S+O2→2H2O+2S。在活性炭上沉积的硫,可用适当的溶剂(硫化铵)萃取加以回收,活性炭则可再用,直至炭粒大量磨细为止。活性炭法的显著优点是操作简单、净化效率较高。主要缺点是当废气中含有的微细尘粒物沉积在炭表面上时,炭的活性大大降低,故在废气处理前必须除去尘粒物质。此外,该法不宜用于含焦油的气体。
【湿法(吸收)净化】
(1) 中和法:用喷淋塔、筛板塔、填料塔等吸收设备净化含硫化氢废气所采用的吸收液有Na2CO3水溶液(2~3%)、磷酸钾水溶液(30%)及乙醇胺水溶液等。工业上很早以来就采用乙醇胺类作为硫化氢气体的吸收剂。一乙醇胺 (MEA)与二乙醇胺是废气净化中最主要的两种胺类,一乙醇胺的价格低、反应能力强,稳定性好,而且容易从沾污的溶液中回收。利用一乙醇胺的水溶液吸收H2S时,所发生的化学反应如下:
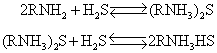
胺溶液的浓度可以任意选择,低浓度的胺溶液对钢制设备的腐蚀性较小,根据实际操作经验,一般使用浓度为15~20%。反应形成复合物,富液加热到100~130℃,硫化氢被解析出来,经冷凝可得到高浓度H2S,进一步制成硫磺。操作时,胺溶液应有足够的循环量,如果溶液量较少,操作时由于反应热使温度大大升高,结果使溶液上被吸收气体的蒸气压增大,而使反应不易进行。溶液再生后经换热器冷却继续使用,工艺流程见图。
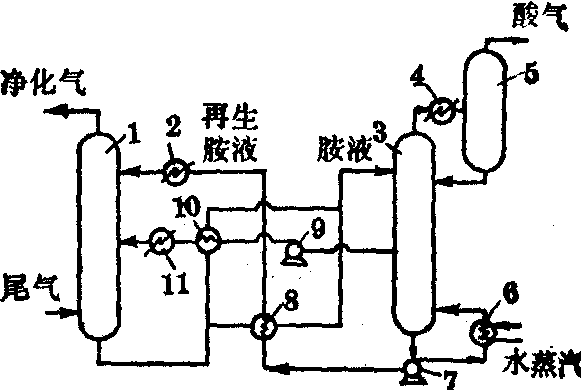
乙醇胺吸收H2S工艺流程
1.吸收塔 2,11.水冷却器 3.气提塔 4.冷凝器 5.酸气分离塔 6.再煮锅 7,9.喷淋泵 8,10.胺的热交换器
(2) 氧化法:硫化氢用碱性吸收液吸收后,在催化剂作用下进一步氧化成硫磺。可用的吸收液有悬浊Fe2O3的Na2CO水溶液、砷化合物和Na2CO3水溶液以及添加苦味酸于Na2CO3或NH3的水溶液等。采用的一实例是硫代砷酸盐溶液法(砷碱法),该法的主要化学反应是在吸收时硫代砷酸盐分子中的一个氧原子被硫原子所取代,而在再生时则反之。其反应可用下式表示:

湿法净化的优点是能够连续运转,占地面积小,净化效率较高,采用单级吸收塔可脱除95%的硫化氢,而在二级吸收系统中,可使净化效率提高至99%左右。它的主要缺点是碱耗量大。
现场应急监测方法
①便携式气体检测仪器:硫化氢库仑检测仪、硫化氢气敏电极检测仪。
②常用快速化学分析方法:醋酸铅检测管法、醋酸铅指示纸法《突发性环境污染事故应急监测与处理处置技术》万本太主编 气体速测管(北京劳保所产品、德国德尔格公司产品)。
实验室监测方法
监测方法 来源 类别
气相色谱法 GB/T14678-93 空气
碘量法 GB/T11601.1-1998 天然气
亚甲蓝法 GB/T11601.2-1998 天然气
亚甲基蓝分光光度法 《空气中有害物质的测定方法》(第二版),杭世平编 空气
环境标准
中国(TJ36-79) 车间空气中有害物质的最高容许浓度:10毫克/立方米
中国(TJ36-79) 居住区大气中有害物质的最高容许浓度:0.01毫克/立方米(一次值)
中国(GB14554-93) 恶臭污染物厂界标准(毫克/立方米):一级0.03;二级0.06~0.10;三级0.32~0.60
中国(GB14554-93) 恶臭污染物排放标准:0.33~21kg/h
参考资料
中国医学百科全书编辑委员会 编;蔡宏道 主编.中国医学百科全书·五 环境卫生学。
沈鑫甫等 编.中学教师实用化学辞典.北京:北京科学技术出版社.2002.第190-191页。
http://www.chemicalbook.com/ProductChemicalPropertiesCB0122872.htm
http://baike.baidu.com/view/149186.htm
