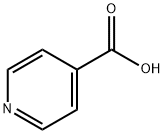
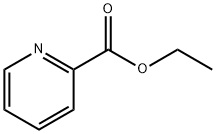
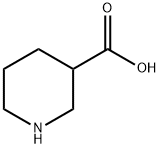
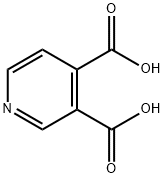
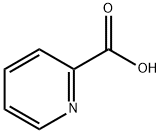
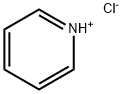
ピリジン化合物
ピリジン系化合物は現在開発と応用範囲が最も広い複素環式化合物の一種であり,重要な精細化学原料の一種であり,その誘導体は主にアルキルピリジン、ハロゲン化ピリジン、アミノピリジン、ブロモピリジン、メチルピリジン、ヨードピリジン、クロロピリジン、ニトロピリジン、ヒドロキシピリジン、ベンジルピリジン、エチルピリジン、シアノピリジン、フルピルチン、及びジヒドロピリジン等を有し,そのうち農薬はピリジン系製品の消費総量の約50%を占める;飼料添加物は約30%を占める;医薬及び他の分野の製品は20%を占める。 ピリジンは弱塩基性と特殊な臭いを有する無色又はわずかな黄色の液体であり,コールタール、シェールオイル、石炭ガス及び石油に天然に存在する。水、アルコール、エーテル、石油エーテル、油類、ベンゼン、クロロホルム等の多くの有機溶剤と融合でき,重要な化学原料と溶剤である。 ピリジンの重要な誘導体はニコチン酸、ニコチン酸アミド、 イソニコチニルヒドラジド、ニコチン、ブルシン、及びビタミンB6等を有する。 ピリジンは正六角形に近い構造を有し,ベンゼンと類似し,同じ電子構造を有する。環中の窒素原子の電子吸引作用で,2,4,6位における電子雲の密度を3,5位以下にさせ,酸性媒質中で,親電子置換反応は3,5位で発生し,求核反応例えばアミン化、アルキル化、アリール化、アシル化は2,4,6位で発生する。ピリジンは弱い第三級アミンの一種であり,エタノール溶液中で複数の酸性物質(例えばピクリン酸、過塩素酸等)とともに水に溶けない塩基性物質を形成する。ピリジンは塩基性であるため,塩酸と反応してピリジン塩酸塩(C5H5N•HCl)を生成することができる。ニッケル触媒の作用で,200℃及び15~30MPaの環境で,水素を添加して還元反応を行い,ピペリジンを生成することができる;電気分解によってピペリジンに還元することもできる。その還元性はベンゼンより簡単である。その一方でピリジンはベンゼンより酸化しにくいが,過酸化水素又は過酢酸を利用してピリジンを酸化させてN-酸化ピリジンを生成でき,これは一つの重要なピリジン誘導体であり,窒素原子が酸化された後に,正電荷を帯びるピリジンイオンを生成できないため,アリール基の親電子置換反応に役立つ。ピリジンの求電子置換反応例えばニトロ化、スルホン化、ハロゲン化はいずれも発生しにくいが,ハロゲン化はその前の両者よりわずかに簡単であり,200℃以上で,3,5-ジクロロピリジン、又は3,4.5-トリクロサンピリジンを取得できる。ピリジンは複数の金属イオンとともに結晶性錯化合物を形成することができる。
- Structure:
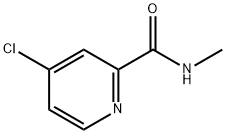
- Chemical Name:N-メチル-4-クロロ-2-ピリジンカルボキシアミド 塩化物
- CAS:220000-87-3
- MF:C7H7ClN2O
- Structure:
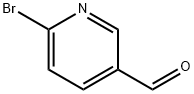
- Chemical Name:2-ブロモ-5-ピリジンカルボキシアルデヒド 臭化物
- CAS:149806-06-4
- MF:C6H4BrNO
- Structure:
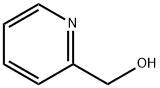
- Chemical Name:2-ピリジンメタノール
- CAS:586-98-1
- MF:C6H7NO
- Structure:
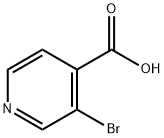
- Chemical Name:3-ブロモピリジン-4-カルボン酸
- CAS:13959-02-9
- MF:C6H4BrNO2
- Structure:
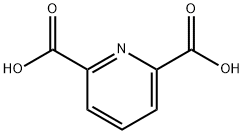
- Chemical Name:2,6-ピリジンジカルボン酸
- CAS:499-83-2
- MF:C7H5NO4
- Structure:
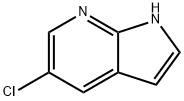
- Chemical Name:5-クロロ-7-アザインドール 塩化物
- CAS:866546-07-8
- MF:C7H5ClN2
- Structure:
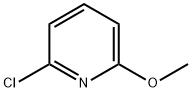
- Chemical Name:2-クロロ-6-メトキシピリジン
- CAS:17228-64-7
- MF:C6H6ClNO
- Structure:
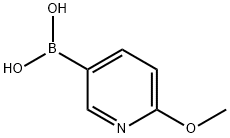
- Chemical Name:6-メトキシピリジン-3-ボロン酸
- CAS:163105-89-3
- MF:C6H8BNO3
- Structure:
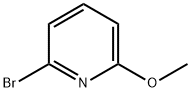
- Chemical Name:2-ブロモ-6-メトキシピリジン 臭化物
- CAS:40473-07-2
- MF:C6H6BrNO
- Structure:
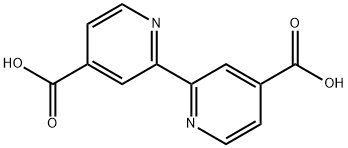
- Chemical Name:2,2'-ビピリジン-4,4'-ジカルボン酸
- CAS:6813-38-3
- MF:C12H8N2O4
- Structure:
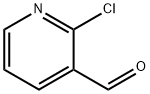
- Chemical Name:2-クロロ-3-ピリジンカルボキシアルデヒド 塩化物
- CAS:36404-88-3
- MF:C6H4ClNO
- Structure:
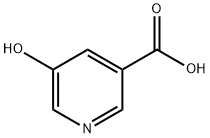
- Chemical Name:5-ヒドロキシニコチン酸
- CAS:27828-71-3
- MF:C6H5NO3
- Structure:
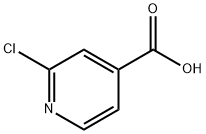
- Chemical Name:2-クロロイソニコチン酸
- CAS:6313-54-8
- MF:C6H4ClNO2
- Structure:
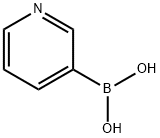
- Chemical Name:3-ピリジルボロン酸
- CAS:1692-25-7
- MF:C5H6BNO2
- Structure:
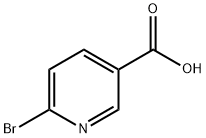
- Chemical Name:6-ブロモニコチン酸
- CAS:6311-35-9
- MF:C6H4BrNO2
- Structure:
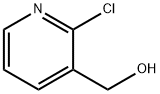
- Chemical Name:2-クロロ-3-ピリジンメタノール
- CAS:42330-59-6
- MF:C6H6ClNO
- Structure:
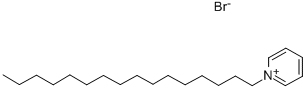
- Chemical Name:ヘキサデシルピリジニウムブロミド水和物
- CAS:140-72-7
- MF:C21H38BrN
- Structure:
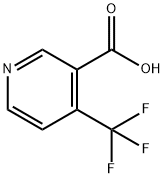
- Chemical Name:4-(トリフルオロメチル)ニコチン酸
- CAS:158063-66-2
- MF:C7H4F3NO2
- Structure:
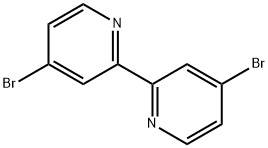
- Chemical Name:4,4'-ジブロモ-2,2'-ビピリジル
- CAS:18511-71-2
- MF:C10H6Br2N2
- Structure:
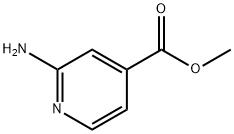
- Chemical Name:2-アミノピリジン-4-カルボン酸メチル
- CAS:6937-03-7
- MF:C7H8N2O2
- Structure:
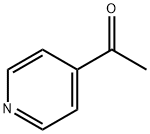
- Chemical Name:4-アセチルピリジン
- CAS:1122-54-9
- MF:C7H7NO
- Structure:
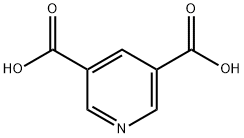
- Chemical Name:3,5-ピリジンジカルボン酸
- CAS:499-81-0
- MF:C7H5NO4
- Structure:
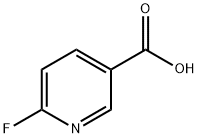
- Chemical Name:6-フルオロニコチン酸
- CAS:403-45-2
- MF:C6H4FNO2
- Structure:
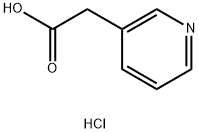
- Chemical Name:3-ピリジル酢酸塩酸塩
- CAS:6419-36-9
- MF:C7H8ClNO2
- Structure:
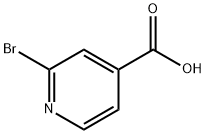
- Chemical Name:2-ブロモイソニコチン酸 臭化物
- CAS:66572-56-3
- MF:C6H4BrNO2
- Structure:
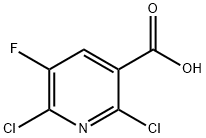
- Chemical Name:2,6-ジクロロ-5-フルオロニコチン酸
- CAS:82671-06-5
- MF:C6H2Cl2FNO2
- Structure:
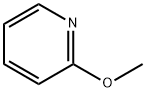
- Chemical Name:2-メトキシピリジン
- CAS:1628-89-3
- MF:C6H7NO
- Structure:
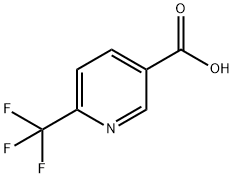
- Chemical Name:6-(トリフルオロメチル)ニコチン酸
- CAS:231291-22-8
- MF:C7H4F3NO2
- Structure:
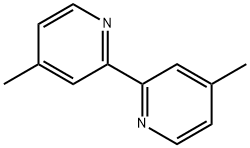
- Chemical Name:2,2'-ビ-4-ピコリン
- CAS:1134-35-6
- MF:C12H12N2
- Structure:
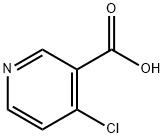
- Chemical Name:4-クロロニコチン酸
- CAS:10177-29-4
- MF:C6H4ClNO2
- Structure:
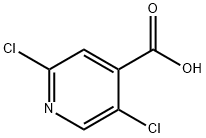
- Chemical Name:2,5-ジクロロイソニコチン酸
- CAS:88912-26-9
- MF:C6H3Cl2NO2
- Structure:
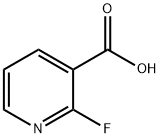
- Chemical Name:2-フルオロ-3-ピリジンカルボン酸
- CAS:393-55-5
- MF:C6H4FNO2
- Structure:
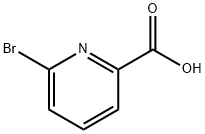
- Chemical Name:6-ブロモピコリン酸
- CAS:21190-87-4
- MF:C6H4BrNO2
- Structure:
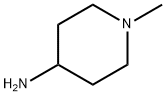
- Chemical Name:4-アミノ-1-メチルピペリジン
- CAS:41838-46-4
- MF:C6H14N2
- Structure:
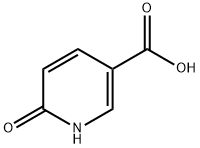
- Chemical Name:6-ヒドロキシニコチン酸
- CAS:5006-66-6
- MF:C6H5NO3
- Structure:
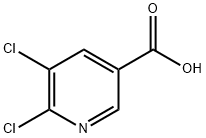
- Chemical Name:5,6-ジクロロニコチン酸
- CAS:41667-95-2
- MF:C6H3Cl2NO2
- Structure:
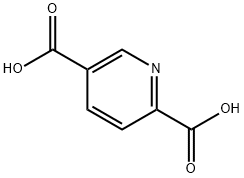
- Chemical Name:2,5-ピリジンジカルボン酸
- CAS:100-26-5
- MF:C7H5NO4
- Structure:
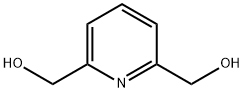
- Chemical Name:2,6-ピリジンジメタノール
- CAS:1195-59-1
- MF:C7H9NO2
- Structure:
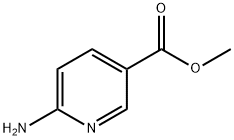
- Chemical Name:6-アミノニコチン酸メチル
- CAS:36052-24-1
- MF:C7H8N2O2
- Structure:
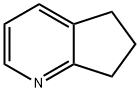
- Chemical Name:6,7-ジヒドロ-5H-シクロペンタ[b]ピリジン
- CAS:533-37-9
- MF:C8H9N
- Structure:
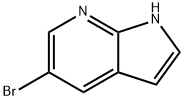
- Chemical Name:5-ブロモ-7-アザインドール 臭化物
- CAS:183208-35-7
- MF:C7H5BrN2
- Structure:
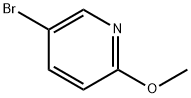
- Chemical Name:5-ブロモ-2-メトキシピリジン
- CAS:13472-85-0
- MF:C6H6BrNO
- Structure:
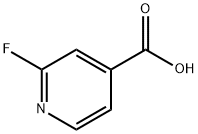
- Chemical Name:2-フルオロイソニコチン酸
- CAS:402-65-3
- MF:C6H4FNO2
- Structure:
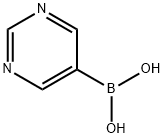
- Chemical Name:5-ピリミジルボロン酸
- CAS:109299-78-7
- MF:C4H5BN2O2
- Structure:
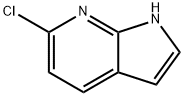
- Chemical Name:6-クロロ-7-アザインドール 塩化物
- CAS:55052-27-2
- MF:C7H5ClN2
- Structure:
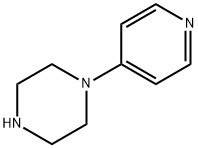
- Chemical Name:4-ピペラジノピリジン
- CAS:1008-91-9
- MF:C9H13N3
- Structure:
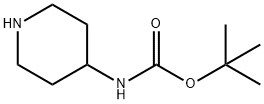
- Chemical Name:4-(tert-ブトキシカルボニルアミノ)ピペリジン
- CAS:73874-95-0
- MF:C10H20N2O2
- Structure:
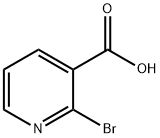
- Chemical Name:2-ブロモニコチン酸
- CAS:35905-85-2
- MF:C6H4BrNO2
- Structure:
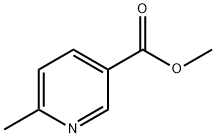
- Chemical Name:6-メチルニコチン酸メチル
- CAS:5470-70-2
- MF:C8H9NO2
- Structure:
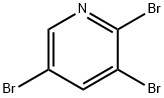
- Chemical Name:2,3,5-トリブロモピリジン
- CAS:75806-85-8
- MF:C5H2Br3N
- Structure:
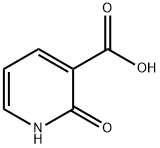
- Chemical Name:2-ヒドロキシニコチン酸
- CAS:609-71-2
- MF:C6H5NO3
- Structure:
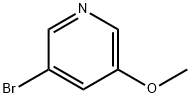
- Chemical Name:3-ブロモ-5-メトキシピリジン 臭化物
- CAS:50720-12-2
- MF:C6H6BrNO
- Structure:
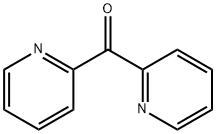
- Chemical Name:ジ-2-ピリジル ケトン
- CAS:19437-26-4
- MF:C11H8N2O
- Structure:
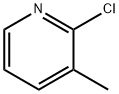
- Chemical Name:2-クロロ-3-ピコリン
- CAS:18368-76-8
- MF:C6H6ClN
- Structure:
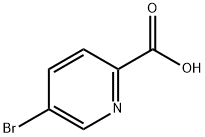
- Chemical Name:5-ブロモピコリン酸
- CAS:30766-11-1
- MF:C6H4BrNO2
- Structure:
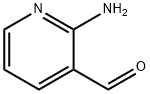
- Chemical Name:2-アミノニコチンアルデヒド
- CAS:7521-41-7
- MF:C6H6N2O
- Structure:
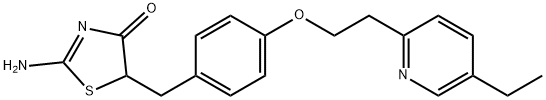
- Chemical Name:2-アミノ-5-[4-[2-(5-エチル-2-ピリジル)エトキシ]ベンジル]チアゾール-4(5H)-オン
- CAS:105355-26-8
- MF:C19H21N3O2S
- Structure:
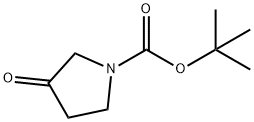
- Chemical Name:1-tert-ブトキシカルボニル-3-ピロリドン
- CAS:101385-93-7
- MF:C9H15NO3
- Structure:
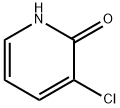
- Chemical Name:3-クロロ-2-ヒドロキシピリジン
- CAS:13466-35-8
- MF:C5H4ClNO
- Structure:
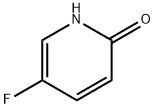
- Chemical Name:5-フルオロ-2-ピリジノール
- CAS:51173-05-8
- MF:C5H4FNO
- Structure:
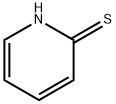
- Chemical Name:2-メルカプトピリジン
- CAS:2637-34-5
- MF:C5H5NS
- Structure:
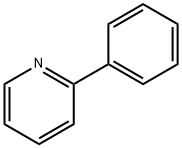
- Chemical Name:2-フェニルピリジン
- CAS:1008-89-5
- MF:C11H9N
- Structure:
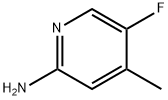
- Chemical Name:2-アミノ-5-フルオロ-4-メチルピリジン
- CAS:301222-66-2
- MF:C6H7FN2
- Structure:
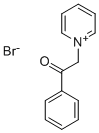
- Chemical Name:1-フェナシルピリジニウムブロミド
- CAS:16883-69-5
- MF:C13H12BrNO
- Structure:
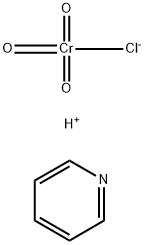
- Chemical Name:クロロクロム酸ピリジニウム
- CAS:26299-14-9
- MF:C5H5N.ClCrO3.H
- Structure:
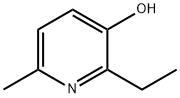
- Chemical Name:2-エチル-6-メチルピリジン-3-オール
- CAS:2364-75-2
- MF:C8H11NO
- Structure:
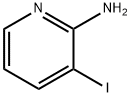
- Chemical Name:2-アミノ-3-ヨードピリジン ヨウ化物
- CAS:104830-06-0
- MF:C5H5IN2
- Structure:
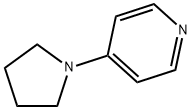
- Chemical Name:4-ピロリジノピリジン
- CAS:2456-81-7
- MF:C9H12N2
- Structure:
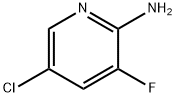
- Chemical Name:2-アミノ-3-フルオロ-5-クロロピリジン
- CAS:246847-98-3
- MF:C5H4ClFN2
- Structure:
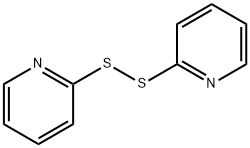
- Chemical Name:2,2'-ジピリジルジスルフィド
- CAS:2127-03-9
- MF:C10H8N2S2
- Structure:
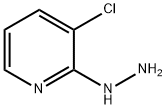
- Chemical Name:(3-CHLORO-PYRIDIN-2-YL)-HYDRAZINE
- CAS:22841-92-5
- MF:C5H6ClN3
- Structure:
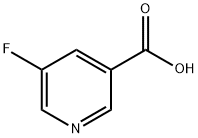
- Chemical Name:5-フルオロニコチン酸
- CAS:402-66-4
- MF:C6H4FNO2
- Structure:
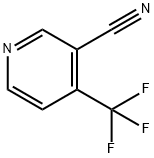
- Chemical Name:4-(トリフルオロメチル)ニコチノニトリル
- CAS:13600-43-6
- MF:C7H3F3N2
- Structure:
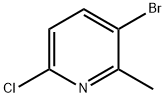
- Chemical Name:3-ブロモ-6-クロロ-2-メチルピリジン
- CAS:132606-40-7
- MF:C6H5BrClN
- Structure:
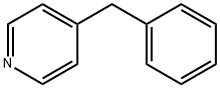
- Chemical Name:4-ベンジルピリジン
- CAS:2116-65-6
- MF:C12H11N
- Structure:
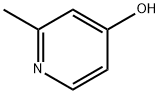
- Chemical Name:4-ヒドロキシ-2-メチルピリジン
- CAS:18615-86-6
- MF:C6H7NO
- Structure:
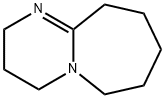
- Chemical Name:1,8-ジアザビシクロ[5.4.0]-7-ウンデセン
- CAS:6674-22-2
- MF:C9H16N2
- Structure:
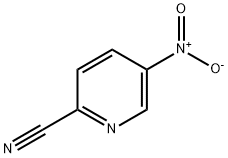
- Chemical Name:2-Cyano-5-nitropyridine
- CAS:100367-55-3
- MF:C6H3N3O2
- Structure:
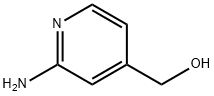
- Chemical Name:2-アミノ-4-ピリジニルメタノール
- CAS:105250-17-7
- MF:C6H8N2O
- Structure:
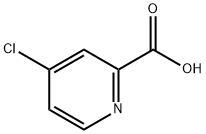
- Chemical Name:4-クロロピコリン酸
- CAS:5470-22-4
- MF:C6H4ClNO2
- Structure:
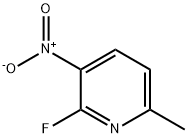
- Chemical Name:6-フルオロ-5-ニトロ-2-ピコリン
- CAS:19346-45-3
- MF:C6H5FN2O2
- Structure:
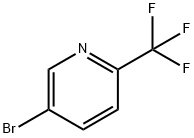
- Chemical Name:5-ブロモ-2-(トリフルオロメチル)ピリジン 臭化物
- CAS:436799-32-5
- MF:C6H3BrF3N
- Structure:
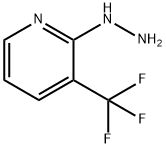
- Chemical Name:3-(トリフルオロメチル)ピリド-2-イルヒドラジン
- CAS:89570-83-2
- MF:C6H6F3N3
- Structure:
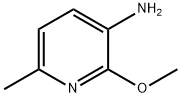
- Chemical Name:3-アミノ-2-メトキシ-6-ピコリン
- CAS:186413-79-6
- MF:C7H10N2O
- Structure:
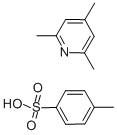
- Chemical Name:2,4,6-トリメチルピリジニウムp-トルエンスルホナート
- CAS:59229-09-3
- MF:C15H19NO3S
- Structure:
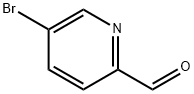
- Chemical Name:5-ブロモ-2-ピリジンカルボキシアルデヒド 臭化物
- CAS:31181-90-5
- MF:C6H4BrNO
- Structure:
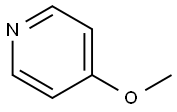
- Chemical Name:4-メトキシピリジン
- CAS:620-08-6
- MF:C6H7NO
- Structure:
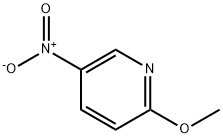
- Chemical Name:2-メトキシ-5-ニトロピリジン
- CAS:5446-92-4
- MF:C6H6N2O3
- Structure:
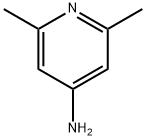
- Chemical Name:2,6-ジメチルピリジン-4-アミン
- CAS:3512-80-9
- MF:C7H10N2
- Structure:
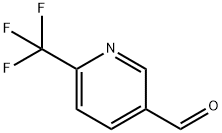
- Chemical Name:6-(トリフルオロメチル)ピリジン-3-カルボキシアルデヒド
- CAS:386704-12-7
- MF:C7H4F3NO
- Structure:
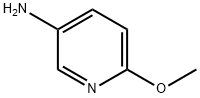
- Chemical Name:5-アミノ-2-メトキシピリジン
- CAS:6628-77-9
- MF:C6H8N2O
- Structure:
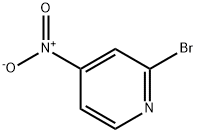
- Chemical Name:2-ブロモ-4-ニトロピリジン
- CAS:6945-67-1
- MF:C5H3BrN2O2
- Structure:
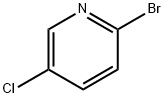
- Chemical Name:2-ブロモ-5-クロロピリジン
- CAS:40473-01-6
- MF:C5H3BrClN
- Structure:

- Chemical Name:5-クロロ-6-ヒドロキシニコチン酸
- CAS:54127-63-8
- MF:C6H4ClNO3