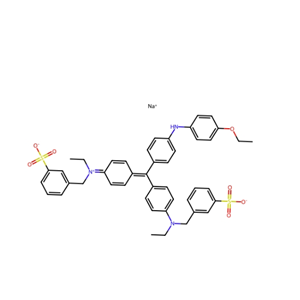
考马斯亮蓝的发现与用途说明
发布日期:2024/1/3 10:15:13
考马斯亮蓝(Coomassie Brilliant Blue)是两种三苯甲烷衍生物染料(G-250和R-250)的统称,起初开发用于纺织行业,但现在通常用于分析生物化学中的蛋白质染色。考马斯亮蓝G-250比考马斯亮蓝R-250多两个甲基。

起名和发现
考马斯这个名字最初在19世纪末被一家设在英国布莱克利(Blackley)的染料公司(Levinstein Ltd.)作为贸易名使用,用来售卖一些酸性羊毛染料。1896年在第四次英国-阿散蒂战争期间, 英国军队占据了考马斯镇(今加纳库马西)。1918年, Levinstein Ltd.公司并入不列颠染料公司(British Deystuffs Cororation) ,后者在1926年成为帝国化学工业的一部分。虽然帝国化学工业公司仍然持有考马斯这种商标,可是他们没有再生产这种染料。
这些蓝色的二磺酸化三苯甲烷的染料首先在1913年由住在德国Elberfeld的Max Weiler生产后来陆续发现了多种有机化学合成这种染料的方法。
目前发表的生化论文中,通常把这些染料统称“考马斯”而不区分具体用的是哪种染料。实际上国际颜色索引列出了超过了四十种名字含有“考马斯”的染料,也有一些其他种类的(非二磺酸化三苯甲烷)的染料,也被叫作“考马斯”蓝。例如默克索引(第10版)列出了具有完全不同的结构的考马斯蓝。
染料的颜色
后缀带R的考马斯亮蓝R-250,R意指红色,这是因为考马斯亮蓝R-250在蓝色中略带有红色;而G型则意指Green,在蓝色中带有一点绿色。250起初是指染料的纯度。
R-250
这两种染料的颜色与溶液的酸堿性有关。考马斯亮蓝G型已经研究得比较详细。在pH低于0的时候,呈现红色,最大吸收峰位于465nm。在pH值约为1时,这种染料呈现绿色,最大吸收峰位于约620nm处。当pH高于2时,这种染料呈现一种亮蓝色,最大吸收峰位于595nm。在pH为7的时候,这种染料的莫耳吸光度是43,000 M−1cm−1。
染料分子呈现不同颜色的原因是分子不同的带电荷状态。在红色形态时,全部三个氮原子均带有正电。两个磺酸基团有相当低的酸度系数,通常会带负电,因而在pH为0左右时,整个染料分子会带1个正电荷。绿色的形态则对应整体不带电荷。而在中性介质(pH7)中,仅有二苯胺官能团上的氮原子带有一个正电荷,所以整个分子带有一个负电荷而呈蓝色。这三个氮原子中前两个失去质子的pKa分别是1.15和1.82。最后一个氮原子在强堿性环境下会失去质子,从而使染料变为粉色(pKa是12.4)
考马斯亮蓝和蛋白质的氨基、羧基基团产生静电作用,而非共价作用。染料分子和蛋白分子包括羊毛(角蛋白)形成一个蛋白质-染料分子复合物。这种复合物的形成,使得染料的带负电荷的形态得到了稳定,从而产生蓝色,即使在多数分子带正电荷的强酸环境下。这是布拉德福蛋白质定量法的理论依据,是一种利用考马斯亮蓝与蛋白质结合的蛋白质测定方法。这种染料与蛋白质的结合,使得考马斯亮蓝的吸收峰从465nm迁移到595nm。记录595nm处吸光度的增加,可以用来测定蛋白质浓度。
这种染料也会与阴离子去垢剂十二烷基硫酸钠形成复合物。这使得染料分子的绿色形态得到稳定。这个效应可以干扰布拉德福蛋白质定量法的测定。阴离子去垢剂也有可能与蛋白质竞争和染料分子结合。
生物化学中的用途
考马斯亮蓝R-250在1964年被Fazekas de St.Groth的团队最先用来观察蛋白。蛋白样品在醋酸纤维素薄膜上进行电泳分离。薄膜随后被放置于5-磺基水杨酸中,使蛋白质条带固定,然后将膜浸到染料溶液中。
两年之后,1965年Meyer和Lambert用考马斯亮蓝R-250去染经聚丙烯酰胺凝胶分离的蛋白质样品。他们将胶浸在含有甲醇乙酸和水的溶液中。由于染料在染色蛋白质的同时也染了聚丙烯酰胺凝胶,为了使蛋白质条带可见,他们对电泳的凝胶进行了脱色。后续的文献报道聚丙烯酰胺凝胶可以被乙酸溶液成功脱色。
在1967年,首次出现使用考马斯亮蓝G让聚丙烯酰胺凝胶中的蛋白条带变得可见的报道,其中染料被溶解在含有甲醇的乙酸溶液中。之后发现,如果使用溶解在不含甲醇的三氯乙酸考马斯亮蓝G胶体,可以使蛋白质条带被染色,而聚丙烯酰胺不被染色。如果用这种方法,就没有必要再对胶进行脱色。现代的手段通常是将考马斯亮蓝G溶解在含有磷酸、乙醇(或甲醇)和硫酸铵(或硫酸铝)的溶液中。
欢迎您浏览更多关于酸性蓝 83的相关新闻资讯信息