亚硝酸的制备
发布日期:2023/11/29 15:15:24
介绍
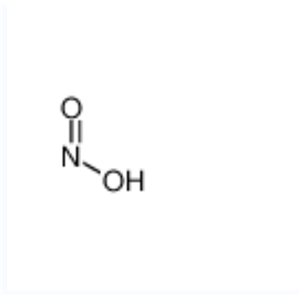
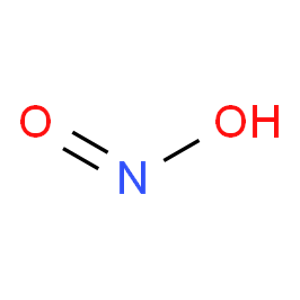
亚硝酸是一种弱酸,电离平衡常数Ka=5.1×10‑4(298K)。HNO2中的氮处于中间价态,既具有氧化性又具有还原性。HNO2仅存在于稀的水溶液中,浓缩HNO2稀溶液时,HNO2会同时发生歧化和分解反应,生成歧化产物硝酸、NO以及分解产物三氧化二氮,同时三氧化二氮又迅速分解为NO和NO2;HNO2见光也会分解。因此,使用HNO2作为反应物时,应使HNO2的制备和使用同时进行,从而减少HNO2的歧化和分解副反应。

亚硝酸
应用
亚硝酸广泛用于有机合成,在工业上主要作为胺类转变成重氮化合物的反应原料,因此研发生产成本低、过程安全、环保的HNO2制备方法具有重要的应用价值。
合成
现有工艺及存在的问题
现有亚硝酸制备工艺主要是亚硝酸盐与无机酸反应制备HNO2或氮氧化物与水反应制备HNO2,得到HNO2水溶液。
(1)亚硝酸盐与无机酸反应制备HNO2工艺
在HNO2盐溶液中加入无机酸,可得到HNO2的溶液。HNO2盐中最具代表性的是HNO2钠,主要用于有机染料。亚硝酸钠可作为生产有机染料的原料其本质是利用亚硝酸钠与无机酸反应可生成用HNO2。HNO2钠易潮解,易溶于水,其水溶液呈碱性,pH约为9;微溶于乙醇、甲醇、乙醚等有机溶剂。采用该方法制备HNO2所使用的原料HNO2盐具有纯度高、反应物的保存及运输方便等优点,但该方法主要存在以下问题:
①亚硝酸盐制备过程除了使用NO和NO2外还会消耗碱。亚硝酸盐(以亚硝酸钠为例)是以NaOH水溶液作为吸收液,吸收NO和NO2制得HNO2钠,反应式为:
NO+NO2+2NaOH→2Na NO2+H2O
制备HNO2除了必须要使用NO和NO2外,还需要消耗碱,才能生成亚硝酸钠。
②使用亚硝酸钠制备HNO2消耗无机酸,以盐酸与HNO2反应生成HNO2为例,其反应式为:
Na NO2+HCl→HNO2+NaCl
显然,以亚硝酸盐与无机酸为原料制备HNO2必然消耗无机酸。
③制备HNO2的过程会产生无机盐副产物
采用无机酸与亚硝酸钠反应生成的HNO2的方法,必然会生成难处理的无机盐。无机盐的存在给后续的分离精制及废物处理带来困难,不仅使工艺流程复杂化,而且也降低了过程的原子利用率及经济效益。
(2)氮氧化物与水反应制备HNO2工艺
理论上,NO、NO2和水反应可以生成HNO2。因此,将NO和NO2混合物溶解于水中,即生成HNO2的水溶液,反应式为:
NO2+NO+H2O→2HNO2
该方法的原料为NO、NO2和H2O,从根本上解决了HNO2盐与酸反应制备HNO2的缺点。虽然从原理上分析,NO和NO2混合溶于水就能够形成HNO2,但由于NO和NO2在水中的溶解度与其反应速率之间存在差异,亦即NO在水中的溶解度比较小,而且与水不发生反应;而NO2易溶于水,与水反应生成硝酸和NO。显然,采用NO与NO2混合后直接与水反应生成HNO2存在反应的转化率低、有副反应发生等突出问题。因此,研发以氮氧化物作为前驱体制备HNO2的新技术不仅具有显著的经济效益,而且也具有显著的环境和社会效益。
新合成方法
针对现有的以NO、NO2和水为原料制备HNO2过程存在的技术问题,王大为[1]提供一种气‑液分散混合效率高、反应速率快、副产物少、能量消耗低、安全性好的制备亚硝酸的新方法。首先采用气‑水分散混合技术将NO分散于水中制得预混合物料,然后将此气‑水预混合物料再与NO2混合,反应生成亚硝酸。
具体步骤为(1)气‑液分散混合:在静态混合器中,操作温度为0℃,体系的绝对压强为0.6MPa,将NO与水的摩尔比为1.0:100的物料进行气‑液分散混合,经气‑液分散混合物料进入下一步;
(2)亚硝酸制备:在静态混合器中,操作温度为0℃,体系的绝对压强为0.6MPa,上一步得到的气‑液分散混合物料吸收NO2,NO2的吸收量与第一步中NO吸收量的摩尔比为1.0:1.02,NO、NO2和水发生反应制得亚硝酸。制得的HNO2水溶液直接作为苯胺重氮化反应的原料,与苯胺、盐酸组成的溶液混合,经重氮化反应生成重氮苯盐酸盐。
该方法存在的优点是:
(1)采用了高效的气‑液分散混合设备,通过强化NO与H2O的预混合,然后再与NO2在水溶液中混合,不但提高了分散混合过程的速率和效率,同时也显著提高了反应生成亚硝酸过程的选择性。
(2)采用高效的气‑液混合设备作为制备亚硝酸的反应器,由于强化了NO2在水中的分散混合特性,从而提高了反应过程的速率。
(3)该方法制得的HNO2可以直接应用于重氮化反应过程,并能使NO、NO2和H2O的反应向生成HNO2的方向进行。相对HNO2而言,一般的重氮化反应产物相对比较稳定,HNO2与伯芳胺的反应是放热、不可逆的快反应过程。虽然制得的亚硝酸稳定性较差,但由于制得的HNO2在重氮化反应生成重氮化合物的过程中能够迅速反应消耗掉,使得HNO2在反应系统中的浓度比较低,从而降低了HNO2的分解,有利于NO、NO2和H2O的反应向生成HNO2的方向进行。
(4)原子利用率高。从经济和原料来源考虑,采用NO2作为制备亚硝酸的前驱体,原料价格低,副产物少,简化了分离精制过程,大幅度降低了制备成本,过程的经济效益及环境效益显著,便于实现大规模工业化。
参考文献
[1]王大为,许文林. 一种亚硝酸的制备方法[P]. 江苏省:CN113003552B,2023-06-16.
欢迎您浏览更多关于亚硝酸的相关新闻资讯信息